
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Энтропия. Физический смысл энтропии. Энтропия и вероятность.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Рассматривая КПД тепловой машины, работающей по циклу Карно, Используя первое начало термодинамики для обратимых процессов,
Выразим из уравнения Менделеева - Клапейрона
Учтём, что
Правая часть этого равенства является полным дифференциалом, следовательно, при обратимых процессах и приведённая теплота тоже является полным дифференциалом, что является признаком функции состояния. Функция состояния, дифференциалом которой является
где dS – приращение энтропии. Равенство (9-44) справедливо только для обратимых процессов и удобно для расчёта изменения энтропии при конечных процессах:
Если система обратимым путём совершает круговой процесс (цикл), то Выражая количество теплоты через приращение энтропии для элементарного процесса, и подставляя его в уравнение для первого начала термодинамики, получим новый вид записи этого уравнения, которое принято называть основным термодинамическим тождеством:
Таким образом, для расчёта изменения энтропии при обратимых процессах удобно использовать приведённую теплоту. В случае необратимых неравновесных процессов
Рассмотрим, что происходит с энтропией в изолированной термодинамической системе. В изолированной термодинамической системе при любом обратимом изменении состояния её энтропия не изменится. Математически это можно записать так: S = const.
Тогда справедливо неравенство Клаузиуса (9-47). Запишем выражение для правой части этого неравенства, соответствующее нашему примеру:
Первое слагаемое в этой формуле может быть заменено на изменение энтропии, так как этот процесс обратимый. Тогда неравенство Клаузиуса можно записать в виде:
Отсюда
Если система изолирована, то
Если же система не изолирована, то энтропия может как убывать, так и возрастать в зависимости от направления теплообмена. Энтропия как функция состояния системы, может служить таким же параметром состояния, как температура, давление, объём. Изображая тот или иной процесс на диаграмме (Т,S), можно дать математическую интерпретацию количества теплоты, как площади фигуры под кривой, изображающей процесс. На рис.9.14 приведена диаграмма для изотермического процесса в координатах энтропия – температура. Энтропия может быть выражена через параметры состояния газа – температуру, давление, объём. Для этого из основного термодинамического тождества (9-46) выразим приращение энтропии:
Проинтегрируем это выражение и получим:
Изменение энтропии можно выразить и через другую пару параметров состояния – давление и объём. Для этого нужно выразить температуры начального и конечного состояний из уравнения состояния идеального газа через давление и объём и подставить в (9-50):
При изотермическом расширении газа в пустоту Т1=Т2, а значит первое слагаемое в формуле (9-47) обнулится и изменение энтропии будет определяться только вторым слагаемым:
Несмотря на то, что во многих случаях для расчёта изменения энтропии удобно использовать приведённую теплоту, ясно, что приведённая теплота и энтропия – разные, не тождественные понятия. Выясним физический смысл энтропии. Для этого используем формулу (9-52), для изотермического процесса, при котором не изменяется внутренняя энергия, а всевозможные изменения характеристик обусловлены лишь изменением объёма. Рассмотрим связь объёма, занимаемого газом в равновесном состоянии, с числом пространственных микросостояний частиц газа. Число микросостояний частиц газа, с помощью которых реализуется данное макросостояние газа как термодинамической системы, можно подсчитать следующим образом. Разобьём весь объём на элементарные кубические ячейки со стороной d~10 –10 м (порядка величины эффективного диаметра молекулы). Объём такой ячейки будет равен d3. В первом состоянии газ занимает объём V1, следовательно, число элементарных ячеек, то есть число мест N1, которые могут занимать молекулы в этом состоянии будет равно
Число микросостояний системы, занимающей объём V1, обозначим через Г1 и определим, подсчитав число размещений NA (число Авогадро) молекул, которые содержатся в 1 моле газа, по N1 ячейкам (местам): Число микросостояний Гi, с помощью которых можно реализовать i- тое макросостояние, называется термодинамической вероятностью данного макросостояния. Термодинамическая вероятность Г ≥ 1. Найдём отношение Г2/Г1:
Для идеальных газов число свободных мест гораздо больше числа молекул, то есть N1 >>NA и N2 >>NA.. Тогда, учитывая выражение чисел N1 и N2 через соответствующие объёмы, получим:
Отсюда можно выразить отношение объёмов через отношение термодинамических вероятностей соответствующих состояний:
Подставим (9-54) в (9-53) и получим:
Формула (9-55) называется формулой Больцмана, впервые получившего её и понявшего статистический смысл энтропии, как функции беспорядка. Формула Больцмана имеет более общее значение, чем формула (9-53), то есть может быть использована не только для идеальных газов, и позволяет раскрыть физический смысл энтропии. Чем более упорядочена система, тем меньше число микросостояний, посредством которых осуществляется данное макросостояние, тем меньше энтропия системы. Рост энтропии в изолированной системе, где происходят необратимые процессы, означает движение системы в направлении наиболее вероятного состояния, которым является состояние равновесия. Можно сказать, что энтропия является мерой беспорядка системы; чем больше беспорядка в ней, тем выше энтропия. В этом заключается физический смысл энтропии.
|
||
|
Последнее изменение этой страницы: 2016-12-16; просмотров: 748; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.008 с.) |

 , можно отметить, что отношение температуры холодильника к температуре нагревателя равно отношению величин количества теплоты, отданного рабочим телом холодильнику, и количества теплоты, принятой от нагревателя. Это значит, что для идеальной тепловой машины, работающей по циклу Карно, выполняется и такое соотношение:
, можно отметить, что отношение температуры холодильника к температуре нагревателя равно отношению величин количества теплоты, отданного рабочим телом холодильнику, и количества теплоты, принятой от нагревателя. Это значит, что для идеальной тепловой машины, работающей по циклу Карно, выполняется и такое соотношение:  . Отношение
. Отношение 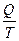 Лоренц назвал приведённой теплотой. Для элементарного процесса приведённая теплота будет равна
Лоренц назвал приведённой теплотой. Для элементарного процесса приведённая теплота будет равна 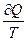 . Значит, при реализации цикла Карно (а он является обратимым циклическим процессом) приведённая теплота остаётся неизменной и ведёт себя как функция состояния, тогда, как известно, что количество теплоты является функцией процесса.
. Значит, при реализации цикла Карно (а он является обратимым циклическим процессом) приведённая теплота остаётся неизменной и ведёт себя как функция состояния, тогда, как известно, что количество теплоты является функцией процесса. и деля обе части этого равенства на температуру, получим:
и деля обе части этого равенства на температуру, получим: (9-41)
(9-41) , подставим в уравнение (9-41) и получим:
, подставим в уравнение (9-41) и получим: (9-42)
(9-42) , а
, а 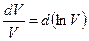 , подставим их в уравнение (9-42) и получим:
, подставим их в уравнение (9-42) и получим: (9-43)
(9-43) , (9-44)
, (9-44)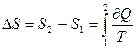 (9-45)
(9-45) , а, следовательно, DS=0, то S = const.
, а, следовательно, DS=0, то S = const. (9-46)
(9-46) , а для необратимых круговых процессов выполняется неравенство Клаузиуса:
, а для необратимых круговых процессов выполняется неравенство Клаузиуса: (9-47)
(9-47) Рассмотрим, что происходит с энтропией термодинамической системы при необратимом процессе. Предположим, что переход из состояния 1 в состояние 2 по пути L1 обратим, а из состояния 2 в состояние 1 по пути L2 – необратим (рис.9.13).
Рассмотрим, что происходит с энтропией термодинамической системы при необратимом процессе. Предположим, что переход из состояния 1 в состояние 2 по пути L1 обратим, а из состояния 2 в состояние 1 по пути L2 – необратим (рис.9.13). .
.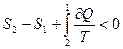 .
. . Так как
. Так как  , то окончательно можно записать:
, то окончательно можно записать: (9-48)
(9-48) , а неравенство (9-48) будет иметь вид:
, а неравенство (9-48) будет иметь вид: , (9-49)
, (9-49) то есть энтропия изолированной системы при необратимом процессе возрастает. Рост энтропии продолжается не беспредельно, а до определённого максимального значения, характерного для данного состояния системы. Это максимальное значение энтропии соответствует состоянию термодинамического равновесия. Рост энтропии при необратимых процессах в изолированной системе означает, что энергия, которой обладает система, становится менее доступной для преобразования в механическую работу. В состоянии равновесия, когда энтропия достигает максимального значения, энергия системы не может быть преобразована в механическую работу.
то есть энтропия изолированной системы при необратимом процессе возрастает. Рост энтропии продолжается не беспредельно, а до определённого максимального значения, характерного для данного состояния системы. Это максимальное значение энтропии соответствует состоянию термодинамического равновесия. Рост энтропии при необратимых процессах в изолированной системе означает, что энергия, которой обладает система, становится менее доступной для преобразования в механическую работу. В состоянии равновесия, когда энтропия достигает максимального значения, энергия системы не может быть преобразована в механическую работу. .
. (9-50)
(9-50) (9-51)
(9-51) (9-52)
(9-52) . Аналогично для второго состояния с объёмом V2 получим
. Аналогично для второго состояния с объёмом V2 получим  . Следует отметить, что изменение положений молекул соответствует новому микросостоянию. Не всякое изменение микросостояния приведёт к изменению макросостояния. Предположим, молекулы могут занимать N1 мест, тогда обмен местами любых молекул в этих N1 ячейках не приведёт к новому макросостоянию. Однако, переход молекул в другие ячейки, приведёт к изменению макросостояния системы. Число микросостояний газа, соответствующих данному макросостоянию, можно подсчитать, определив число способов размещения частиц этого газа по элементарным ячейкам. Для упрощения расчётов рассмотрим 1 моль идеального газа. Для 1 моля идеального газа формула (9-52) будет иметь вид:
. Следует отметить, что изменение положений молекул соответствует новому микросостоянию. Не всякое изменение микросостояния приведёт к изменению макросостояния. Предположим, молекулы могут занимать N1 мест, тогда обмен местами любых молекул в этих N1 ячейках не приведёт к новому макросостоянию. Однако, переход молекул в другие ячейки, приведёт к изменению макросостояния системы. Число микросостояний газа, соответствующих данному макросостоянию, можно подсчитать, определив число способов размещения частиц этого газа по элементарным ячейкам. Для упрощения расчётов рассмотрим 1 моль идеального газа. Для 1 моля идеального газа формула (9-52) будет иметь вид: (9-53)
(9-53) . Аналогично подсчитаем число микросостояний Г2 системы, занимающей объём V2:
. Аналогично подсчитаем число микросостояний Г2 системы, занимающей объём V2:  .
. .
.
 (9-54)
(9-54) . Учитывая, что отношение молярной газовой постоянной и числа Авогадро, есть постоянная Больцмана k, а также то, что логарифм отношения двух величин равен разности логарифмов этих величин, получим:
. Учитывая, что отношение молярной газовой постоянной и числа Авогадро, есть постоянная Больцмана k, а также то, что логарифм отношения двух величин равен разности логарифмов этих величин, получим:  . Отсюда можно заключить, что энтропия i- того состояния Si определяется логарифмом числа микросостояний, посредством которых реализуется данное макросостояние:
. Отсюда можно заключить, что энтропия i- того состояния Si определяется логарифмом числа микросостояний, посредством которых реализуется данное макросостояние: (9-55)
(9-55)


