
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Закон Максвелла для распределения молекул по скоростям.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Распределение большого числа молекул идеального газа, находящегося в состоянии термодинамического равновесия, по модулям скоростей подчиняется закону распределения Максвелла. Для получения дифференциального распределения Максвелла будем искать число частиц, скорости которых лежат в очень малом интервале d
где
Поскольку число частиц, даже в малых объёмах вещества, очень велико, то
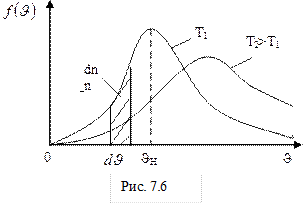
Вид дифференциального распределения Максвелла при разных значениях температуры представлен на рис.7.6. Площадь заштрихованной криволинейной трапеции численно равна доле частиц, скорости которых лежат в интервале от
В отличие от распределения Гаусса, распределение Максвелла не симметрично относительно абсциссы максимума функции распределения. Это обусловлено наличием в формуле (7-12) квадрата модуля скорости, кроме экспоненты. При малых скоростях Таким образом, распределение Максвелла – это равновесное распределение идеального газа. Оно устанавливается благодаря столкновениям молекул, которые приводят систему к тепловому равновесию. Распределение Максвелла позволяет определить несколько средних скоростей: наиболее вероятную скорость, среднюю арифметическую скорость и среднюю квадратичную скорость. Скорость Средняя квадратичная скорость определяется как квадратный корень из среднего квадрата скорости Для идеального газа, находящегося в состоянии термодинамического равновесия при температуре Т, она равна
Среднюю арифметическую скорость Для идеального газа, находящегося в состоянии термодинамического равновесия при температуре Т, она равна:
Эти скорости мало отличаются друг от друга по своим численным значениям: Экспериментально равновесное распределение частиц по скоростям было обнаружено Штерном, Истерманом и Симпсоном в 1947 году.
|
||||
|
Последнее изменение этой страницы: 2016-12-16; просмотров: 473; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.143.239.63 (0.007 с.) |

 вблизи некоторой скорости
вблизи некоторой скорости 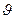 . Пусть dn – число частиц в единице объёма, скорости которых лежат в интервале от
. Пусть dn – число частиц в единице объёма, скорости которых лежат в интервале от  Это число пропорционально интервалу скоростей d
Это число пропорционально интервалу скоростей d  , а также пропорционально числу частиц в единице объёма. Можно записать так:
, а также пропорционально числу частиц в единице объёма. Можно записать так: , (7-10)
, (7-10) - плотность вероятности скорости, которая означает долю частиц в единице объёма, скорости которых лежат в единичном интервале скоростей вблизи скорости
- плотность вероятности скорости, которая означает долю частиц в единице объёма, скорости которых лежат в единичном интервале скоростей вблизи скорости 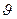 до
до  d
d  может быть найдена как
может быть найдена как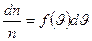 (7-11)
(7-11) имеет смысл вероятности того, что любая частица идеального газа в единице объёма имеет скорость, лежащую в интервале скоростей от
имеет смысл вероятности того, что любая частица идеального газа в единице объёма имеет скорость, лежащую в интервале скоростей от  d
d  (7-12)
(7-12) до
до  , соответствующая максимуму плотности вероятности
, соответствующая максимуму плотности вероятности  , называется наиболее вероятной скоростью. При
, называется наиболее вероятной скоростью. При  выполняется равенство
выполняется равенство  . Отсюда получаем, что наиболее вероятная скорость равна:
. Отсюда получаем, что наиболее вероятная скорость равна: или
или  (7-13)
(7-13)

 преобладает вклад
преобладает вклад  , поэтому при этих скоростях вид кривой дифференциального распределения (рис.7-6) близок к параболе, при
, поэтому при этих скоростях вид кривой дифференциального распределения (рис.7-6) близок к параболе, при  основной вклад вносит экспонента, которая убывает гораздо быстрее, чем растёт парабола. Площадь фигуры под кривой (
основной вклад вносит экспонента, которая убывает гораздо быстрее, чем растёт парабола. Площадь фигуры под кривой ( ) на рис.7.6 равна единице (условие нормировки) и выражает факт существования молекулы. При возрастании температуры увеличивается наиболее вероятная скорость, а плотность вероятности, соответствующая этой скорости, уменьшается, но площадь фигуры под кривой остаётся неизменной. Интегральное распределение Максвелла показано на рисунке 7.7. Здесь N1/N – доля частиц, скорости которых превышают скорость
) на рис.7.6 равна единице (условие нормировки) и выражает факт существования молекулы. При возрастании температуры увеличивается наиболее вероятная скорость, а плотность вероятности, соответствующая этой скорости, уменьшается, но площадь фигуры под кривой остаётся неизменной. Интегральное распределение Максвелла показано на рисунке 7.7. Здесь N1/N – доля частиц, скорости которых превышают скорость  .
. , называют наиболее вероятной скоростью. Для идеального газа, находящегося в состоянии термодинамического равновесия при температуре Т, она определяется из условия
, называют наиболее вероятной скоростью. Для идеального газа, находящегося в состоянии термодинамического равновесия при температуре Т, она определяется из условия  и связана со средней кинетической энергией поступательного движения молекул. Чтобы найти её с помощью распределения Максвелла, нужно определить отношение суммы квадратов скоростей молекул, содержащихся в единице объёма, к числу молекул в этом объёме:
и связана со средней кинетической энергией поступательного движения молекул. Чтобы найти её с помощью распределения Максвелла, нужно определить отношение суммы квадратов скоростей молекул, содержащихся в единице объёма, к числу молекул в этом объёме: 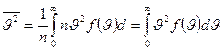 .
.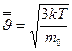 или
или  (7-14)
(7-14) определяют как отношение суммы всех скоростей всех молекул в единице объёма к числу молекул в единице объёма:
определяют как отношение суммы всех скоростей всех молекул в единице объёма к числу молекул в единице объёма:  .
. .. (7-15)
.. (7-15) .
.


