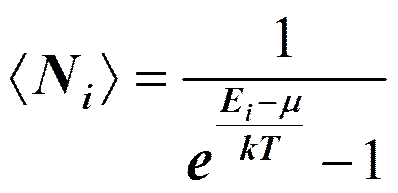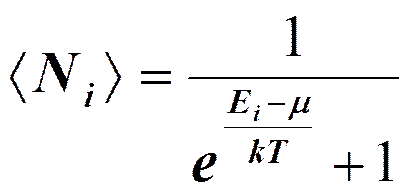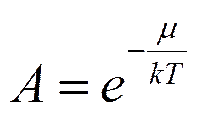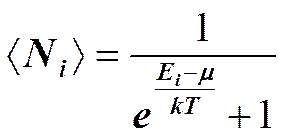Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Молекулы, химические связи. понятие об энергетических уровняхСодержание книги
Поиск на нашем сайте
Молекула — наименьшая частица вещества, состоящая из одинаковых или различных атомов, соединенных между собой химическими связями, и являющаяся носителем его основных химических и физических свойств. Химические связи обусловлены взаимодействием внешних, валентных электронов атомов. Ионная связь (например, в молекулах NaCl, KBr) осуществляется электростатическим взаимодействием атомов при переходе электрона одного атома к другому, т. е. при образовании положительного и отрицательного ионов.
Ковалентная связь (например, в молекулах Н2, С2, СО) осуществляется при обобществлении валентных электронов двумя соседними атомами (спины валентных электронов должны быть антипараллельны). Ковалентная связь объясняется на основе принципа неразличимости тождественных частиц, например электронов в молекуле водорода. Неразличимость частиц приводит к специфическому взаимодействию между ними, называемому обменным взаимодействием. Это чисто квантовый эффект, не имеющий классического объяснения, но его можно себе представить так, что электрон каждого из атомов молекулы водорода проводит некоторое время у ядра другого атома и, следовательно, осуществляется связь обоих атомов, образующих молекулу.
При сближении двух водородных атомов до расстояний порядка боровского радиуса возникает их взаимное притяжение и образуется устойчивая молекула водорода. Молекула является квантовой системой; она описывается уравнением Шредингера. Квантовая статистика.
Состояние системы невзаимодействующих частиц задается с помощью так называемых чисел заполнения Ni — чисел, указывающих степень заполнения квантового состояния (характеризуется данным набором i квантовых чисел) частицами системы, состоящей из многих тождественных частиц. Для систем частиц, образованных бозонами — частицами с нулевым или целым спином, числа заполнения могут принимать любые целые значения: О, 1, 2,.... Для систем частиц, образованных фермионами — частицами с полуцелым спином, числа заполнения могут принимать лишь два значения: 0 для свободных состояний и 1 для занятых. Сумма всех чисел заполнения должна быть равна числу частиц системы. Квантовая статистика позволяет подсчитать среднее число частиц в данном квантовом состоянии, т. е. определить средние числа заполнения <Ni>. Идеальный газ из бозонов — бозе-газ — описывается квантовой статистикой Бозе — Эйнштейна.
Это распределение называется распределением Бозе — Эйнштейна.
Здесь < Ni > — среднее число бозонов в квантовом состоянии с энергией Ei, k — постоянная Больцмана, Т — термодинамическая температура, m — химический потенциал; m не зависит от энергии, а определяется только температурой и плотностью числа частиц. Химический потенциал определяет изменение внутренней энергии системы при добавлении к ней одной частицы при условии, что все остальные величины, от которых зависит внутренняя энергия (энтропия, объем), фиксированы.
где <Ni>—среднее число фермионов в квантовом состоянии с энергией Ei, m — химический потенциал. Если е(Ei-m)/(kT)>>1, то распределения Бозе — Эйнштейна и Ферми — Дирака переходят в классическое распределение Максвелла — Больцмана:
где
Таким образом, при высоких температурах оба «квантовых» газа ведут себя подобно классическому газу. Температурой вырождения То называется температура, ниже которой отчетливо проявляются квантовые свойства идеального газа, обусловленные тождественностью частиц, т. е. Т 0 — температура, при которой вырождение становится существенным. Если T >> T 0, то поведение системы частиц (газа) описывается классическими законами. Вырожденный электронный газ в металлах Распределение электронов по различным квантовым состояниям подчиняется принципу Паули, согласно которому в одном состоянии не может быть двух одинаковых (с одинаковым набором четырех квантовых чисел) электронов, они должны отличаться какой-то характеристикой, например направлением спина. Следовательно, по квантовой теории, электроны в металле не могут располагаться на самом низшем энергетическом уровне даже при 0 К. Принцип Паули вынуждает электроны взбираться вверх «по энергетической лестнице». Электроны проводимости в металле можно рассматривать как идеальный газ, подчиняющийся распределению Ферми — Дирака. Если m0 — химический потенциал электронного газа при Т= 0К, то, среднее число < N(E)> электронов в квантовом состоянии с энергией E равно
Для фермионов (электроны являются фермионами) среднее число частиц в квантовом состоянии и вероятность заселенности квантового состояния совпадают, так как квантовое состояние либо может быть не заселено, либо в нем будет находиться одна частица. Это означает, что для фермионов < N (E)> = f (E), где f (E) — функция распределения электронов по состояниям. Из (236.1) следует, что при Т= 0К
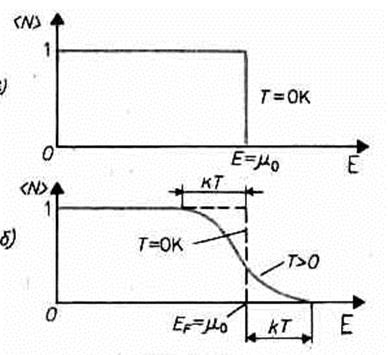
функция распределения < N (E)³1, если E <m0, и < N (E)³0, если E >m0. В области энергий от 0 до m0 функция < N (E)> равна единице. При E=m0 она скачкообразно изменяется до нуля. Это означает, что при Т=0 К все нижние квантовые состояния, вплоть до состояния с энергией E=m0, заполнены электронами, а все состояния с энергией, большей m0, свободны. Следовательно, m0есть не что иное, как максимальная кинетическая энергия, которую могут иметь электроны проводимости в металле при 0 К. Эта максимальная кинетическая энергия называется энергией Ферми и обозначается ЕF (EF=m0). Поэтому распределение Ферми — Дирака обычно записывается в виде
Наивысший энергетический уровень, занятый электронами, называется уровнем Ферми. Уровню Ферми соответствует энергия Ферми ЕF, которую имеют электроны на этом уровне. Уровень Ферми, очевидно, будет тем выше, чем больше плотность электронного газа. Работу выхода электрона из металла нужно отсчитывать не от дна «потенциальной ямы», как это делалось в классической теории, а от уровня Ферми, т. е. от верхнего из занятых электронами энергетических уровней. При температурах, отличных от 0 К, функция распределения Ферми — Дирака плавно изменяется от 1 до 0 в узкой области (порядка kT) в окрестности ЕF (рис. 312, б). В тепловом движении участвует лишь небольшое число электронов, например при комнатной температуре Т» 300 К и температуре вырождения T0=3•104 К,— это 10-5 от общего числа электронов. Если (Е-EF)>>kT тогда распределение Ферми — Дирака переходит в распределение Максвелла — Больцмана. Таким образом, при (E-EF}>>kT, т. е. при больших значениях энергии, к электронам в металле применима классическая статистика, в то же время, когда (E-EF)<<kT, к ним применима только квантовая статистика Ферми — Дирака.
|
||||
|
Последнее изменение этой страницы: 2016-12-15; просмотров: 477; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.34.93 (0.005 с.) |