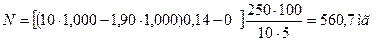Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение содержания общего азота в молоке микрометодом и Расчет по азоту количества белкаСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Органические вещества молока при нагревании с крепкой серной кислотой окисляются до углекислоты и воды, а азот переходит в сернокислый аммоний. Сернокислый аммоний переводят в аммиак, добавляя крепкую щелочь. Аммиак улавливают 0,01 н. раствором Н2 S04, находящимся в приемной колбе. Этот химический процесс можно изобразить следующими реакциями: (NH4)2 SO4 + 2NaOH = Na2 SO4 + 2H2O + 2NH3; 2NH3 +H2SO4 = (NH4)2SO4. По количеству 0,01 н. раствора Н2 SO4 (в мл), связавшейся с аммиаком, вычисляют количество азота в исходной навеске молока. При расчетах исходят из того, что 1 мл 0,01 н. H2SO4 связывает 0,14 г азота. Для вычисления содержания белка в молоке количество азота умножают на коэффициент 6,38 (получен в результате деления 100 на среднее содержание азота в белке молока). Приготовление индикатора Ташира. Приготовить два раствора: 1) 0,1 %-ный спиртовой раствор метилрота красного – в мерной колбе на 100 мл в этиловом спирте растворить 100 мг метилрота; 2) 0,1 %-ный спиртовой раствор метиленовой сини (100 мг сини растворить в этиловом спирте). Далее 40 мл 0,1 %-ного раствора метилрота смешать с 10 мл 0,1 %-ного раствора метиленовой сини. Из полученной смеси приготовить рабочий раствор путем добавления к 25 мл смеси 50 мл дистиллированной воды и 25 мл этилового спирта. Техника определения: 1. Пипеткой отмерить в колбу Кьельдаля 5 мл молока. 2. В колбу с молоком влить 20 мл концентрированной серной кислоты, смывая капли молока, если они попали на горло колбы. Добавить около 10-20 мг селена. Вставить в горло колбы воронку или стеклянную грушу. 3. В вытяжном шкафу кипятить содержимое колбы вначале на слабом огне (через асбестовую сетку), а затем на более сильном до полного 4. В остывший прозрачный раствор добавить около 50 мл воды и 5. Аммиак отгонять на аппарате (рис. 3). Перед работой через прибор необходимо пропускать пар в течение 15-20 мин Паром же обработать и приемную коническую колбу емкостью 100 мл.
Рис. 2 Аппарат для отгонки аммиака: 1 – парообразователь; 2 – трубка для отвода пара в момент перемены проб; 3 – сборник отработанной жидкости; 4 – воронка (с краном а) для заливки исследуемого раствора; 5 – сосуд для отгонки; 6 – холодильник; 7 – приемная колба; б, в – зажимы. 6. В приемную колбу на 100 мл (7) отмерить 10 мл 0,01 н. раствора H2SO4 и влить 3-5 капель индикатора Ташира. Конец трубки холодильника (6) погрузить в приемную колбу с кислотой. 7. Отмерить пипеткой 10 мл исследуемого раствора, находящегося в мерной колбе, и аккуратно влить его через воронку (4) аппарата в сосуд для отгонки (5). Ополоснуть воронку 2 раза небольшими порциями воды, а затем влить через нее же 8 мл 40 %-ного раствора NaOH и закрыть кран. Кран (а) приемной воронки закрывают каждый раз (после внесения исследуемого раствора, промывной воды и щелочи). В сосуде (5) для отгонки объем жидкости должен составлять не более 50 мл. Далее пропускают пар через сосуд для отгонки аммиака в течение 10 мин. Окончание отгонки проверяют красной лакмусовой бумажкой, на которую наносят каплю дистиллята, вытекающего из трубки холодильника. 8. После окончания отгонки конец трубки холодильника вынуть из кислоты, опустив приемную колбу, и продолжать отгонку, еще 2-3 мин. Затем конец трубки ополоснуть водой и прекратить поступление пара, зажав резиновую трубку от парообразователя зажимом (б), а зажим (в) открыть для выхода пара из парообразователя. 9. Не связанную с аммиаком серную кислоту в приемной колбе 10. Для внесения поправки на чистоту реактивов проделать контрольное определение. Для этого вместо молока взять 5 мл воды, все последующие операции выполнить так, как описано выше. Рассчитать количество азота (в мг) в 100 мл молока по формуле:
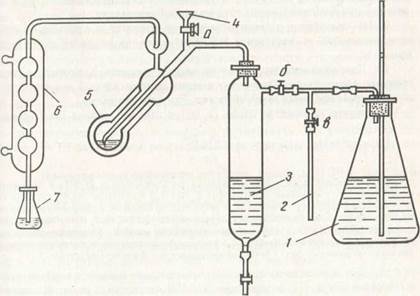
N = [(ar1 - br2) 0,14 - п ] ×
где N – количество азота в 100 мл молока (мг); а – 0,01 н. H2SО4 в приемной колбе (мл); г - поправка к титру 0,01 н. H2SO4; b ~ 0,01 н. NaOH, пошедшего на титрование (мл); г2 – поправка к титру 0,01 и. NaOH; n – поправка на реактивы, вычисленная по контрольному определению; 0,14 - азот (мг), эквивалентный 1 мл 0,01 н. H2SO4; 250 – степень разведения молока; 5 – количество молока, взятого для сжигания (мл); 10 – количество исследуемого раствора, взятого для отгонки аммиака (мл); 100 – коэффициент для пересчета на 100 мл. 11. Для пересчета на процентное содержание белков в молоке надо количество азота (г), содержащееся в 100 мл молока, разделить на его плотность и умножить на коэффициент 6,38. Пример. Рассчитать содержание белков в молоке. В приемную колбу взято 10 мл 0,01 н. HSO; поправка к титру кислоты 1,000. На титрование содержимого приемной колбы пошло 1,90 мл 0,01 н. NaOH; поправка к титру, щелочи 1,000; поправка на реактивы равна 0. Плотность молока 1,032.
или 0,5607 г азота в 100 мл молока. Содержание белков
|
||
|
Последнее изменение этой страницы: 2016-06-22; просмотров: 1159; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.62 (0.01 с.) |

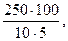 (2)
(2)