
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Расчет количества воздуха и продуктов горенияСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Минимальное количество воздуха, необходимое для полного сгорания единицы количества (кг, кмоль, м3) горючего вещества, называется теоретическим количеством воздуха (Vв0). При горении на пожарах расход воздуха отличается от теоретически необходимого. Действительный расход воздуха на единицу горючего записывается как Vв=aVв0. Множитель a называется коэффициентом избытка воздуха. Разность между действительным и теоретически необходимым количеством воздуха DVв называется избытком воздуха. Определение количества воздуха и объема продуктов горения оказывается возможным на основании закона сохранения массы по уравнениям химических реакций. При составлении уравнений материального баланса процессов горения принято учитывать не только кислород, принимающий в реакции окисления, но и азот, входящий в состав воздуха:
C6H6 + 7,5O2 + 7,5×3,76N2 = 6CO2 + 28,2N2 + 3H2O
Если состав горючего дан в весовых процентах каждого элемента из расчета на 1 кг массы, то по балансу элементарных реакций можно рассчитывать массовые расходы кислорода и количество продуктов горения. Знание плотности газов или объема 1-го кмоля (22,4 м3 при н.у.) позволяет перейти от массовых единиц к объемным: Из уравнения: H2 + 0,5O2 + 0,5×3,76N2 = H2O + 0,5×3,76N2 можно записать: 2 кг Н2 сгорают в 0,5×3,76×22,4 м3 воздуха; 1 кг Н2 сгорают в 26,7 м3 воздуха.
Общая формула для расчета Vв0 будет иметь вид:
где C, H, S и О – содержание элементов в горючем, % весовые. Если состав газообразного горючего дан в объемных процентах, то, помня закон Авогадро, что в равных объемах газов при одинаковых внешних условиях содержится одинаковое число молекул, по балансу отдельных реакций можно определить с учетом заданного объема каждого газа в 1 м3 смеси объемы воздуха, теоретически необходимые для полного сгорания каждого газа, а следовательно, и всей смеси. Например, на горение 1 м3 метана объем воздуха находят из уравнения реакции горения: CH4 + 2O2 + 2×3,76N2 = CO2 + 2H2O + 2×3,76N2;
VВ0=(2O2 + 2×3,76N2) м3 на (I м3 CH4) = 2+2×3,76 = 9,52 м3 или на I м3 CH4 расходуется 2 м3 O2, тогда Формула для расчета теоретически необходимого объема воздуха для полного сгорания 1 м3 газовой смеси имеет вид:
Если aВ>1, то избыточное количество воздуха учитывается в продуктах горения:
Коэффициент избытка воздуха при неполном сгорании рассчитывается по формуле:
а при полном Таким образом, объем воздуха, пошедший на горение, можно рассчитать, если известен состав горючего. При этом наиболее оптимальный способ расчета выбирается, исходя из способа выражения состава горючего материала. Можно решать и обратные задачи: исходя из состава продуктов горения определять количество сгоревшего вещества; находить коэффициент избытка воздуха.
Задача 1. Определить объем воздуха и продуктов горения при н.у., если при пожаре на складе сгорело 2 кг ацетона, а горение протекало при aВ=2. Решение. Из возможных способов решения задачи следует остановиться на расчете объема воздуха и продуктов горения по уравнению химической реакции, т.к. в условии задачи указана химическая формула горючего вещества (или ее можно записать по названию соединения). Следовательно, необходимо записать уравнение реакции горения ацетона в воздухе:
(CH3)2CO+4O2+4×3,76N2=3CO2+3H2O+4×3,76N2.
Определив молекулярную массу горючего, можно, составив пропорцию, рассчитать и количество воздуха, необходимое для сгорания 2 кг ацетона, а также и объем продуктов горения. Молекулярная масса ацетона 58, для горения этого количества ацетона требуется 4+4×3,76 молей воздуха, или (4+4×3,76)×22,4 м3 воздуха, т.к. объем 1 кмоля воздуха при н.у. равен 22,4 м3, тогда на горение 2 кг ацетона теоретически необходимое количество воздуха рассчитывается из выражения:
Действительное количество воздуха с учетом коэффициента избытка воздуха aВ=2 рассчитывается по выражению: VВ=2×14,7=29,4 м3, а избыток воздуха: VВ-VВ0=29,4-14,7=14,7 м3. Объем продуктов горения также определяется по уравнению реакции: из 58 кг ацетона образуется 3×22,4 м3 углекислого газа, 3×22,4 м3 водяного пара, 4×3,76×22,4 м3 азота, расчетный объем продуктов горения на 2 кг ацетона находятся из выражения:
С учетом избытка воздуха полный объем продуктов горения: VП.Г. = 16,25+14,7=30,95 м3. Примечание. Если температура в процессе горения была задана другой, то объем продуктов горения и воздуха рассчитывается с учетом объема, который занимает один кмоль газа при этой температуре:
где Po=101325 Па; Т0=273,15 К; заданные температура и давление. Задача 2. Определить объем воздуха и продуктов горения при сжигании 1 кг горючего вещества, имеющего элементный состав: С-40 %, Н-10 %, N-20%, золы-18 %, влаги-12 %; aВ=I (считать, что воздух и продукты горения находятся при н.у.). Решение. Для решения задачи необходимо было бы записать балансы элементарных реакций горения углерода, водорода с учетом процентного содержания каждого элемента в 1 кг горючего, но есть уже готовые формулы, которыми можно воспользоваться, например, объем воздуха: Объем продуктов горения рассчитывается исходя из элементного состава горючего следующим образом. Из уравнений элементарных реакций известно, что объем углекислого газа при горении 1 кг углерода составляет 1,86 м3,сернистого газа из 1 кг серы – 0,7 м3 и т.д. Но в условии задачи углерода в горючем 40 %, что составляет 0,4 кг углерода, равно
Задача 3. Газовая смесь объемом 1 м3, состоящая из 20 % ацетилена, 40 % бутана, 20 % углекислого газа и 20 % кислорода сгорает с 30 %-м избытком воздуха. Вычислить объем воздуха, принимающего участие в горении, и объем продуктов горения, если процесс протекает при н.у. Решение. Записываем уравнения горения каждого газа: C2H2+2,5O2+2,5×3,76N2 = 2CO2+H2O+2,5×3,76N2; C4H10+6,502+6,5×3,76N2 = 4CO2+5HO2+6,5×3,76N2. Углекислый газ не горит, поэтому его надо учесть только в продуктах горения, когда будем вычислять их полный объем. Рассчитываем объем воздуха, теоретически необходимый для полного сгорания газовой смеси:
Действительный объем воздуха находим, учитывая коэффициент избытка воздуха, равный 1,3: VВ = VВ0aВ=13,81×1,3=17,95 м3/м3. Избыток воздуха, который войдет в состав продуктов горения, будет: DVВ= VВ- VВ0=17,95-13,81=4,14 м3. В результате горения образовались углекислый газ и водяной пар. Из уравнения реакции видим, что при горении 1 м3 ацетилена образуется 2 м3 СО2 и 1 м3 Н2О, но в составе газовой смеси находится 0,2 м3 С2Н2, поэтому углекислого газа образуется при горении ацетилена лишь 2×0,2=0,4 м3, водяного пара 1×0,2=0,2 м3. Полный объем углекислого газа находим, учитывая количество его в горючей смеси:
=2,2 Аналогично рассчитываем объем водяного пара в продуктах горения:
В состав продуктов горения войдет избыток воздуха 4,14 м3, который состоит из 4,14×0,21=0,87 м3 кислорода и 4,14×0,79=3,27 м3 азота. Общий объем азота в продуктах горения V(N2)=2,5×3,76×0,2+6,5×3,76×0,4+3,27=14,93 м3. Тогда полный объем продуктов горения, учитывая, что в продуктах горения содержится углекислый газ, водяной пар, азот и кислород, находим следующим образом:
Примечание. Целесообразно определять раздельно в продуктах горения объемы азота и кислорода, а если потребуется, состав продуктов горения можно выразить в процентном соотношении.
|
||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 2061; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.007 с.) |

 м3/кг,
м3/кг, м3.
м3. м3/м3, где
м3/м3, где  и
и  - процентное содержание данного газа в 1 м3 газовой смеси,
- процентное содержание данного газа в 1 м3 газовой смеси,  - число молей кислорода, необходимое для полного сгорания 1 моля 1-го горючего газа. Аналогичным образом получают и формулы для расчета объемов продуктов горения.
- число молей кислорода, необходимое для полного сгорания 1 моля 1-го горючего газа. Аналогичным образом получают и формулы для расчета объемов продуктов горения. , м3.
, м3.
 ,
, , где CO2, СО, СН4 и т.д. процентное содержание каждого газа в продуктах горения; О2 – процентное содержание кислорода в продуктах горения.
, где CO2, СО, СН4 и т.д. процентное содержание каждого газа в продуктах горения; О2 – процентное содержание кислорода в продуктах горения. м3.
м3. м3.
м3. ,
, м3/кг. Тогда объем воздуха, пошедший на горение, будет:
м3/кг. Тогда объем воздуха, пошедший на горение, будет:  м3/кг.
м3/кг. . В состав продуктов горения войдут азот, углекислый газ, водяной пар с учетом влаги из горючего вещества:
. В состав продуктов горения войдут азот, углекислый газ, водяной пар с учетом влаги из горючего вещества:  м3/кг;
м3/кг; м3/кг;
м3/кг; м3/кг,
м3/кг, м3/кг.
м3/кг.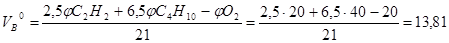 м3/м3.
м3/м3. =2×0,2+4×0,4+0,2=
=2×0,2+4×0,4+0,2= м3.
м3. м3.
м3.


