
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Расход воздуха и выход продуктов полного сгорания горючих элементов.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
При использовании абсолютного сухого атмосферного воздуха реакции полного сгорания горючих элементов имеют вид С + О2 + 3,76N2 = СО2 + 3,76N2 + Qс
2Н2 + О2 + 3,76N2 = 2Н2О + 3,76N2 + QН2 (1.17)
S + О2 + 3,76N2 = SО2 + 3,76N2 + QS
Таблица 2 - Потребное количество кислорода и выход продуктов полного горения
После подстановки получим
где С,Н, Ор, Sр – % элементов в твердом или жидком топливе Для газообразного топлива
где Н2, СО и т.д. – % горючих газов в газообразном топлива Пример 1. Определить расход воздуха для сжигания топлива, состав которого – 100 % С Весовой метод. Уравнение реакции горения С + О2 = СО2 из этой реакции следует, что 1 кг С сгорая в СО2 требует 32: 12 = 2,67 кг кислорода С этим количеством кислорода войдет азота
Следовательно, масса воздуха, приходящегося на 1 кг углерода равна, т.е. теоретический расход воздуха LО = 2,67 + 8,83 = 11,5 кг/кг При О оС и 101,3 кн/м2 это количество воздуха займет объем 11,5: 1,293 = 8,89 м3. Таким образом, потребное количество воздуха может быть выражено в весовых количествах 11,5 кг/кг и в объемных (в нормальном состоянии) 8,89 м3/кг. Молярный метод. В 100 кг С содержится 100: 12 = 8,33 моля т.к. при горении углерода на 1 моль последнего расходуется 1 моль кислорода, т.е. на 100 кг углерода потребуется 8,33 моля кислорода. С этим количеством кислорода войдет азота
всего же воздуха 8,33 + 31,34 = 39,67 моля или
39,67 . 22,4 = 888,8 м3 Следовательно, LО = 888,8: 100 = 8,89 м3кг, или же LО = 8,89 . 1,293 = 11,5 кг/кг
Следовательно, весовой и молярный методы дают одинаковые результаты. Для сжигания реального топлива расход воздуха Lα принимают больше чем теоретический расход Lо для полного сжигания топлива. Поэтому было введено понятие «коэффициент расхода воздуха» α. Коэффициент расхода воздуха представляет собой отношение действительно затрачиваемого объема воздуха на единицу топлива (L α) к теоретически необходимому (LО), т.е.
Подавляющее большинство металлургических печей работают с a = 1,05 ¸ 1,25 (1.21) Теоретически необходимый расход воздуха определяют по теоретическому расходу кислорода и объемной доли кислорода в воздухе
Подставляя значение
Для атмосферного воздуха КО2 = 0,21 и формула примет вид
Объемный теоретический расход сухого воздуха, для сжигания 1 м3 газообразного топлива определится по формуле
Так как для горения используют влажный воздух, в котором на 1 м3 сухой части содержится f г влаги или водяного пара, то расход влажного воздуха составит
Определение количества и состава продуктов сгорания При полном сгорании топлива Объем продуктов полного горения твердого или жидкого топлива складывается из СО2, Н2О, N2, SО2, О2 изб. 1. При полном сгорании твердого и жидкого топлива (при a>1) объем СО2 в продуктов сгорания определяют по формулам
где 1,867 – объем углекислого газа, полученный при полном сгорании 1 кг углерода; С – содержание углеводорода в топливе, %. 2. Объем водяных паров складывается: - из объема водяных паров, образовавшихся от сгорания 1 кг водорода топлива в количестве 22,4: 2 = 11,2 м3/кг; - из объема водяных паров, полученных в результате испарения влаги топлива – 1,242 Wр, где 1,242 – удельный объем водяного пара (м3/кг); - при сжигании жидкого топлива его предварительно распыливают воздухом или паром; если обозначить через Wср (ср-средство распыления) количество пара (в кг), расходуемое для распыления 100 кг топлива, то количество пара в продуктах сгорания увеличится на 1,242 Wср (м3/кг). Общее количество водяных паров в продуктах сгорания
3. При наличии серы в продуктах сгорания будет присутствовать сернистый газ. Из 1 кг серы получается 22,4: 32 = 0,7 м3. Следовательно,
4. Содержание азота в продуктах сгорания складывается из азота топлива 0,8 Nр, где 0,8 – удельный объем азота (22,4: 28 =0,8) м3/кг, а так же азота в воздухе
где КО2 – объемная доля кислорода воздуха. Следовательно, объем азота в продуктах сгорания
5. Объем избыточного кислорода воздуха
Общий объем продуктов сгорания (Vд) при сжигании твердого и жидкого топлива
При сжигании газообразного топлива объем продуктов сгорания определяют по формулам Объем углекислого газа
где СО, СО2 и т.д. – составляющие топлива, % (объема). На 1 м3 СО получаем 1 м3 СО2, поэтому при окислении углерода стоит коэффициент равный единице. При сгорании углеводородов СтНп количество молей СО2 в реакции получается равным количеству атомов углерода. Например, при сгорании СтНп получаем тСО 2 и т.д. Общая формула для подсчета объема углекислого газа, полученного при полном сгорании углеводородов СтНп
Аналогично подставляют объем водяного пара, полученного при полном сгорании СтНп
2. Объем водяного пара
где f т – влажность топлива, отнесенная к 1 м3 сухого газа, г/м3; fв - влажность топлива, отнесенная к 1 м3 сухого воздуха, г/м3. 3. Объем SО2
4. Объем азота
5. Объем избыточного кислорода
6. Общий объем продуктов горения
СН4 = 75 %; С2Н6 = 3 %; С3Н8 = 1 %; и СО2 = 21 % Для горения 100 молей газа приведенного состава потребное количество кислорода составит
СН4 + 2О2 = СО2 + 2Н2О 75 х 2 = 150 молей 2. для горения этана С2Н6 + 3,5О2 = 2 СО2 + 3 Н2О 3 х 3,5 = 10,5 молей 3. для горения пропана С3Н8 + 5 О2 = 3 СО2 + 4 Н2О 1 х 5 = 5 молей____ всего 165,5 молей С этим количеством кислорода поступит азота 165,5 х 3,762 = 622,6 молей, а всего воздуха 165,5 + 622 = 788,1 молей. Следовательно, Lо = 788,1: 100 = 7,881 моль/моль, или Lо = 7,881 м3/м3
Определение состава продуктов горения 1. СО2 - вносит газ 21 моль - горение метана СН4 + 2О2 = СО2 + 2Н2О 75 х 1 = 75 молей - горение этана С2Н6 + 3,5О2 = 2СО2 + 3Н2О 3 х 2 = 6 молей - горение пропана С3Н8 + 5О2 =3СО2 + 4Н2О 1 х 3 = 3 моля_ всего 105 молей 2. Н2О - горение метана СН4 + 2О2 = СО2 + 2Н2О 75 х 2 = 150 молей - горение этана С2Н6 + 3,5О2 = 2СО2 + 3Н2О 3 х 3 = 9 молей - горение пропана С3Н8 + 5О2 =3СО2 + 4Н2О 1 х 4 = 4 моля_ всего 163 моля
3. Воздух вносит азота 622,6 моля Всего продуктов горения Vд = 105 + 163 + 622,6 = 890,6 моля Количество продуктов горения, образующихся на 1 м3 газа составит Vд = 890,6: 100 = 8,906 м3/м3
Температуры горения топлива
Под температурой горения понимают ту температуру, которую приобретают продукты сгорания в результате сообщения им тепла, выделяемого при сжигании. Различают адиабатную и действительную температуру горения. Адиабатной называется температура, которую приобретают продукты сгорания в адиабатных условиях, т.е. без теплообмена с окружающей средой. Действительной называется температура, которую приобретают продукты сгорания в реальных условиях сжигания. Различают три адиабатные температуры: жаропроизводительность (по Д.И.Менделеееву), калориметрическая и теоретическая температуры. Рассмотрим адиабатную оболочку, в которой находится 1 м3 газа или 1 кг жидкого топлива, или 1 кг твердого топлива. Внутри адиабатной оболочки находится стехиометрическое количество воздуха Lо, При подсчете жаропроизводительности принимают температуру топлива и воздуха равную 0 оС. Составим уравнение теплового баланса. С одной стороны в адиабатной системе выделяется
На основании теплового баланса
Из этого выражения следует, что максимальная температура, которую приобретают продукты горения, равна
где Vп.г - объем продуктов полного горения, полученный при cтехиометрическом сжигании топлива, м3/м3, м3/кг;
кДж/м3 К, кДж/кг К. Полученная температура была названа Д.И.Менделеевым жаропроизводительностью топлива. Полученную максимальную температуру в развернутом виде можно записать
Величина жаропроизводительности различных индивидуальных газов приведены в таблице 3. Таблица 3 - Жаропроизводительность различных горючих газов
Если при расчете температуры адиабатного горения учитывается подогрев воздуха и газа, то полученная температура называется калориметрической. Тепловой баланс горения имеет вид
из которого следует
где Qф.в . - физическое тепло подогретого воздуха, МДж/м3; Qф.т - физическое тепло подогретого газа или жидкого топлива, МДж/м3. Величину Qф.в . и Qф.г можно вычислить по формулам
где α - коэффициент расхода воздуха Lо - теоретический расход воздуха, м3/м3;
кДж/м3 К;
кДж/м3 К; tг, tв – температуры подогрева газа и воздуха Величину Qф.в . и Qф.г можно записать и через энтальпии
Тогда tк можно записать в виде
Если левую и правую часть уравнения умножить на
Можно записать в виде Вычислить tк по представленным формулам невозможно, т.к. в формулу входит величина Спг, которая зависит от этой tк. Определяют tк двумя методами: 1) методом инерций; 2) графическим методом построения зависимости hп.г = f (t). В соответствии с методом итераций задаемся калориметрической температурой t'к и вычисляем калориметрическую энтальпию h'к. Сравниваем hк и h'к. Если окажется, что h'к > hк, то следовательно принятая температура t'к завышена. Принимаем следующую температуру t''к на 100 о ниже, чем предыдущая и вновь рассчитываем h''к и сравниваем с hк. Необходимо достичь, чтобы hк находилась между h'к и h''к, тогда и калориметрическая температура будет находиться в диапазоне t'к и t''к. Калориметрическую температуру можно определить по интерпаляционной формуле
Калориметрическую температуру можно определить графическим путем. Для этого необходимо построить зависимость
где продуктов горения СО2, Н2О и т.д. – процентное содержа- ние указанных компонентов в продуктах горения. Затем вычисляется калориметрическая энтальпия продуктов горения
Откладывая hк на оси ординат hпг, проводится прямая параллельная оси абсцисс до пересечения с кривой энтальпии и из этой точки опускается на ось абсцисс, где и отмечается tк. Калориметрическая температура рассчитывается из условий адиабатности и необратимости. В действительности реакции являются обратимыми и при температурах выше 1800 оС эндотермические реакции начинают оказывать ощутимое влияние. Адиабатическая температура, которая учитывает диссоциацию продуктов горения называется теоретической. До температуры 2200 оС считается, что частичной диссоциации подвергаются только СО2 и Н2О СО2 Н2О Продукты горения в этом случае состоят из СО – СО2 – Н2 - Н2О – N2 При подсчете температуры в печи при сжигании газов с высокой температурой сгорания, особенно при подогреве воздуха и газа, необходимо считаться с понижением температуры вследствие диссоциации продуктов сгорания
где Расчет теоретической температуры весьма трудоемкий, поэтому воспользуемся с достаточной для технических расчетов степенью точности зависимостями в области температур до 2200 оС: Величина φ равна: 1900 - 2000 оС Þ φ = 0,96 2000 - 2100 оС Þ φ = 0,945 2100 - 2200 оС Þ φ = 0,93 При температуре выше 2200 оС происходит более глубокая диссоциация продуктов горения СО2 Н2О Н2 О2 ½N2 + ½ О2 Действительная температура горения tд соответствует реальным условиям сжигания и потерь тепловой энергии в печи
где qпот – потеря тепловой энергии в результате горения в реальных условиях, отнесенная к 1 м3 или 1 кг сжигаемого топлива При рассмотрении понятия tд имеется в виду и теплопередача газов при этой температуре. В связи со сложностью расчетов tд из-за qпот и qдисс было предложено использование пирометрического коэффициента ηпир. Отношение действительной температуры горения к калориметрической называется пирометрическим коэффициентом.
Средние значения пирометрических коэффициентов для различных печей приведены в таблице 4. Таблица 4- Средние значения пирометрических коэффициентов
Значение ηпир колеблется в пределах 0,6-0,85 для нагревательных печей. ηпир является эмпирической величиной, но можно вычислить и по формуле
где ε – КПД топочного процесса, доли единицы; qпот и qпол - величина отдачи тепла продуктами сгорания нагреваемому материалу (полезная отдача) и различного рода потери.
|
||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-18; просмотров: 1023; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.169 (0.009 с.) |

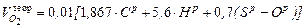 , м3/кг (1.18)
, м3/кг (1.18)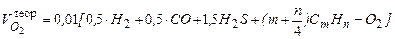 , (1.19)
, (1.19)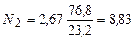 кг
кг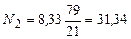 моля
моля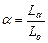 (1.20)
(1.20)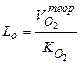 (1.22)
(1.22) из формулы (1.18), то получим теоретический объемный расход сухого воздуха для сжигания 1 кг твердого или жидкого топлива
из формулы (1.18), то получим теоретический объемный расход сухого воздуха для сжигания 1 кг твердого или жидкого топлива м3/кг (1.23)
м3/кг (1.23) , м3/кг (1.24)
, м3/кг (1.24) Для атмосферного воздуха КО2 =0,21 и формула примет вид
Для атмосферного воздуха КО2 =0,21 и формула примет вид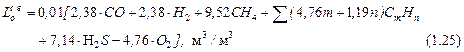
 м3
м3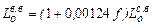 , м3/ед.топлива (1.26)
, м3/ед.топлива (1.26)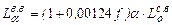
 = 0,01. 1,867 С, м3/кг,
= 0,01. 1,867 С, м3/кг, , м3/кг (34)
, м3/кг (34) = 0,01.0,7.Sр
= 0,01.0,7.Sр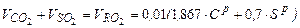 , м3кг
, м3кг
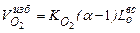 , м3/м3
, м3/м3 (1.27)
(1.27) ,м3/м3
,м3/м3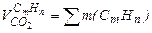

 , м3/м3
, м3/м3 , м3/м3
, м3/м3 , м3/м3
, м3/м3 , м3/м3
, м3/м3 Пример 2 Определить расход воздуха и выход продуктов сгорания для сжигания 1 м3 газа следующего состава
Пример 2 Определить расход воздуха и выход продуктов сгорания для сжигания 1 м3 газа следующего состава . С другой стороны количество теплоты, которое пошло на нагрев продуктов горения V пг составляет
. С другой стороны количество теплоты, которое пошло на нагрев продуктов горения V пг составляет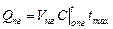

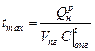 , оС
, оС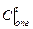 - средняя объемная теплоемкость продуктов горения,
- средняя объемная теплоемкость продуктов горения, , оС (1.29)
, оС (1.29)
 , (1.30)
, (1.30) ,
, - средняя объемная теплоемкость подогретого воздуха
- средняя объемная теплоемкость подогретого воздуха - средняя объемная теплоемкость подогретого газа
- средняя объемная теплоемкость подогретого газа


 (1.31)
(1.31)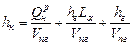
 , оС
, оС продуктов горения по формуле
продуктов горения по формуле ,
, и т.д. – энтальпия соответствующих компонентов
и т.д. – энтальпия соответствующих компонентов
 СО +½ О2 - Qдисс
СО +½ О2 - Qдисс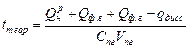 , (1.32)
, (1.32) - теплота диссоциации продуктов сгорания, образующихся при сгорании 1 кг или 1 м3 топлива, кДж/кг, кДж/м3.
- теплота диссоциации продуктов сгорания, образующихся при сгорании 1 кг или 1 м3 топлива, кДж/кг, кДж/м3.
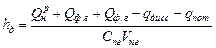 , (1.33)
, (1.33) (1.34)
(1.34)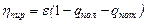 , (1.35)
, (1.35)


