
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Нефтяные, газонефтяные и нефтепродуктовСодержание книги
Поиск на нашем сайте Пожары и взрывы представляют собой явления, в результате которых исходное вещество переходит в качественно новое состояние. Схожесть этих процессов заключается в преобразовании энергии межмолекулярных или межатомных связей в энергии меньшего уровня, принимающие форму тепловой и кинетической, и образовании веществ, плотность которых гораздо меньше первоначальной. Понять сущность процессов, лежащих в основе опасных явлений пожаров и взрывов, позволит классификация, представленная на схеме 1.5. Как видно из рис.1.5, процессы, лежащие в основе пожара, только химические, а для взрывов – и химические, обусловленные реакцией окисления, и физические. При этом для пожаров характерны только диффузионные реакции, а для взрывов газопаровоздушных (ГПВС) и пылевоздушных смесей (ПЛВС) только кинетические. Разберем последовательно эти главные отличительные особенности. Обычно под горением принято называть самоускоряющееся быстрое химическое превращение, сопровождающееся интенсивным выделением тепла и света. Это определение не универсально. Существует целый класс химических реакций, протекающих с так называемым холодным пламенем и с умеренной скоростью. Однако холодное пламя возникает лишь в особых условиях и интересует лишь постольку, поскольку возможен его переход в обычное горячее пламя. Соответственно пламенем (горячим) называется газообразная среда, в которой интенсивная химическая реакция приводит к свечению, выделению тепла и саморазогреву. Обычно горением называют быстрое окисление кислородом (содержащимся в воздухе или чистым) горючих – угля, жидких нефтяных продуктов, газообразных углеводородов и т.д. Однако химические превращения, соответствующие понятию горения, не ограничиваются процессами соединения с кислородом. В горючих смесях различают горючее и окислитель. Окислителем при горении могут быть также окислы азота, галоиды, озон. Кроме того, известны процессы горения, в которых участвует только один исходный продукт, способный к быстрому распаду, например ацетилен (С2Н2), гидразин (N2H4), взрывчатые вещества, пороха. Такие соединения всегда бывают эндотермическими. Процессы их горения осуществляются за счет теплового эффекта реакции разложения или, как у взрывчатых веществ, внутреннего самоокисления сложной молекулы. Таким образом, взрывчатые вещества (ВВ) можно разделить на несколько групп.
Схема 1.5. Классификация процессов протекания реакций при пожарах и взрывах Прежде всего, можно выделить вещества, у которых каждая молекула содержит в себе все необходимое для взрыва. Молекулу таких взрывчатых веществ можно представить в виде двух активных групп атомов, разделенных малоактивной перегородкой. Такой перегородкой являются обычно атомы азота, который сам мало активен в химическом отношении (рис.1.10).
При повышении температуры ВВ соответственно увеличивается скорость движения его молекул. Это приводит к увеличению силы молекулярных соударений. В результате достаточно сильных соударений молекулы ВВ разрушаются. Активные атомные группы освобождаются, неактивные атомные преграды, имевшиеся между ними, выбиваются и удаляются. Активные группы приходят во взаимодействие друг с другом и из них образуются достаточно подвижные, имеющие большую скорость и несущие на себе значительную энергию молекулы взрывных газов. Эти газы быстро расширяются и передают среде, окружающей место взрыва, энергию своих молекул.
Другая группа ВВ – смеси частиц, состоящих из различных молекул. Частицы представляют собой горючее вещество, способное сгорать, соединяясь с кислородом. Необходимый для достаточно быстрого сгорания кислород не может быть получен в таких условиях из окружающей атмосферы. Это обусловлено слишком малой концентрацией атмосферного кислорода. Поэтому при взрыве необходимо обеспечить обильное выделение кислорода внутри ВВ. С этой целью в состав вводятся частицы, молекулы которых разлагаются при нагревании и выделяют из своего состава кислород, который быстро соединяется с горючим материалом; температура при этом резко повышается. В результате горения образуются продукты сгорания, которые находятся в газообразном состоянии и быстро расширяются. Это и обусловливает действие взрыва на окружающую среду (рис.1.11).
Примером ВВ, являющихся смесями, можно считать оксиливиты. Эти ВВ представляют смесь твердого горючего (например, древесных опилок) с жидким кислородом. Этот же механизм окисления горючих компонентов, но кислородом, взятого из воздуха, лежит в основе кинетических реакций горения газо- и пылевоздушных смесей, а горючими компонентами в ГПВС являются молекулы углеводородов, в ПЛВС – ее твердые мелкодисперсные частицы. Однако обязательным условием должно быть хорошее предварительное «перемешивание» горючих компонентов с молекулами воздуха в отношении достаточном для сгорания. Окисление углеводородов. Механизм этих процессов очень сложный. Характерная особенность реакции – ее многостадийность, ступенчатый переход от углеводорода к конечным продуктам полного сгорания (СО2 и Н2О при избытке кислорода в смеси). Как уже отмечалось, энергия, выделяемая при реакции, связана с разрывом имеющихся связей компонентов одной системы в другую и образованием новых молекулярных связей другой системы. Необходимость активации при химическом превращении обусловлена затратой энергии на разрыв старых, существующих межатомных связей, и процесс активации предшествует перегруппировке атомов в реагирующих молекулах, т.е. химической реакции. Реакция возможна лишь в том случае, если взаимодействующие молекулы получают определенный запас энергии, достаточный для разрыва или ослабления межатомных связей. Активация заключается в переходе молекул в такое состояние, в котором становится возможным химическое превращение. Разность среднего запаса энергии молекул в активном и неактивном состояниях называется энергией активации. Активация молекул необходима не только при эндотермических реакциях, но и при экзотермических. В последнем случае (а он специфичен для всех процессов горения) образующиеся при реакциях молекулярные связи прочнее старых, ранее существующих, и новая система компонентов энергетически более устойчива. Казалось бы, переход в энергетически более устойчивую систему должен протекать самопроизвольно. Механизм химической реакции во многом аналогичен спуску салазок с горки, когда перед началом спуска имеется незначительный бугорок (рис.1.12). Этот бугорок есть суть препятствия термодинамического превращения, которое заключается в необходимости первоначального разрыва или ослаблении ранее существующих межатомных связей, хотя новые связи в образующихся продуктах окажутся прочнее старых и при их возникновении освободится большее количество энергии, чем затраченное на первом этапе. Энергия активации равна сумме энергии активных центров – молекул вещества, способных к химической реакции, в ходе которой могут возникать промежуточные (добавочные) активные центры, может уже выделиться часть энергии, которая поглотится веществом и облегчит процесс горения. Такой ступенчатый процесс лежит в основе реакций с разветвленным цепным механизмом и имеет автокаталитический характер. В процессе реакции молекулы сталкиваются между собой. Если бы все столкновения приводили к реакции, то горение протекало бы мгновенно. В действительности горение протекает с конечной скоростью, это означает, что не все сталкивающие молекулы способны к реагированию, а лишь активные молекулы (центры активации), которые образуются из нормальных в результате их нагрева (подвода энергии активации), т. е. повышения их энергии.
Разветвления цепей часто явственно вырождены, т.е. добавочные активные центры образуются из промежуточных продуктов после длительной задержки. Содержание активных центров здесь также значительно превосходит равновесное. При умеренных температурах в качестве побочных продуктов образуются альдегиды и перекиси. Они отличаются более высокой реакционной способностью, чем исходные углеводороды, с их участием происходят вырожденные разветвления. При высоких температурах возможно образование радикалов C2 и СН. В начальной стадии реакции окисления углеводородов ее механизм в известной степени сходен с механизмом окисления водорода. Углеводород RH (R – углеводородный радикал) взаимодействует с активными центрами по уравнениям: OH+RH=Н2О+R; (1.1) О+RH=OH+R. (1.2) Радикал R∙ может реагировать с кислородом по реакции, аналогичной образованию воды: ОН+Н2=Н2О+Н, (1.3) R+O2=RO+О с А=30 ккал/моль. (1.4) Помимо большой сложности процесса и многообразия продуктов реакции, окисление углеводородов отличается от окисления водорода и некоторыми особенностями аналогичных элементарных процессов. Энергия активации реакции (1.4) больше, чем у реакции разветвления атомарного водорода (1.5) с энергией активации 18 ккал/моль, и она образует два новых активных центра: Н+О2=ОН+О с А=18 ккал/моль (1.5) и достигает 30 ккал/моль. Поэтому такой механизм разветвления цепи (1.4) менее вероятен, чем у водорода (1.5), особенно при умеренных температурах, и при этом превалируют вырожденные разветвления, т. е. такие, в которых участвуют более стабильные продукты. Реакция, ведущая к образованию перекиси: R∙+О2=RO2, (1.6)
протекает бимолекулярно. Промежуточные продукты – альдегиды, перекиси RO2 и гидроперекиси RO2H могут вступать в реакции расщепления, которые играют здесь столь же существенную роль, как и окислительные реакции. Особенность окисления газообразных, жидких и твердых горючих веществ. Горючее вещество и окислитель составляют горючую систему. Источник воспламенения вызывает в ней реакцию окисления. При установившемся горении источником воспламенения служит тепло зоны реакции. Горючие системы могут быть однофазными (гомогенными) и неоднофазными (гетерогенными). К гомогенным относятся газообразные системы, в которых горючие вещество и окислитель перемешаны друг с другом, например смесь пропана с воздухом. К неоднородным относятся системы, в которых горючее вещество и окислитель находятся в разных фазах и отделены друг от друга поверхностью раздела, например, горючие материалы и жидкости, находящиеся в соприкосновении с воздухом или струи газов, поступающие в воздух. При горении гетерогенных горючих систем, кислород, для того чтобы вступить в реакцию с горючим веществом, должен продифундировать через область пространства, занятую смесью воздуха и продуктов горения. Горение всех видов газов, жидкостей и твердых веществ на пожарах, за исключением некоторых ВВ и пиротехнических изделий, является диффузионным, т. е. когда скорость химической реакции определяется скоростью диффузии кислорода в зону реакции, причем скорость реакции горения не зависит от природы горючего. При горении гомогенных горючих систем, в которых окислитель и горючее вещество находятся в одной фазе, диффузионные явления обычно роли не играют. В этом случае горение зависит только от скорости химической реакции и называется кинетическим, т.е. предварительно перемешанным. Скорость кинетического горения смесей значительно превышает скорость диффузионного горения горючих веществ и в замкнутом объеме представляет взрыв. Диффузионное горение. Как уже отмечалось, реакции этого типа характерны для горения всех видов жидкостей, твердых веществ на пожарах. Горение при истечении газов и испарении жидкостей в атмосферу характеризуется наличием пламени. Пламя представляет собой светящуюся газовую оболочку, в которой происходит экзотермическая реакция газообразных продуктов разложения с окислителем. Пламя может возникнуть при горении веществ, находящихся в любом агрегатном состоянии. Для газообразных систем весь процесс горения протекает в пламени, поэтому понятия «горение» и «пламя» часто используются как синонимы. При горении конденсированных систем часть физико-химических превращений (нагревание, плавление, испарение, разложение, взаимодействие реагентов) может происходить вне пламени, непосредственно в образце и на его поверхности. Пламенное горение веществ и материалов обусловливается тем, что они выделяют горючие газы в количествах, соответствующих концентрационному пределу воспламенения. Пламя или его часть характеризуется видимым излучением, хотя известно и прозрачное пламя. Образующееся светящееся пламя излучает довольно большое количество энергии, что играет важную роль в распространении огня. Сила излучения светящегося пламени позволяют судить о радиационной (лучистой) силе, составляющей от общей выделяемой химической энергии напалма 30-40 %, пламя угарного газа около 25%, пламя ацетилена 28,2% в видимой и 6,9% несветящейся части. По характеру движения потоков окислителя и горючего различают ламинарное пламя и турбулентное. В зависимости от размеров потока горючих паров и газов и режима его движения различают: ламинарное диффузионное пламя (диффузионное пламя в ламинарном потоке); турбулентное пламя (диффузионное пламя в турбулентном потоке).
Ламинарное диффузионное пламя возникает при небольших размерах потока паров или газов, движущихся с небольшой скоростью (пламя спички, свечи, пламя с небольшим диаметром). Оно наиболее широко изучено и многие положения его теории применяются для объяснения турбулентного пламени, которое трудно поддается изучению. Теория ламинарного диффузионного пламени впервые была предложена С. Бурке и Т. Шуманом в 1928 г. Строение ламинарного (и распределение концентраций газов и паров) диффузионного пламени горения жидкости в сосуде небольшого диаметра показано на рис.1.13. Пламя состоит из зоны горения 1 и зоны паров 2, которая занимает почти весь объем пламени. Подобное по строению пламя образуется также при горении газов и твердых веществ, если движение газов и паров происходит в ламинарном режиме, для которого характерно формирование свободно восходящей конвективной струи продуктов сгорания, в которой критерий Рейнольдса (Re) возрастает с увеличением расстояния от поверхности горючего материала. На некоторой высоте происходит срыв ламинарного потока и переход его в турбулентный. Критическое значение критерия Рейнольдса составляет 150, что примерно в 10 раз меньше обычно принятого значения. Турбулизация является следствием естественной конвекции. Взаимодействие поднимающихся в поле силы тяжести нагретых газов с окружающей средой усиливает эффект турбулизации. Чем больше очаг горения, тем сильнее наблюдается возмущение. Зона горения, или фронт пламени 1, в диффузионном пламени представляет очень тонкий слой, в котором протекает реакция горения. Превращение веществ в этом слое вызывает возникновение молекулярной диффузии в прилегающих к нему слоях воздуха и горючего. Движущей силой молекулярной диффузии является стремление к выравниванию концентраций, участвующих в горении газов и паров вследствие градиента концентрации. Выделение тепла в зоне реакции и появление градиента температур вызывает тепловые потоки. Горение твердых веществ. Горение твердых веществ может быть пламенным и беспламенным. Если твердые вещества при горении выделяют летучие, то при их горении возникает пламя. Твердые вещества, которые при горении не дают летучих, горят без пламени. В этих процессах отсутствует стадия перехода горючего в газовую фазу. Горючее вещество сгорает по мере диффузии и возникновения контакта воздуха с твердым веществом. В случае горения газов и пламенного горения веществ происходит взаимодиффузия воздуха и горючего, поэтому этот вид пламени называется диффузионным. Типичным примером диффузионного пламени является пламя свечи, пламя возникающее при горении дров, каменного угля, или пламя при горении распыленного топлива, широко используемое в промышленных печах и различных двигателях. В отличие от горения газов механизм горения твердых веществ и материалов характеризуется многостадийностью и включает совокупность различных физико-химических процессов (фазовых переходов, термо-окислительное разложение и др.), в результате которых исходное вещество превращается в нагретые до высокой температуры продукты сгорания. Все горючие вещества (согласно ГОСТ 12.1.044-84 к твердым веществам и материалам относятся те, которые имеют температуру плавления или каплепадения более 50˚С) подразделяются на два класса: безгазовые и газофицирующие при горении. К веществам и материалам 1-го класса, не образующим при горении газообразных продуктов, могут быть отнесены различные термитные смеси, продуктами сгорания которых являются нелетучие конденсированные вещества – окислы металлов. Подавляющее большинство твердых веществ и материалов относится ко 2-му классу. Горение твердых веществ и материалов происходит в диффузионном режиме, причем его скорость определяется не кинетикой происходящих в пламени реакций, а скоростью подвода к нему исходных реагентов. Основными процессами, обусловливающими их подвод в зону пламени, являются диффузия и конвекция. Если при разложении твердого материала выделяется недостаточное количество горючих паров и газов, то наблюдается горение без пламени – непосредственно на поверхности (процесс тления). Характеризующаяся такими условиями горения частичка материала называется искрой. Ее температура, зависящая от свойств материала и условий нагрева, достигает 1500˚С и выше. Таким образом, при пожаре в результате диффузионного окислительного процесса формируются опасные факторы: плотность теплового излучения пламени (Вт/м2), прогрев окружающей среды в ближней зоне пожара и повышение ее температуры (˚С), снижение концентрации кислорода в воздухе вследствие его расхода на горение (% об.), изменение состава воздуха поступлением продуктов сгорания: оксида углерода – СО (% об.), диоксида углерода – СО2 (% об.), образование зоны задымления (г/м3). Кроме этих основных факторов при пожаре с участием полимерных материалов могут образовываться токсичные продукты (г/м3). Кинетическое горение. Этот тип реакции характерен для газовых смесей, предварительно перемешанных с окислителем и, как отмечалось выше, для таких смесей скорость диффузионного горения существенной роли не играет, т.к. ее параметр значительно ниже скорости кинетической. Газо- и паровоздушные смеси при поджигании горят послойно: зона горения перемещается в пространстве, происходит распространение пламени. Скорость перемещения в пространстве по горючей среде определяет интенсивность процесса горения и является его важнейшей характеристикой. Процесс распространения пламени по горючей газовой среде, при котором самоускоряющаяся реакция возникает в реагирующем слое вследствие разогрева путем теплопроводности от соседнего слоя продуктов реакции, принято называть дефлаграцией. Узкая зона, в которой происходит химическая реакция, называется фронтом пламени. Толщина фронта пламени при 101,3 кПа (нормальном атмосферном давлении) обычно не превышает нескольких десятых миллиметра. Поэтому его можно считать поверхностью, разделяющей холодную горючую смесь и нагретые продукты реакции. На каждой единице поверхности фронта в единицу времени сгорает одно и то же количество вещества горючей смеси. С увеличением поверхности пламени возрастает количество вещества, сгорающего в единицу времени. Расширение газа при сгорании вследствие нагревания приводит к тому, что несгоревшая среда будет оттесняться на периферию, перемещение пламени будет происходить равномерно во все стороны. При перемещении плоского участка фронта по горючей смеси его новое положение параллельно исходному и распространение невозмущенного пламени произвольной формы происходит в каждой точке фронта по нормали к его поверхности. Такое горение называется нормальным (от слова нормаль), а скорость перемещения пламени по неподвижной горючей среде вдоль нормали к его поверхности – нормальной скоростью пламени иn. Следовательно, величина поверхности фронта пламени и его форма являются важнейшими факторами, определяющими интенсивность суммарного процесса. Скорость распространения пламени (скорость потока при неподвижном пламени) может изменяться в широком диапазоне при соответствующем изменении формы пламени. Однако в большинстве кинетических (перемешанных) газопаровоздушных смесях (ГПВС) распространение пламени по исходной свежей смеси происходит сравнительно низкой скоростью. В самоподдерживающей волне дефлаграционного горения, фронт реакции которого продвигается по горючей смеси благодаря теплопроводности и конвекции в направлении от сгоревшего газа к несгоревшему, не происходит повышения давления, обусловленного ускорением реакции. Наблюдающееся в этом случае в замкнутом объеме повышение давления носит пространственно равномерный характер и является в основном результатом роста температуры. Такое повышение среднего давления для типичных углеводородно-воздушных смесей может достигать 0,6 – 0,8 МПа (т.е. превышает нормальное атмосферное давление в 6 – 8 раз), что в условиях замкнутого объема может привести к разрушению ограждающих очаг горения конструкций. Ускорение пламени при ограничении возможности его свободного распространения, как при распространении от точечного источника поджигания в неограниченном пространстве и имеющего фронт в форме сферической поверхности, связано с изменением его формы внешними факторами. Так, если заставить распространяться фронт пламени в зауженных пространствах (вытянутых помещениях, трубах), то за одинаковое время реакции горения образуется объем сгоревшего газа, эквивалентный объему при свободном распространении, но площадь фронта горения, зажатого между ограничивающими поверхностями, будет существенно меньше сферической поверхности. Тогда соответствие равенства объемов может быть только в случае увеличения скорости его образования для пламени с поверхностью меньшей площади. Это условие вытекает из закона площадей Имеется еще один фактор увеличения скорости распространения пламени – турбулизация, т.е. возникновение неупорядоченных движений отдельных объемов газа, завихрений и отклонение площади фронта горения в сторону увеличения. При этом в зону реакции будут вовлечено большее количество смеси, тем самым повысится интенсивность процесса в целом. Таким образом, различные режимы дефлаграционного (недетанационного) горения отличаются скоростью распространения пламени в связи с неодинаковым развитием поверхности его фронта. Достаточно быстрое сгорание, при котором скорость равна нескольким сотням метров в секунду при заметной турбулизации горения, часто называют взрывом. Следует подчеркнуть условность такой классификации: «медленное» горение отличается от «взрыва» только величиной поверхности пламени, а значит и его скоростью, граница между обоими режимами устанавливается произвольно. Оценка режима горения характеризуется скоростью, при этом принято считать, что если число Маха (отношение скорости горения к скорости звука в воздухе) менее 0,1 – дефлаграционный режим, более 0,6 – 0,7 – детонационный (взрывной), от 0,1 до 0,6 – смешанный (промежуточный). Закономерностью дефлаграционного горения является то, что пламя распространяется по горючей среде путем послойной передачи поджигающего импульса в результате молекулярной теплопроводности. При условиях, рассмотренных выше – заужение пространства и турбулентность, нарастание скорости вызывает распространение в пространстве зоны быстрой химической реакции, при которой каждый последующий слой газа нагревается не теплопроводностью, а путем быстрого сжатия, достаточно интенсивного, чтобы довести реагирующую среду до состояния адиабатического воспламенения. Такой механизм горения нагревания сжатием именуется детонацией. При этом возникают взрывные и детонационные волны, распространяющиеся по невозмущенной горючей среде, как бы опережая химический процесс горения, сжимая горючую смесь и вызывая ее воспламенение. Скорость распространения взрывных волн менее 300 м/с, а детонационных – значительно большие скорости звука. Сильный разрушительный эффект взрыва обуславливается влиянием ударной волны, формирующейся вследствие быстрого расширения газа и высокоскоростного обтекания встречающихся препятствий. Ударные волны, наряду с вышеуказанным случаем перехода дефлаграционного в детонационный режим горения возникают, например, при срабатывании клапанных устройств, резком открытии вентилей, прорывах мембран, создающих условия для быстрого соединения полостей с газами, находящимися под различными давлениями. Если ударному сжатию подвергается горючая смесь, может наблюдаться ее воспламенение. Таким образом, детонация – разновидность процесса взрыва, в ходе которого возникает мощная, самоподдерживающая, сверхзвуковая волна, сжимающая вещество до такой степени, что в месте ее прохождения начинается химическая реакция, сопровождаемая выделением значительного количества энергии. Наблюдаемый очень сильный разрушительный эффект является результатом образующейся ударной волны, не требующей препятствий для своего развития. Так при детонационном распространении пламени в трубопроводе максимальные скорости могут достигать значений до 3000 м/с. Скорость распространения пламени существенно зависит от вида горючей смеси и условий его распространения. Так при сравнительных испытаниях получены следующие скорости распространения пламени: для метановоздушной смеси – 137 м/с на расстоянии 10,6 м от источника зажигания; для пропановоздушной смеси – 149 м/с на 10,6 м; для водородно-воздушной смеси – 2134 м/с на расстоянии 15 м. Конденсированные взрывчатые вещества. Под конденсированными взрывчатыми веществами (КВВ) понимаются химические соединения или смеси, находящиеся в твердом или жидком состоянии, которые под влиянием определенных внешних условий способны к быстрому самораспространяющемуся химическому превращению с образованием сильно нагретых и обладающих большим давлением газов, которые, расширяясь, производят механическую работу. Такое химическое превращение ВВ принято называть взрывчатым превращением. Взрывчатое превращение в зависимости от свойств взрывчатого вещества и вида воздействия на него может протекать в форме взрыва или горения. Взрыв распространяется по взрывчатому веществу с большой переменной скоростью, измеряемой сотнями или тысячами метров в секунду. Процесс взрывчатого превращения, обусловленный прохождением ударной волны по взрывчатому веществу и протекающий с постоянной (для данного вещества при данном его состоянии) сверхзвуковой скоростью, называетсядетонацией. В случае снижения качеств ВВ (увлажнение, слеживание) или недостаточного начального импульса детонация может перейти в горение или совсем затухнуть. Такая детонация заряда ВВ называется неполной. Горение КВВ — процесс взрывчатого превращения, обусловленный передачей энергии от одного слоя взрывчатого вещества к другому путем теплопроводности и излучения тепла газообразными продуктами. Процесс горения ВВ (за исключением инициирующих веществ) протекает сравнительно медленно, со скоростями, не превышающими нескольких метров в секунду. Скорость горения в значительной степени зависит от внешних условий и в первую очередь от давления в окружающем пространстве. С увеличением давления скорость горения возрастает; при этом горение может в некоторых случаях переходить во взрыв или в детонацию. Горение бризантных ВВ в замкнутом объеме, как правило, переходит в детонацию. Возбуждение взрывчатого превращения ВВ называется инициированием. Для возбуждения взрывчатого превращения ВВ требуется сообщить ему с определенной интенсивностью необходимое количество энергии (начальный импульс), которая может быть передана одним из следующих способов: механическим (удар, накол, трение); тепловым (искра, пламя, нагревание); электрическим (нагревание, искровой разряд); химическим (реакции с интенсивным выделением тепла); взрывом другого заряда ВВ (взрыв капсюля-детонатора или соседнего заряда). Все ВВ, применяемые в производстве, делятся на три основные группы: инициирующие ВВ, бризантные ВВ, метательные ВВ (пороха). В табл.1.13 приведена существующая классификация ВВ, которая является условной, т.к. поведение указанных веществ зависит от условий, в которых они находятся, и способов инициирования. Так, например, аммиачная селитра, используемая в качестве сельскохозяйственного удобрения и даже не относимая некоторыми специалистами к числу ВВ, проявляет себя как весьма сильное взрывчатое вещество, о чем свидетельствуют данные об авариях. Так, в г. Людвигсгафене (Германия) в 1921 г. на территории компании BASF произошел гигантский взрыв аммиачной селитры массой 4500 тонн, в результате пострадало более 2000 человек, в том числе погиб 561 человек. ВВ в зависимости от их природы и состояния обладают определенными взрывчатыми характеристиками. Наиболее важными из них являются: чувствительность к внешним воздействиям; энергия (теплота) взрывчатого превращения; скорость детонации; бризантность; фугасность (работоспособность). Таблица 1.13 Условная классификация КВВ
Количественные значения основных характеристик некоторых КВВ приведены в табл. 1.14. Таблица 1.14 Характеристики некоторых взрывчатых веществ
* ТНТ-эквивалент определяется из соотношения теплот взрыва исследуемого вещества и тринитротолуола (1.7). Значения тротилового эквивалента в таблице основаны на экспериментальных данных.
где Qв – теплота сгорания реагентов (заряда), кДж/кг; mв – масса ВВ, кг; 4520.103 – теплота взрыва ТНТ, Дж/с. При поджигании взрывчатых веществ сначала возникает медленное горение. На открытом воздухе процесс может полностью пройти в виде медленного горения, если отсутствуют условия для развития местного повышения давления. Горение ВВ в условиях замкнутого или полузамкнутого объема способствует повышению давления, приводящему к существенному ускорению горения и к развитию взрыва и детонации. Кроме повышения давления, являющегося основным фактором перехода горения во взрыв, существенным также является предварительный разогрев горящей системы. При сильном ударе по ВВ одновременно возникают очаги разогрева и весьма высокое давление, что способствует возникновению взрыва. Как видно из табл.1.14, из-за высокой начальной плотности конденсированных ВВ при их детонации развиваются колоссальные давления до 39 ГПа. Для определения взрывоопасности порохов и взрывчатых веществ при их хранении и эксплуатации используются следующие методы: дифференциально-термический анализ кинетики разложения вещества при повышенных температурах; метод копровых испытаний для изучения чувствительности к удару; метод изучения передачи детонации через зазор или инертную преграду; метод определения критического диаметра детонации (т.е. наименьшего диаметра зарядаКВВ, при котором еще возможно самоподдерживающееся распространение детонационной волны). Критический диаметр детонации зависит от удельной массы оболочки, окружающей заряд ВВ. При помещении заряда в массивную стальную оболочку он будет име
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-10; просмотров: 1098; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.33 (0.013 с.) |





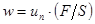 , в соответствии с которым скорость распространения пламени
, в соответствии с которым скорость распространения пламени  в зажатой области будет во столько раз больше нормальной
в зажатой области будет во столько раз больше нормальной 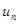 , во сколько раз поверхность пламени превосходит поперечное сечение этой поверхности. Этим законом поясняется возможность перехода дефлаграционного режима в детонационный при горении ГПВС в трубах.
, во сколько раз поверхность пламени превосходит поперечное сечение этой поверхности. Этим законом поясняется возможность перехода дефлаграционного режима в детонационный при горении ГПВС в трубах. , (1.7)
, (1.7)


