
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Раздел 1. Технические характеристики топливаСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
1.1 Топливо и его составные части
Среди различных источников энергии, использованных для энерготехнологического обеспечения потребностей страны, ведущая роль принадлежит топливу. Топливом называются вещества, горение которых сопровождается выделением значительного количества тепла и которые удовлетворяют следующим требованиям: 1. Газообразное состояние продуктов горения и их безвредность; 2. Наличие горючих элементов, определяющее экономическую целесообразность их использования; 3. Возможность управления процессами. Этим требованиям удовлетворяют лишь два химических элемента: углерод (С) и водород (Н), а так же их химические соединения. Топливо имеет органическое происхождение и является главным источником получения тепловой энергии. Различают энергетическое и технологическое топливо. Энергетическим называется топливо, которое используется для производства электрической энергии, водяного пара и горячей воды. Технологическим называется топливо, которое используется в печных агрегатах для совершения технологического процесса. По агрегатному состоянию различают твердое, жидкое и газообразное топливо. Принято состав жидкого и твердого топлива выражать в массовых процентах, а газообразного – в объемных процентах. Качество топлива оценивается несколькими характеристиками: - химическим составом; - теплотой сгорания. Полный химический анализ, как правило, применяется только для определения состава газообразного топлива. Жидкое топливо оценивается по плотности. Для определения характеристики твердого и жидкого топлива проводят технический и элементарный анализ. При техническом анализе а топливе определяются летучие, влага, зола. Для характеристики топлива в общем виде принято делать элементарный анализ, при котором содержание той или иной составляющей обозначать химическим знаком. присвоенным данному элементу или составляющей. С + Н + О + N + S + А + W = 100% (1.1)
Символы С, Н, О, N, S, А, W выражают % содержание в топливе (по массе) углерода, водорода, кислорода, азота, золы, серы, воды. Компоненты топлива. Углерод (С) - наиболее важная составляющая топлива. Он находится в свободном состоянии, в виде органически сложных соединений с другими элементами. В органической части различных твердых топлив содержание углерода колеблется от 50% (древесина) до 95% (антрацит). В органической части различных сортов жидкого топлива содержание углерода достигает 90%. Водород (Н) - находится в свободном состоянии, в виде непрочных химических соединений с углеродом, серой и т.д. Общее содержание водорода в естественном твердом топливе колеблется от 1% до 6%, в жидком оно достигает 10 – 15%, а в газообразном топливе – до 60% (коксовальный газ). Водород, находящейся в соединении с кислородом называют “связанным” и такой водород инертен к горению. Условно считают, что весь кислород топлива связан с водородом в виде воды (правило Дюлонга). Следовательно, если в топливе содержится кислород в таком то количестве по его массе (О2, кг), то масса “связанного” им водорода составит Нсвяз.= О2 /8 кг. Коэффициент “8” определен из весовых соотношений О2 и Н2 (реакция горения 1 кг Н2 требует 8 кг О2) Н2 + ½ О2 = Н2О (2 + ½ . 32 = 18) и на 1 кг Н2 требуется 16/2 = 8 кг кислорода. Количество свободного водорода в топливе составит Нсвоб.= Нобщ – Нсвяз = Нобщ - О2 /8 Водород является самым легким горючим газом, его плотность равна r = 2/ 22,4 = 0,09 кг/м3
Кислород (О) находится в топливе в основном в виде прочных соединений с горючими элементами и не поддерживает горение, снижая тем самым теплоту сгорания топлива. Кислород является балластом. Содержание кислорода в древесине достигает 44%, в жидком топливе кислорода содержится не менее 1,5%, а в газообразном топливе кислорода содержится менее 1,5%. В газообразном топливе содержание свободного кислорода незначительно (0,2 – 0,5%). Свободный кислород может участвовать в горении и это обстоятельстве необходимо учитывать при расчете. Азот (N) является балластом. В твердом и жидком топливе содержится азота 0,5 – 1,0%. а в газообразном топливе его содержание достигает до 60% (доменный газ). Сера (S) содержится в газообразном топливе в виде SО2, Н2S. В твердом и жидком топливе она может содержаться в трех видах: в виде органических соединений с углеродом, водородом, азотом и кислородом (Sо), в виде сернистого соединения с металлами и называется колчеданной и обозначается Sк и в виде сульфатов Sc. S = So + Sc + Sk При нагреве топлива без доступа воздуха (при сухой перегонке) вся органическая и колчеданная сера улетучивается с продуктами горения – эту серу называют летучей. При горении летучей серы выделяется в значительных количествах тепло. Сера так же может находится в виде сернокислых сульфатных соединений: СаSО4, FeSО4, MgSО4. Такая сера называется сульфатной и обозначается Sс. Сульфатная сера находится в окисленном состоянии и не может вступать в реакцию горения. Присутствие серы в топливе нежелательно, т.к. сернистый газ SО2, образующийся при горении и выброшенный с продуктами горения, вредно действует на растительный и животный мир. При плавлении металла часть серы из газовой фазы может переходить в металл, резко снижая его качество (красноломкость стали). По этой причине применение сернистых мазутов ограничивается при отоплении мартеновских печей содержанием серы S< 0,5%. При содержании серы более 3 % в топливе делает его малопригодным для промышленного пользования. Зола (А) топлива является балластом, ухудшающим тепловые свойства и условия сжигания топлива. Зола состоит из кислотных окислов (SiО2, Аl2О3), из основных оксидов (СаО, FeО,Fe2О3, MgО, Nа2О, К2О). Зола входит, главным образом, в состав твердого топлива. Жидкое топливо содержит мало золы. Газообразное топливо содержит золу только в виде пыли. При оценке топлива по зольности большое значение имеет ее температура плавления. По температуре плавления золу делят на 4 группы: 1. Легкоплавкая (tпл < 1150 оС); 2. Среднеплавкая (tпл » 1150 – 1350 оС); 3. Тугоплавкая (tпл » 1350 – 1500 оС); 4. Огнеупорная (tпл > 1500 оС). Температуру плавления определяют в лаборатории согласно ГОСТ по поведению при нагревании стандартного образца из золы. Чем выше температура плавления золы, тем лучше и полнее сжигается топливо. Легкоплавкая зола дает шлаки с низкой температурой плавления и тем самым усиливается шлакование топок, затрудняя подачу воздуха, снижает степень выгорания топлива. Температуру плавления золы определяют в основном по ее составу и, в частности, по ее кислотности: чем больше отношение содержащихся в золе кислотных окислов к основным, тем выше и температура плавления. Кроме того, огнеупорность золы возрастает с увеличением содержания Аl2О3 в сумме кислотных окислов (Аl2О3 + SiО2). Отношение
изменяется от 4,5 до 11,5 при переходе от легкоплавкой золы к тугоплавкой. Отношение Влага (W) является балластом топлива, т.к. снижает использование тепла при сжигании в тех или иных тепловых агрегатах. Различают внешнюю и внутреннюю влагу. Под внешней (Wвнеш) понимают влагу, которая попала в топливо из окружающей среды в процессе его добычи и транспортировки. Внешняя влага удаляется при естественной подсушке топлива (без подогрева) до так называемого воздушно-сухого состояния. При достижении топливом воздушно-сухого состояния наступает равенство меду упругостью водяного пара в топливе и наружным давлением водяного пара, насыщающего окружающую атмосферу, и удаление влаги из топлива прекращается. Внутренняя влага (Wвнутр) включает в себя гигроскопическую и гидратную влагу. Гигроскопическая влажность определяется высушиванием топлива до постоянной массы при температуре 105 оС. Топливо предварительно измельчают в порошок и доводят до воздушного состояния. Гигроскопическая влажность иначе называется влажностью аналитической пробы. Величина гигроскопической влажности различных видов топлива колеблется в широких пределах: - тощие каменные угли и антрацит – 0,5 – 1%; - каменные угли пламенные – 1 – 2, 5%; - бурый уголь – 30 – 40%; - дрова – 15 – 20%; - торф – 20 – 30%. Гидратная влага содержится в минеральной части топлива (золе), входящая в состав различных химических соединений. Содержание гидратной влаги по сравнению с влажностью рабочего топлива невелико и поэтому в печной теплотехнике этой составляющей пренебрегают. Гидратная влага удаляется в процессе нагревания топлива при температурах 400 – 500 оС. Содержание рабочей влаги в твердом топливе колеблется в широких пределах. Влажность топлива тем выше, чем меньше его геологический возраст. Содержание влаги в антраците не превышает 5%, в зеленой древесине – до 60%, а в свежедобытом торфе – 80%. В жидком топливе влага является случайной примесью, попавшей при транспортировке, хранении и при разогреве цистерн “острым паром”. Содержание влаги в жидком топливе, а так же и в твердом топливе, когда требуется повышенная точность измерения, определяют методом дистилляции. В газообразном топливе влага находится в виде паров, предельное содержание которых определяется температурой насыщения водяного пара. Содержание влаги при нормальных условиях не велико и не превышает 3 – 5% по объему. При снижении температуры на каком-нибудь участке происходит выпадение влаги. Результаты анализа топлива могут характеризовать: - органическую массу; горючую массу; сухую массу; рабочее топливо. Каждая из этих характеристик определяется компонентами, которые входят в нее.
Для пересчета составов из одной массы в другую необходимо выполнить соответствующий перерасчет согласно таблице
Таблица 1 - Формулы коэффициентов – множителей для перерас - чета состава топлива
Теплота сгорания топлива. Основным энергетическим показателем топлива является теплота сгорания. Теплотой сгорания называется тепловой эффект реакции полного сгорания единицы топлива (кг, м3, кмоль) до СО2, Н2О, SО2 и соответствующих продуктов полного окисления других элементов, если они входили в состав данного вещества. Т.к. в составе процесса горения обычно лежит химическая реакция взаимодействия двух веществ – топлива и окислителя, то химическая реакция между топливом (Т) и окислителем (О), протекающая с образованием продуктов сгорания М и N, может быть описана стехиометрическим уравнением следующего вида а Т + в О Û тМ + пN + Q, (1.3) где а, в, т и п - число молекул участвующих в элементарном акте реакции. За системную единицу количества тепла в системе Си принимают джоуль (Дж). Джоуль – универсальная единица измерения работы, энергии и количества теплоты. Кратные единицы количества теплоты: килоджоуль (кДж), мегаджоуль (мДж) и т.д. Джоуль определяется как работа, проводимая силой в 1 Ньютон (1н) при перемещении точки приложения этой силы на 1 м вдоль ее направления (1 Дж = 1 н.м). В качестве единицы теплоты в науке и технике ранее имела широкое распространение внесистемная единица калория (кал) и кратные единицы: килокалория (ккал), мегакалория (мкал) и т.д. Соответственно: 1 кал = 4,187 Дж 1 ккал = 4187 Дж = 4,187 кДж 1 мкал = 4,187 .106 Дж = 4,187 мДж Горение элементов топлива может быть полным и неполным. При полном сгорании образуются конечные продукты – углекислый газ (СО2) и водяной пар (Н2О) а так же выделяется максимум тепла. При неполном сгорании в конечных продуктах находятся кроме СО2 и Н2О еще и СО, Н2, СН4 и т.п. Количество тепла, которое выделяется при полном сгорании единицей топлива (1кг или 1м3), называется теплотой сго-рания. В зависимости от агрегатного состояния водяных паров различают высшую и низшую теплоту сгорания. Высшей теплотой сгорания Низшей теплотой сгорания называется количество тепла, которое выделяется при сжигании единицы топлива до продуктов полного сгорания (СО2, Н2О, SО2 и др.) при условии, что вся образовавшаяся влага находится в парообразном состоянии при температуре 20 оС. Т.к. в топливе различается 4-е массы (рабочая, сухая, горючая и органическая), то и теплоты сгорания определяются относительно этих масс и записываются следующим образом: Рассмотрим на какую величину различаются При Поэтому разница между этими теплотами составляет (2677,1 – 160,7 = 2156,4 кДж/кг). Тогда разница между теплотами сгорания можно записать в следующем виде
где Wр и Нр – содержание влаги и водорода в рабочем топливе в долях единицы. Если Wр и Нр выражается в %, то формула будет иметь вид
|
||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-18; просмотров: 465; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.139.234.68 (0.09 с.) |

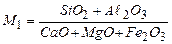 (1.2)
(1.2) изменяется в этом случае от 0,28 до 0,40. Зольность топлива в действительных условиях колеблется в пределах доли процента для газового топлива, долей процента для жидкого топлива, для дров 1 – 2%, 5 – 10% для хороших каменных углей и до 30 – 50% для горючих сланцев и торфа.
изменяется в этом случае от 0,28 до 0,40. Зольность топлива в действительных условиях колеблется в пределах доли процента для газового топлива, долей процента для жидкого топлива, для дров 1 – 2%, 5 – 10% для хороших каменных углей и до 30 – 50% для горючих сланцев и торфа.


 1
1 


 1
1 
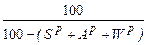
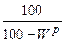 1
1
 называется количество тепла, которое выделяется при сжигании единицы топлива до продуктов полного сгорания (СО2, Н2О, SО2) при условии, что вся образовавшаяся влага находится в жидком состоянии при температуре ОоС. В высшей теплоте сгорания учитывается скрытая теплота парообразования (2258,4 кДж кг) и теплота охлаждения воды от 100 оС до О оС (418,68 кДж кг). На практике водяные пары конденсируются за пределами камеры сгорания. поэтому понятие высшей теплоты сгорания имеет лишь теоретическое значение, Для приближения к практике введено понятие низшей теплоты сгорания
называется количество тепла, которое выделяется при сжигании единицы топлива до продуктов полного сгорания (СО2, Н2О, SО2) при условии, что вся образовавшаяся влага находится в жидком состоянии при температуре ОоС. В высшей теплоте сгорания учитывается скрытая теплота парообразования (2258,4 кДж кг) и теплота охлаждения воды от 100 оС до О оС (418,68 кДж кг). На практике водяные пары конденсируются за пределами камеры сгорания. поэтому понятие высшей теплоты сгорания имеет лишь теоретическое значение, Для приближения к практике введено понятие низшей теплоты сгорания  .
. . На практике чаще всего используют
. На практике чаще всего используют  .
.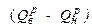 . В величину
. В величину  , кроме химической теплоты, входит еще теплота конденсации 2258,4 кДж/кг и теплота охлаждения сконденсированной воды от 100оС до О оС (
, кроме химической теплоты, входит еще теплота конденсации 2258,4 кДж/кг и теплота охлаждения сконденсированной воды от 100оС до О оС ( 418,7 кДж). Таким образом, в этом случае в систему возвращаются теплоты (2258,4 + 418,7 = 2677,1 кДж/кг).
418,7 кДж). Таким образом, в этом случае в систему возвращаются теплоты (2258,4 + 418,7 = 2677,1 кДж/кг). конденсации водяных паров нет, а есть только их охлаждение от 100 оС до 20 оС [1.2,0087(100-10)] = 160,7 кДж/кг.
конденсации водяных паров нет, а есть только их охлаждение от 100 оС до 20 оС [1.2,0087(100-10)] = 160,7 кДж/кг. , кДж/кг (1.4)
, кДж/кг (1.4)


