
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Вычисление количества элемента в известном количестве вещества.Содержание книги
Поиск на нашем сайте
Пример. Сколько граммов кислорода содержится в 16 г сернистого газа SO2? Решение: Молекулярная масса SO2 равна 32+(16×2)=64 1 моль=64 г. Формула SO2 показывает, что в 1 моль сернистого газа, т.е. в 64 г его находится 2 атома кислорода, т.е. 32 г кислорода. На этом основании делаем следующую запись: в 64 г SO2 содержится 32 г кислорода в 16 г SO2 содержится Х г кислорода Составляем пропорцию: 64: 16 = 32: Х Вычисляем известное: Х= Ответ: в 16 г сернистого газа содержится 8 г кислорода. Задания: 1)Сколько граммов кислорода содержится в 2 г: а) оксида ртути(II) HgO; б) оксида меди(II) CuO; в) оксида серебра Ag2O; г) оксида магния MgO; д) калийной селитры KNO3; е) бертолетовой соли KClO3; ж) сурика Pb3O4? (Ответ: а)0,15 г.; б)0,4 г., в)0,14 г. г)0,8 г, д)0,94 г е)1,15 г., ж)0,19 г. 2)Сколько граммов азота содержится в 0,5 моль каждого из перечисленных веществ: а) аммиака NH3; б) оксиде азота(I) N2O; в) оксиде азота(I I) NO; г) азотистого ангидрида N2O3; д) оксиде азота(IY) NO2; е) оксиде азота(Y) N2O5? (Ответ: а)8,5 г.; б)22 г.; в)15 г, г)38 г.; д)23 г. е)54 г. г.) 3) Сколько килограммов углерода содержится в тонне: а) мрамора CaCO3; б) магнезита MgCO3; в) сидерита FeCO3? (Ответ: а)0,12 т..; б)0,14 т.; в)0,1 т.)
1.7Случаи более сложных вариантов задач разобранных выше типов. На практике редко приходится встречаться с чистыми веществами. В связи с этим расчёты в задачах приведённых выше типов выражаются в определении содержания элементов в смесях веществ или в определении количества смеси по известному количеству элемента в веществе и др. Пример. Образец красного железняка - железной руды, являющейся природным оксидом железа(III), содержит 92% оксида железа(III) Fe2O3 , остальное составляют примеси, не содержащие железа. Определить содержание железа в 1 т этой руды. Решение: 1)Сколько оксида железа(III) Fe2O3 содержит 1 т руды? 100 т -92 т 1 т - Х Х=0,92 т 2)Сколько железа находиться в 1 т руды? Fe2O3 - 2 Fe 160 - 112 160 - 112 0,92 - Х 160:0,92=112:Х Х=0,644 Ответ: одна тонна руды содержит 0,644 т железа.
Пример. Сколько меди содержится в 200 г 5%-ного раствора серной меди CuSO4? Решение: 1)100 г раствора содержат 5 г CuSO4 200 г раствора содержат Х г CuSO4 Х=10 г 2)Сколько меди содержится в 10 г CuSO4 CuSO4 - Cu 160 - 64 160 64 10 - Х Х= Ответ: 200 г 5%-ного раствора сернокислой меди содержат 4 г меди? Пример. Сколько 15%-ного раствора хлористого натрия NaCl надо взять, чтобы в нём заключалось 2 г хлора? Решение: 1)Сколько граммов NaCl содержат 2 г хлора? NaCl - Cl 58,5 - 35,5 58,5 35,5 Х - 2 58,5:Х=35,5:2, Х=3,29 2)100 г раствора содержат 15 г NaCl Х г раствора содержат 3,29 г NaCl 100:Х=15:3,29, Х= Х=21,9. Ответ:21,93 г. Задания: 1)36 л воды подверглись полностью разложению. Сколько при этом получилось: а) водорода; б) кислорода? Ответ выразить в килограммах и кило-молях. (Ответ: а) 2 кг или 1 кило-моль, б) 32 кг или 1 кило – моль.) 2)Сколько граммов оксида меди(II) CuO образуется при окислении: а) 4 г меди; б) 6 моль меди? Ответ: а)5 г., б)477 г. 3)Сколько кислорода может выделиться при разложении оксида ртути(II), взятой в количестве: а) 86,8 г; б) 10 моль. (Ответ: а) 6,36 г., б)160 г.) Расчёты по химическим уравнениям. Напоминаем, что количества веществ, соответствующие химическому уравнению, называются «стехиометрическими количествами», а расчёты, связанные с химическими уравнениями, называются стехиометрическими вычислениями. Приведем четыре типичных случая расчётов по химическим уравнениям на примере реакции вытеснения меди из раствора сульфата меди(II) CuSO4 железом: CuSO4 + Fe = Fe SO4 + Cu В этом уравнении обозначены четыре вещества, количества которых связаны, как обычно в уравнениях, стехиометрическими отношениями; поэтому по известному количеству одного из веществ можно вычислить количества трёх остальных.
Определение количества одного из продуктов реакции по известному количеству одного из исходных веществ. Пример. Сколько меди можно получить из 16 г сульфата меди(II) при действии необходимого количества железа? Решение: 16 г Х г CuSO4 + Fe = Fe SO4 + Cu 160 64 160 - 64 160: 16 = 64: Х 16 - Х Х = 6,4. Ответ: 6,4 г. Задания: 1) Сколько водорода выделится из соляной кислоты HCl при её взаимодействии с цинком Zn, взятым в количестве: а) 6,5 г; б) 2 моль. Ответ выразить в граммах, молях и литрах. (Ответ: а) 0,2 г.;0,1 моль; 2,24 л. б) 4 г., 2 моль, 44, 8 л.) 2)Сколько граммов едкого натра NaOH образуется при взаимодействии воды с натрием, взятым в количестве: а) 4,6 г; б) 4 моль. (Ответ: а) 8 г; б) 160 г) 3)Сколько водорода выделяется при взаимодействии воды с калием, взятым в количестве: а) 3,9 г; б) 10 моль. Ответ выразить в граммах, молях и литрах. (Ответ: а) 3,9 г.; 0,1 моль; 2,24 л. б) 390 г., 10 моль, 224 л.)
|
||||
|
Последнее изменение этой страницы: 2016-09-20; просмотров: 113; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.141.32.252 (0.006 с.) |

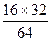 =8.
=8.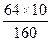 =4.
=4.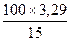 ,
,


