
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Нахождение массы заданного объёма газа, заданного при нормальных условиях.Содержание книги
Поиск на нашем сайте
Пример. Найти массу 1 литра кислорода, измеренного при нормальных условиях. Решение: Формула кислорода О2, молекулярная масса кислорода равна 32(16 × 2 = 32). Масса 1 моль 32 г. Следовательно, 32 г кислорода занимают при нормальных условиях объём, равный 22,4 л. На этом основании делаем следующую запись: 22,4 л весят 32 г 1 л весит Х г 22,4: 1 = 32: Х Х = 32: 22,4 = 1,43 (г). Ответ: масса 1 литра кислорода, измеренного при нормальных условиях, равна 1,43 г. Справочный материал: Чтобы узнать массу 1 л любого газа (или пара), измеренного при нормальных условиях, следует число, выражающее молекулярную массу газа, разделить на 22,4. Нормальные условия — стандартные физические условия, с которыми обычно соотносят свойства веществ. Нормальные условия определены IUPAC (Международным союзом практической и прикладной химии) следующим образом: Атмосферное давление 101325 Па = 760 мм рт. ст.. Температура воздуха 273,15 K = 0° C. Закон Авогадро: один из основных законов идеальных газов, согласно которому в равных объёмах различных газов при одинаковых температурах и давлениях содержится одинаковое число молекул. Число молекул в одном моле называют числом Авогадро. Закон был открыт А. Авогадро в 1811 году: 1) 1 моль любого идеального газа при одинаковых температурах и давлениях занимает один и тот же объём, равный 22,4 литра при давлении 101 325 Па/м2 (760 мм рт. ст.) и температуре 0°С; 2) плотности r2 и r1 двух идеальных газов при одних и тех же давлении и температуре прямо пропорциональны (и удельные объёмы V1 и V 2 обратно пропорциональны) их молекулярным массам M2. и M1:
Задания: 1)Какова масса при н.у. 2,5 л: а) сероводорода; б) оксида серы(IY); в) паров оксида серы(YI); г) паров CS2? Ответ: а)3,8 г, б)7.1 г, в) 8.9 г, г) 8.4 г. 2)Сколько граммов воздуха необходимо для окисления 160 г серы? (Содержание кислорода в воздухе равно 23% по массе.) (Ответ: 696 г.) Нахождение объёма заданного количества газа, занимаемого им при нормальных условиях. Пример. Какой объём занимает 1 г углекислого газа при нормальных условиях? Решение: Молекулярная масса СО2 равна 44. Вес 1 моль СО2 равен 44 г. При нормальных условиях 44 г углекислого газа занимают объём, равный 22,4 л. 44 г занимают объём 22,4 л 1 г занимает объём Х л 44: 1 = 22,4: Х Х = 22,4: 44 = 0,51. Ответ: 1 г углекислого газа занимает при нормальных условиях объём 0,51 л.
Справочный материал: Чтобы узнать объём, занимаемый одним граммом газа при нормальных условиях, следует 22,4 разделить на молекулярную массу газа. Задания: 1)Какой объём занимают при нормальных условиях: а) 0,1 моль сероводорода; б) 0,2 моль оксида серы(IY); в) 3 моль парообразного оксида серы(YI); г) 0,5 моль парообразного сероуглерода CS2? Ответ: а) 2,24 л., б)4,48 л., в)67,2 л., г) 11,2 л.. 2)Какой объём занимают при н.у.: а) 2 г H2S; б) 4 г SO2; в) 6 г паров SO3; г) 10 г паров CS2? Ответ: а)1,32 л., б)1,68 л., в)2,95 л.. Нахождение массы данного объёма газа, измеренного при нормальных условиях, по молекулярной массе газа. Пример. Молекулярная масса газа равна 64. Какова масса 1 литра этого газа, измеренного при нормальных условиях? Решение: М = 22,4 × m 64 = 22,4 × m m = Ответ: масса 1 литра данного газа, измеренного при нормальных условиях, равна 2,86 г. Справочный материал: 1 моль любого идеального газа при одинаковых температурах и давлениях занимает один и тот же объём, равный 22,4 л. при давлении 101 325 Па/м2 (760 мм рт. ст.) и температуре 0°С; Задания: 1)Какова масса при н.у.: а) 1 л кислорода; б) 1 м3 кислорода? (Ответ: а) 1,43 г; б) 1 кг 429 г.) 2)Сколько кислорода выделится при полном разложении перекиси водорода, взятой в количестве: а) 34 г; б) 3 моль? Ответ: а)22,4 л., б)67,2 л. Нахождение молекулярной массы газа по известной массе данного объёма газа. Пример. Масса 1 литра водорода, измеренного при нормальнух условиях, равна 0,089 г. Определить молекулярную массу водорода. Рнешение: 1 моль 22,4 × m, m = 0,089 г 1 моль 22,4×0,089 = 1,9936 или 2 г. Ответ: молекулярная масса водорода равна 2. Задания: 1)Масса 1 литра метана измеренного при н.у., равна 0,714 г. Определите молекулярную массу метана. (Ответ: 16 г) 2)Масса 1 литра пентана 3,21 г, измеренного при н.у.. Определите молекулярную массу пентана. (Ответ: 72 г) Нахождение плотности газа по водороду (D), если известна молекулярная масса газа. Пример. Какова плотность по водороду углекислого газа СО2? Решение: молекулярная масса СО2 равна 44(12 + 16 × 2)= 44. М = 2D 44 = 2D D = Ответ: углекислый газ тяжелее водорода в 22 раза. Задания: 1)Вычислить следующие физические константы для этана: а) плотность по водороду; б) плотность по воздуху; в) массу одного литра; г) объём одного грамма. Ответ: а) 30, б)1,03, в)1,34, в)0,75.
2)Вычислить следующие физические константы для пропана: а) плотность по водороду; б) плотность по воздуху; в) массу одного литра; г) объём одного грамма. (Ответ: а)22,б) 1,034, в)1,96, г)0,51) 3.6Нахождение плотности газа по воздуху (d), если известна молекулярная масса газа. Пример. Вычислить плотность углекислого газа по воздуху. Решение: Молекулярная масса СО2 равна 44. М = 29 d. d = d = Ответ: углекислый газ тяжелее воздуха приблизительно в 1,5 раза. Задания: 1)Вычислить относительную плотность бутана по воздуху. (Ответ: 2) 2)Вычислить относительную плотность пропана по кислороду. (Ответ: 1, 375)
|
||||||
|
Последнее изменение этой страницы: 2016-09-20; просмотров: 327; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.58.16.208 (0.009 с.) |


 = 2,86.
= 2,86.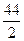 = 22.
= 22.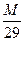
 = 1,5.
= 1,5.


