
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
К Нарушения сосудистого тонусаСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Регуляция сосудистого тонуса: • Метаболическая регуляция осуществляется при участии С02, лактата, петидов (продукты протеолиза - каллидин), АПУД-еистемы (серотонин, гистамин, дофамин). биологически активных веществ, выделяющихся при дегрануляции тучных клеток (серо-тонин, гистамин), простагландинов, АДФ, аденозина, К+, Са++, изменений рН. Важную роль играет N0 (оксида азота), который является посредников действия большинства ди-лататорных веществ. Нарушение синтеза N0 в эндотелии сосудов возникает при дисфункции эндотелия (встречается при гипертонической болезни, ангиотрофоневрозах, вас-кулитах и некоторых других заболеваниях). • Гуморальная регуляция реализуется при участии моноаминов (гистамин, серо-тонин), пептидов (брадикинин, ангиотензин), гормонов (адреналин, вазопрессин), простагландинов ПГЕ, ПГ I2 (вазодилатация), ПГР, ПГА2 (вазоконстрикция). • Нервная регуляция сосудистого тонуса в основном симпатическая (а-, р-, холи-нэргическая). Парасимпатические нервы участвуют в регуляции тонуса сосудов кожи, слюнных желез, органов малого таза. IV. Виды региональных нарушений кровообращения и их механизмы. Сладж-Феномен. 1. Артериальная гиперемия - увеличение притока артериальной крови к органу или ткани. Причины артериальной гиперемии: Артериальные гиперемии могут возникать при воздействии экзогенных ш эндогенных факторов. По природе этиологические факторы можно классифицировать на физические (очень высокая или низкая температура окружающего воздуха, механическая травма), химические (органические и неорганические кислоты, щелочи, спирты и другие соединения) и биологические (физиологически активные вещества, образующиеся в организме, например аденозин, простагландины А, Е, I2, ацетилхолин, продукты жизнедеятельности бактерий, паразитов, риккетсий и некоторые их эндотоксины). По механизму возникновения различают следующие варинты артериальной гиперемии: • нейротоническая (возбуждение холинорецепторов сосудов кожи, языка, органов малого таза, поджелудочной и слюнных желез, р-адренорецепторы сосудов сердца и мозга). • нейропаралитическая (блокада а-адренорецепторов сосудов периферических органов). • гуморальная (накопление С02, лактата, аденозина, АДФ, К+, брадикинина, гиста-мина, простагландинов Е и Ь, что чаще всего возникает при гипоксии, воспалении).
• миопаралитическая (истощение запасов катехоламинов при длительном действии на ткани какого-либо фактора, например, длительное воздействие высоких температур, механическое давление, токсин возбудителя сыпного тифа). Различают физиологическую и патологическую гиперемию. Примером физиологической артериальной гиперемии может быть краска стыда на лице, розово-красные участки кожи на месте ее теплового или механического раздражения. Артериальная гиперемия характеризуется: • Увеличением числа и диаметра видимых артериальных сосудов в связи с увеличением их просвета. • Покраснением органа, ткани или их участков, что обусловлено повьппением притока артериальной крови, расширением артериол и прекапилляров, увеличением числа функционирующих капилляров, «артериализацией» венозной крови (повьппением уровня ок-сигенированного гемоглобина в венозной крови). • Повышением температуры тканей и органов вследствие притока к ним более теплой артериальной крови, а также в результате повышения интенсивности в них обмена веществ. • Увеличением лимфообразования и лимфооттока, вследствие увеличения перфузионного давления в сосудах микроциркуляторного русла. 1|| • Увеличением объема и тургора органа или ткани в связи с возрастанием их крове- и При микроскопии ткани в зоне артериальной гиперемии наблюдается: увеличение диаметра артериол, прекапилляров, числа функционирующих капилляров, ускорение тока крови по микрососудам в связи с увеличением объема ее притока и/или артериального давления, сокращение потока клеток крови по центральной оси артериолы и прекапилляра и увеличение ширины потока плазмы крови с малым содержанием в ней форменных элементов вокруг этого «цилиндра» (феномен обусловлен отбрасыванием клеток крови к центру просвета сосуда в связи с ускорением тока крови). 2. Венозная гиперемия развивается при нарушении оттока венозной крови от ор Исходя из этиологии и механизма развития, различают венозную гиперемию: • обтурационную, обусловленную закупоркой просвета вены тромбом, эмболом (обли-
• компрессионную, наблюдающуюся при сдавлении вены извне воспалительным отеком, опухолью, лигатурой, разрастающейся соединительной тканью; • застойную, связанную с сердечной недостаточностью. Венозная гиперемия сопровождается: • Увеличением числа и диаметра видимых венозных сосудов в связи с увеличением их просвета. • Цианозом тканей и органов, вследствие увеличения кровенаполнения сосудов венозной кровью более темный цвет которой обусловлен накоплением дезокси-формы гемоглобина. • Снижение температуры тканей и органов вследствие увеличения объема в них более холодной венозной крови (в сравнении с артериальной) и уменьшения интенсивности тканевого метаболизма. • Отек тканей и органов, развивающийся вследствие увеличения кровяного давления в капиллярах, посткапиллярах и венулах. При длительной венозной гиперемии отек потенцируется за счет «включения» осмотического, онкотического и мембраногенного патогенетических факторов. • Кровоизлияния в ткань либо кровотечения (внутренние или наружные), являющиеся следствием перерастяжения и микроразрывов стенок венозных сосудов. При микроскопии тканей в зоне венозной гиперемии выявляются: увеличение диаметра капилляров, посткапилляров и венул; возрастание числа функционирующих капилляров на начальном этапе гиперемии и последующее снижение, в связи с образованием микротромбов и агрегатов клеток крови; замедление, вплоть до прекращения оттока венозной крови; значительное расширение осевого «цилиндра» клеток крови (до величины просвета венул) и исчезновение «полосы» плазматического тока в них; «маятникообраз-ное» движение крови в венулах «туда-обратно»: «туда» - от капилляров в венулы в связи с проведением систолической волны сердечного выброса крови, «обратно» - в результате возврата ее тока в связи с «отражением» от механического препятствия (тромба, эмбола, суженного участка венулы). 3. Ишемия - уменьшение или прекращение притока артериальной крови к органу, В зависимости от причины и условий возникновения различают следующие виды ишемии: • ангиоспастическая возникает вследствие раздражения а-адренорецепторов артерий внутренних органов при действии различных стрессоров или при введении лекарственных препаратов - ос-адреномиметиков; • обтурационная формируется в результате закупорки просвета артерий (тромбоз, эмболия, разрастание соединительной ткани в просвете артерии при воспалении ее стенки, сужение просвета артерии атеросклеротической бляшкой); • компрессионная наблюдается при сдавлении артерии (наложение жгута, воспалительный отек, опухоль, рубец, гипертрофированный орган, перевязка артерий во время операций лигатурой); • перераспределительная возникает при нарушении регуляции сосудистого тонуса, когда из-за усиленного притока крови к одному органу ограничивается кровоснабжение другого (ишемия головного мозга после быстрого удаления асцитической жидкости из брюшной полости, куда устремляется большая масса крови) При ишемизаиии наблюдается: • Уменьшение диаметра и количества видимых артериальных сосудов в связи с уменьшением их кровенаполнения.
• Побледнение ткани или органа, что обусловлено в основном снижением их кровенаполнения и уменьшением числа функционирующих капилляров. • Снижение величины пульсации артерий в результате уменьшения их систолического наполнения кровью.
• Понижение температуры ишемизированного региона ткани вследствие уменьшения притока теплой артериальной крови, а впоследствии - падения интенсивности метаболизма и, следовательно, выделения тепла. • Снижение лимфообразования в результате понижения перфузионного давления в микрососудах. • Уменьшение объема и тургора органов и тканей вследствие недостаточности их крове- и лимфонаполнения. При микроскопическом исследовании ишемизированной ткани наблюдаются: уменьшение диаметра артериол и прекапилляров, снижение количества функционирующих капилляров, замедление тока крови по микрососудам, расширение осевого «цилиндра», представленного движущимися клетками крови и сужение полосы плазматического потока по периферии артериолы. Исход и значение ишемии различны и зависят от ее продолжительности, скорости развития преграды, степени развития и состояния коллатеральных артерий, эффективности функционирования сердца, толерантности ткани к ишемии (чем выше интенсивность метаболизма в ткани, тем тяжелее повреждение цри ишемизации: в головном мозге инфаркт возникает в течение нескольких минут после артериальной окклюзии; скелетная мускулатура, кости и некоторые другие ткани могут противостоять ишемии более длительное время, прежде чем в них возникнут явные морфо-функциональные нарушения). Охлаждение (гипотермия) замедляет скорость возникновения ишемического повреждения из-за общего уменьшения метаболических потребностей тканей. Это явление используется при некоторых хирургических операциях и при транспортировке органов для трансплантации. 4. Стаз - это замедление, вплоть до полной остановки, тока крови в сосудах микро-циркуляторного русла, главным образом, в капиллярах. Стаз крови характеризуется остановкой крови в капиллярах и венулах с расширением просвета и склеиванием эритроцитов в гомогенные столбики - это отличает стаз от венозной гиперемии. Гемолиз и свертывание крови при этом не наступают. Виды стаза: • застойный стаз - стазу предшествует венозная гиперемия, • ишемический стаз - стазу предшествует ишемия, • истинный стаз - возникает без предшествующих перечисленных расстройств кровообращения, под влиянием эндо- и экзогенных причин (инфекции - малярия, сыпной тиф; различные химические и физические агенты - высокая температура, холод) приводящих к нарушению иннервации микроциркуляторного русла и гемореологии.
Крайней степенью выраженности стаза является сладж.
5. Нарушения лимфообращения клинически и морфологически проявляются, главным образом в виде недостаточности лимфооттока. Первые проявления нарушения лимфооттока - это застой лимфы и расширение лимфатических сосудов. Компенсаторно-приспособительной реакцией в ответ на застой лимфы является развитие коллатералей и перестройка лимфатических сосудов, которые превращаются в тонкостенные, широкие полости (лимфангиоэктазии). В них появляются многочисленные выпячивания стенки - варикозное расширение лимфатических сосудов. Проявлением декомпенсации лимфообращения является лимфогенный отек^ или лимфедема. Лимфедема по распространенности может быть классифицирована на местную (регионарную) и общую, по течению - на острую и хроническую. Значение недостаточности лимфатической системы определяется, прежде всего, нарушениями тканевого метаболизма, к которым ведет недостаточность не только лимфатической, но и венозной системы (венозный застой). Развивающаяся гипоксия делает по существу стереотипными и однозначными изменения органов и тканей при застое, как лимфы, так и крови. V. Методы оценки сосудистой гемодинамики. Для оценки сосудистой гемодинамики в клинической практике широко используются ультразвуковая допплерография и реография (электроплетизмография). Ультразвуковая допплерография (УЗДГ) - ультразвуковой метод регистрации скорости, направления и организованности потока крови в сосудах на основе доплеров-ского эффекта. Допплеровским эффектом в ультразвуковой диагностике обозначается феномен, который заключается в том, что частота ультразвукового сигнала при его отражении от движущегося объекта изменяется пропорционально скорости движения иодируемого объекта вдоль оси распространения сигнала. Чем больше скорость движения объекта, тем больше сдвиг частоты ультразвука. При движении объекта в сторону источника излучения, частота отраженного от объекта эхо увеличивается, а при движении объекта от источника излучения - уменьшается Информация о кровотоке представляется на графическом дисплее в виде кривой допплеровского сдвига частот (рис. 2.4.З.). Кровоток, направленный от датчика, изображается внизу от базальной линии, к датчику выше ее.
Реография (электроплетизмография) - неинвазивный метод исследования кровообращения. Принцип метода основан на том, что кровь по сравнению со всеми остальными тканями организма обладает наибольшей электропроводностью, поэтому колебания кровенаполнения сосудов, обусловленные циклической работой сердца, вызывают синхронные изменения электропроводности исследуемого участка тела. Для диагностики нарушений регионального кровообращения используют две основных модификации реогра-фии - реовазографию (нарушение кровообращения в конечностях) и реоэнцефалографию (нарушения мозгового кровообращения).
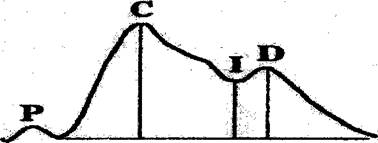
Реовазография позволяет оценить кровенаполнение, состояние сосудистого тонуса, степень развития коллатерального кровообращения в конечностях, а также состояния клапанов поверхностных и глубоких вен нижних конечностей. При реовазографическом исследовании через участок тела человека пропускают переменный ток высокой частоты и малой силы, он безвреден для организма и не ощущается исследуемым. Любое изменение в каком-либо участке тела и органа количества крови сопровождается изменением электрических параметров, которые графически регистрируются аппаратом - реографом или реоплетизмографом. Чем больше кровенаполнение тканей, тем меньше их электрическое сопротивление (импеданс). На реовазограмме различают анакроту (восходящую часть), вершину, катак- роту (нисходящую часть), на которой располагаются 1-3 дополнительных волны (рис. 2.4 А).
Рис. 2.4.4. Основные компоненты реограммы, выделяемые при традиционном анализе: систолическая (С), диастолическая (О), пресистолическая (Р) волна и инцизура (I). Восходящая часть кривой - анакро-та, нисходящая.- катакрота. При качественном анализе реовазограммы учитывается регулярность кривой, крутизна анакроты, характер вершины, форма катакроты, количество и выраженность дополнительных волн. Кривая считается регулярной, если каждая последующая волна похожа на предыдущую. Патология гемостаза. . Виды гемостаза: сосудисто-тоомбоиитарный и плазменный, их роль в изменении агрегатного состава косей. Понятие о антикоагулянтах и Фибринолизе. Система гемостаза - биологическая система, обеспечивающая, с одной стороны, сохранение жидкого состояния циркулирующей крови, а с другой, -предупреждение и купирование кровотечений. Виды гемостаза: • сосудистый • тромбоцитарный • плазменный (коагуляционный)
В нормальных условиях эндотелий кровеносных сосудов обладает высокой тром-борезистентностью и играет важную роль в поддержании жидкого состояния крови и предупреждении тромбозов. Факторы, определяющие тромборезистентность эндотелия: • Контактная инертность внутренней, обращенной в просвет сосуда поверхности этих клеток, в силу чего она не активирует системы гемостаза. • Синтез мощного ингибитора агрегации тромбоцитов - простагландина 12 (простацик-лина). • Наличие на цитоплазматической мембране эндотелиальных клеток особого гликопро-теина - тромбомодулина, связывающего тромбин, благодаря чему последний утрачивает Способность вызывать гемокоагуляцию, но сохраняет активирующее действие на систему двух важнейших антикоагулянтов - протеинов С и 8. • Высокое содержание на внутренней поверхности кровеносных сосудов мукополисаха-ридов и фиксацией на эндотелии комплекса «гепарин-антитромбин III». • Способность стимулировать фибринолиз путем синтеза и секреции тканевого активатора плазминогена, а также через систему «протеины С+8» • Элиминаця из крови активированных факторов свертывания крови и их метаболитов. Причинами трансформация антитромботического потенциала эндотелия на тромбогенный могут явиться: венозная гиперемия и гипоксия, повреждение стенок сосудов физическими и химическими агентами (медиаторы воспаления, бактериальные токсины), иммунными комплексами, метаболические изменения в сосудистой стенке (атеросклероз, диабетическая ангиопатия). Тромбощп арный гемостаз включает: адгезию (прилипание к стенке сосуда тромбоцитов, индуцируемое тромбоксаном Аг, коллагеном, фактором Виллебранда (ФВ), адено-зином); агрегацию (склеивание, осуществляемое при участии коллагена, тромбоксана А2, адреналина, АДФ), уплотнение (ретракцию, потенциируемую тромбостенином) с образованием тромбоцитарного (белого) тромба (рыхлый, быстро разрушается при высокой скорости кровотока, без участия механизмов коагуляционного гемостаза не способен предотвратить кровотечение). Индукторы агрегации тромбоцитов могут иметь как плазменное, так и тромбоцитарное происхождение. Функции тромбоцитов: • Ангиотрофическая, т.е. поддержание нормальной структуры и функции стенок микрососудов, в том числе жизнеспособность и репарацию эндотелиальных клеток. • Поддержание спазма поврежденных сосудов путем высвобождения вазоактивных веществ - серотонина, катехоламинов, тромбомодулина и др. • Образование в поврежденном сосуде тромбоцитарной пробки. • Участие тромбоцитарных факторов в процессе свертывания крови и в регуляции фиб-ринолиза. • Стимуляция процесса репарации в местах повреждения сосудистой стенки выделяющимся из подвергшихся адгезии тромбоцитов ростовым фактором. Плазменный (коагуляционный гемостаз) - несколько взаимосвязанных каскадных реакций, протекающих при участии протеолитических ферментов (13 белков). На каждой стадии каскада профермент (зимоген) превращается в сериновую протеазу, которая катализирует превращение следующего профермента в сериновую протеазу. Стадии коагуляционного гемостаза: 1. Образование активной протромбиназы. 2. Образование тромбина (2-5 с). 3. Образование фибрина (красный тромб) - 3-5 с. Пути активации свертывания крови. Механизмы активации свертывания крови подразделяют на внешние и внутренние. Это деление искусственно, так как оно не имеет места in vivo, но облегчает интерпретацию лабораторных тестов in vitrо. Основным путем активации свертывания крови считается внешний путь. Он начинается с высвобождения тканевого фактора (ФШ иди ТФ). ТФ образуется во многих клетках, имеющих контакт с кровью и поступает в нее при повреждении клеток или действии протеаз. ТФ в присутствии ионов Са** активирует фактор VII. Профермент ФУП синтезируется в печени, является витамин К-зависимым. Комплекс ТФ/ФУПа/Са** действует на два субстрата ФХ и Ф1Х. Внутренний путь начинается с обнажения отрицательно заряженной поверхности (например, коллагена) в пределах сосудистой стенки, следствием этого является активация ФХП. ФХПа вызывает активацию прекалликреина (ПК), высокомолекулярного кини-ногена (ВМС) и ФХ1. ФХПа расщепляет ФХ1 до ФХ1а и ПК до калликреина. ФХ1а превращает Ф1Х в ФГХа. Таким образом, Ф1Х активируется ФХ1а или комплексом ТФ/ФУНа/Са**, последний является более важным. Ф1Ха требует наличия Са++ и кофактора ФУШ для прикрепления к тромбоцитар-ному фосфолипиду и превращения ФХ в ФХа. ФУШ циркулирует в крови в связанном с фактором Виллебранда состоянии, что стабилизирует его молекулу, увеличивает период полужизни. Термином «активная протромбиназа» называется комплекс ФХа+ФУа, активированный на фосфолипидной поверхности в присутствии Са++ Общий путь. При участии протромбиназы осуществляется трансформация про-тромбина (ФП) в тромбин (ФПа), который вызывает гидролиз фибриногена до фибрина. Фибриноген синтезируется в основном гепатоцитами, но имеется в мегакариоцитах и тромбоцитах. Его синтез индуцируется повреждением тканей, воспалением, стрессом. Тромбин расщепляет фибриноген до двух пептидов и мономера фибрина. Эти мономеры образуют полимер фибрин I ($о1иЫ1е)> удерживаясь водородными связями - это растворимые фибриновые комплексы. Последующий гидролиз этих комплексов под действием тромбина приводит к выделению фибринопептида В. Тромбин активирует ФХШ, который в присутствии Са++ связывает боковые цепи полимеров. Образуется сеть фибри-новых волокон фибрин II (insjlubile), что прочно удерживает тромбоцитарную массу на месте травмы. Антикоагулянты - вещества, способные блокировать активированные факторы свертывания. /. Предшествующие (первичные): • Антитромбин III (АТ III, гепариновый кофактор 1) - ингибитор тромбина, ФХа, Ф1Ха, ФХ1а, ФХПа. 75-90 % антикоагулянтной активности. Эффект АТ III потенцируется гепарином. • Гепарин - синтез в тучных клетках. Действует только при наличии АТ III. • а,2-макроглобулин (около 3% антитромбиновой активности). • а/-антитрипсин - нейтрализует ФХ1а и активированный протеин С. • С1~ингибитор - 95% ФХ1а и более 50% всего калликреина. Дефицит его приводит к анщоневротическому отеку. • Протеин С - инактивирует ФУа и ФУШа. • • Тромбомодулин - гликопротеид, фиксированный на цитоплазматической мембране эндотелия. Связывает и инактивирует тромбин, но не ослабляет его активирующего действия на протеин С. П. Образующиеся (вторичные): АТ1 (фибрин), продукты деградации фибрина (ПДФ). Фибринолиз — процесс растворения фибринового свертка в результате ферментативных реакций. Интенсивность фибринолиза определяется активностью плазмина, образующегося из неактивного плазминогена. Активаторы плазминогена образуются сосудистой стенкой (внутренняя активация). Внутренний путь активации включает активацию белков контактной фазы: факторов XII, XI, прекалликреина, высокомолекулярного кининогена. Внешняя активация происходит в результате действия тканевого активатора плазминогена (ТАП), урокиназы. Нефизиологическими активаторами плазминогена являются стрептокиназа (гемолитический стрептококк), антистреплаза (комплекс человеческого плазминогена и бактериальной стрептокиназы), стафлокиназа (золотистый стафилококк) Ингибиторы плазмина: (Х2-антиплазмин? аг-макроглобулин, а!-антитрипсин, АТ III, Срингибитор, ингибиторы активатора плазминогена 1, 2, Клеточная фибринолитическая система представлена некоторыми биологически активными веществами, продуцируемыми лейкоцитами, макрофагами и тромбоцитами. Методы исследований гемостаза, Сосудисто-тромбоцитарный гемостаз: 1. Время капиллярного кровотечения (по Дъюку). Метод основан на измерении длительности кровотечения после прокола мочки уха. В норме время кровотечения составляет 2-5 мин. Укорочение времени - активация сосудисто-тромбоцитарного гемостаза. Удлинение - угнетение сосудисто-тромбоцитарного гемостаза. 2. Количество тромбоцитов. Микроскопический метод, основан на подсчете числа тромбоцитов в камере Горяева с использованием фазовоконтрастной приставки к микроскопу. Нормальное количество тромбоцитов в крови 150-400x109/л. Уменьшение числа тромбоцитов - тромбоцитопения, увеличение - тромбоцитоз 3. Гемолизат-агрегационный тест. Определяется время появления видимых агрегатов тромбоцитов после добавления в цитратную, богатую тромбоцитами плазму, гемолизата эритроцитов. Время агрегации при использовании максимальной дозы гемолизата -11-17 с. отражает способность тромбоцитов к агрегации. Укорочение времени - усиление агрегации тромбоцитов (активация и гиперагрегация тромбоцитов), удлинение - снижение способности тромбоцитов к агрегации (тромбоцитопатия). Коагуляционный гемостаз: 1. Время свертывания (по Ли-Уайту). Заключается в измерении времени коагуляции ве 2, Протромбиновый (тромбопластиновый) тест Квика. Характеризует процесс сверты уменьшение индекса - уменьшение активности коагуляционного гемостаза по внешнему пути свертывания. 3. Активированное парциальное (частичное) тромбопластиновое время (АПТВ-АПЧВ). Заключается в измерении времени свертывания рекальцифицированной плазмы в условиях стандартной активации фосфолипидами (кефалином) и контактом с чужеродной поверхностью (каолином). В зависимости от вида стандарта АПТВ (АПЧВ) составляет 30-40 с. Характеризует внутренний путь свертывания. Укорочение времени - усиление активности коагуляционного гемостаза по внутреннему пути свертывания, удлинение - уменьшение активности коагуляционного гемостаза по внутреннему пути свертывания. 4. Тромбиновое время. Оценивается конечный этап коагуляции (образование фибрина из фибриногена) по времени свертывания плазмы под влиянием стандартного раствора тромбина. Нормальный показатель равен 14-16 с. Характеризует конечный этап гемокоа-гуляции — образование фибрина. Изменение конечного этапа гемокоагуляции - образования фибрина. Укорочение времени - активация конечного этапа, удлинение - угнетение конечного этапа 5. Этаноловый тест. При добавлении к плазме 50% этанола через 10 минут появляется желеобразная масса (паракоагулят). Это говорит о наличии в плазме комплексов фибрин-мономеров с фибриногеном и продуктами его деградации плазмином, то есть о наличии активного тромбина и тромбообразования. Тест проводится при температуре не выше 26°С, результат определяется ровно через 10 минут. В норме паракоагулят не обнаруживается, т.е. тест - отрицательный. Образование паракоагулята через 10 минут при температуре 26°С - качественный показатель скрытой гиперкоагуляции, свидетельствующий о наличии в плазме активированного тромбина при условии, что другие показатели, характеризующие гемокоагуляцию, в пределах нормы или удлинены. 6. Фенантролиновый тест. Основан на оценке времени появления в бедной тромбоцитами незамороженной цитратной плазме хлопьев фибрина (паракоагулята) после добавления к ней фенантроли-на. В отличие от этанолового теста, является более точным количественным методом определения в плазме растворимых фибрин-мономерных комплексов (РФМК), что позволяет более достоверно выявить тромботические и предтромботические состояния. У здоровых людей время паракоагуляции составляет от 52 с и более. Время паракоагуляции соответствует различным концентрациям РФМК в плазме. Нормальные показатели — 30-50 мкг/мл. Увеличение количества РФМК в плазме - скрытая гиперкоагуляция при условии см. этаноловый тест. В таблице 2.5.1. представлен типовой пример исследования системы гемостаза. Табица 2.5.1. Пример типового исследования системы гемостаза.
Заключение: Угнетение тромбоцитарно-сосудистого гемостаза. Тромбоцитопатия //. Тромбофилии, связанные с повышением активности тромбоцитов и повреждением сосудистой стенки.
///. Гиперкоагуляции, связанные с уменьшением антикоагулянтной активности крови и угнетением фибринолиза. Активация коагуляционного гемостаза возникает при увеличении содержания прокоагулянтов в крови (стресс, гиперлипидемии, атеросклероз, ГБ, опухоли, лечение эстрогенами) и снижении антикоагулянтной активности крови (врожденный дефицит АТ III, приобретенный дефицит АТ III (заболевания печени, синдром диссиминированного внут-рисосудистого свертывания (ДВС-синдром), гипогепаринэмия (атеросклероз, ГВ> сахарный диабет), дефицит протеинов С и 8). Угнетение фибринолиза вследствие снижения выработки и выделения активаторов плазминогена (атеросклероз, ГБ, ревматоидный артрит), увеличение содержания анти-плазминов (наследственный, при болезнях почек), дефицит калликреин-зависимой активации. IV- Гипокоагуляиии связанные с нарушениями в сосудисто- тоомбоиитарном гемостазе. Нарушение сосудистого гемостаза может быть выявлено при наличии гемангиом, геморрагических телеангиоэктазий, наследственного микроангиоматоза. Угнетение тромбоцитарного гемостаза может быть обусловлено тромбоцитопенией вследствие усиленного разрушения тромбоцитов (болезнь Верльгофа или идиопатическая тромбопитопеническая пурпура, изоиммунная неонатальная антигеноконфликтная тром-боцитопения - несовместимость тромбоцитов матери и плода, гетероиммунная тромбоци-топения, например, при введении противостолбнячной лошадиной сыворотки), угнетения\ мегакариоцитарного ростка костного мозга (при инфекционных заболеваниях, болезнях системы крови, воздействии химических, лучевых факторов, лекарственных препаратов)! или тромбоцитопатией - качественной неполноценностью тромбоцитов (тромбастения Гланцмана - дефицит тромбостенина, ДВС-синдром, В12 - дефицитная анемия, цирроз печени, лекарственные - антибиотики, цитоетатики, антигистаминные). V. Гипокоагуляиии. связанные с дефицитом плазменных прокоагулянтов избытком антикоагулянтов и гиперфибринолизом. Угнетение коагуляционного гемостаза наблюдается при наеледственном (гемофили С (XI), гемофилия В (IX), гемофилия А (VIII), болезнь Виллебранда обусловлена количе ственной и качественной патологией ФВ (зрелая форма ФВ обеспечивает адгезию трол боцитов к коллагену сосудистой стенки и стабилизирует молекулу ФУШ, увеличивая ш риод ее полусуществования и транспортируя в места активного образования гемостатич ской пробки)) и приобритенном дефицит факторов коагуляции (синдром массивнь трансфузий, заболевания печени, дефицит витамина К (необходим для синтеза VII, X,: IX), образование блокирующих антител к факторам свертывания (ревматоидный артр* плоскоклеточный рак), повышении антикоагулянтной активности крови эндогенного (/ III, гепарин - парапротеинемии, антифосфолипидный синдром при коллагенозах, лейкоз анафилактический шок) и экзогенного (передозировка гепарина) происхождения. Гиперфибринолиз первичный - при массивном поступлении в кровь активаторов пла миногена (стресс - адреналин, инфекция - стрептокиназа), вторичный - в ответ на увели чение образования фибрина (ДВС-синдром). VI. ДВС-синдром. Стадии. Механизмы. Фармакологическая коррекция в раз-личные стадии. ДВС-синдром - типовой патологический процесс с образованием микротромбов, нарушением функции органов и тканей и кровоточивостью. ДВС - всегда явление вторичное, следствие основного патологического процесса, способствующего активации системы свертывания крови и генерации тромбина. Тромбин вызывает отложение фибрина в микроциркуляторном русле с потреблением тромбоцитов и факторов свертывания. Плазмин обеспечивает протеолиз фибрина и факторов свертывания и усугубляет геморрагические осложнения. ДВС возникает при заболеваниях, способствующих выделению в кровь прокоагулян-тов, которые вызывают распространенное повреждение эндотелия или стимулируют тромбоциты и макрофаги (септическое течение инфекционного процесса, злокачественные новообразования, акушерские осложнения, травмы и отравления). Стадии: 1. Гиперкоагуляции (полиорганная блокада микроциркуляции). Образование тромбина способствует образованию больших растворимых комплексов фибрин-фибриноген и развитию фибриновых микротромбов, которые вызывают обструкцию микроциркуля-торного русла и полиорганную недостаточность. 2. Гипокоагуляции (коагулопатии потребления). Позднее кровотечение вызвано потреблением тромбоцитов, истощением факторов свертывания и гиперфибринолизом. Увеличивается потребление естественных ингибиторов сериновых цротеаз (антитромбин III, протеин С, протеи | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
| Поделиться: |

 Сладж - это феномен склеивания эритроцитов не только в капиллярах, но и в сосудах различного калибра, в том числе в венах и артериях, с исчезновением границ клеток (нарушение мембраны, агрегация - аглютинация).
Сладж - это феномен склеивания эритроцитов не только в капиллярах, но и в сосудах различного калибра, в том числе в венах и артериях, с исчезновением границ клеток (нарушение мембраны, агрегация - аглютинация).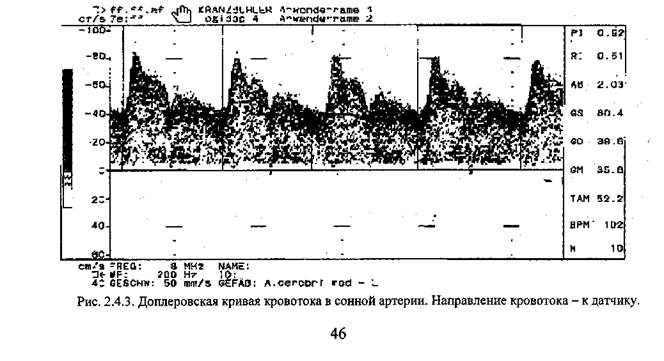
 Сосудистый гемостаз реализуется за счет временного запустевания капилляров и венул, кровотечение из них в первые 20-30 секунд не возникает (эффективен только в сосудах диаметром до 100 мкм). Это явление обусловлено: вазоспазмом (симпатоадренало-вая реакция, серотонин, тромбоксан А2); ввертыванием интимы; выбросом факторов свертывания из стенки сосуда (тканевой тромбопластин); обнажением коллагена.
Сосудистый гемостаз реализуется за счет временного запустевания капилляров и венул, кровотечение из них в первые 20-30 секунд не возникает (эффективен только в сосудах диаметром до 100 мкм). Это явление обусловлено: вазоспазмом (симпатоадренало-вая реакция, серотонин, тромбоксан А2); ввертыванием интимы; выбросом факторов свертывания из стенки сосуда (тканевой тромбопластин); обнажением коллагена. Протеин 8 - кофактор протеина С.
Протеин 8 - кофактор протеина С. Активация сосудисто-тромбоцитарного гемостаза наблюдается вследствие нарушения целостности сосудистой стенки (атеросклероз, артериальная гипертензия, облитерй-рующий тромбангиит, тромбофлебит), первичного изменения метаболизма индукторов агрегации и чувствительности к ним тромбоцитарных рецепторов, вторичного увеличения в крови концентрации индукторов агрегации и дефицита физиологических антиагрегантов (атеросклероз, сахарный диабет, гипертоническая болезнь (ГБ)).
Активация сосудисто-тромбоцитарного гемостаза наблюдается вследствие нарушения целостности сосудистой стенки (атеросклероз, артериальная гипертензия, облитерй-рующий тромбангиит, тромбофлебит), первичного изменения метаболизма индукторов агрегации и чувствительности к ним тромбоцитарных рецепторов, вторичного увеличения в крови концентрации индукторов агрегации и дефицита физиологических антиагрегантов (атеросклероз, сахарный диабет, гипертоническая болезнь (ГБ)).


