Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
V. Нарушение ферментативного спектра миокарда.Содержание книги
Поиск на нашем сайте
Острая сердечная недостаточность (ОСН)- виды, причины и патогенез Пять форм ОСН: а) тампонада сердца, б) полная атрио-вентрикулярная блокада, в) мерцание, фибрилляция желудочков, г) инфаркт миокарда и д) острая закупорка легочной артерии. Тампонада сердца - синдром острой сердечной недостаточности, вызванной внутриперикардиальным сдавлением сердца жидкостью (гемотампонада, перикардит острый экссудативный) или газом. Патогенез нарушений: 1) механическое сдавление тонкостенных отделов сердца и крупных вен → уменьшение наполнения его полостей. Развивается синдром низкого сердечного выброса (резкое уменьшение сердечного и МОС), уменьшение тканевого кровотока, олигоурия, повышение потребления, повышение потребления O2 и увеличение содержания в крови молочной и пировиноградной кислоты и 2) патологический вагусный рефлекс - из-за растяжения перикарда → раздражение nervus vagus → может быть остановка сердца, АД понижается, а венозное повышается. При наличии большого выпота, когда резко ограничивается диастола и сильное затруднена работа сердца - возниает кислородное голодание мозга: беспокойство, чувство тревоги. Нарастает бледность кожи и затем цианоз. Это легко воспроизводится в эксперименте. Полная атрио-вентрикулярная блокада - различают 4 степени атрио-вентрикулярной блокады: 1 степень - удлинение времени предсердно-желудочкового проведения; 2 степень - выпадение некоторых желудочковых комплексов после постепенного удлинения интервала P-Q, но после выпадения желудочкового сокращения проводимость на непродолжительное время улучшается, а затем вновь периоды Венкебаха - Самойлова. При блокаде 3 степени из предсердий в желудочки проводится лишь каждый 2, 3, 4-й импульс и 4 стадия - полная поперечная блокада. Причины: гипоксия, тяжелая патология миокарда с нарушением метаболизма, инфаркт миокарда, интоксикация, рубцы, ревматизм. Нет синхронизации сокращений предсердий (60-70/мин) и желудочков (40-50). Если обе систолы вместе - холостое сокращение желудочков и снижение МО. Нарушение предсердно-желудочковой проводимости - частая причина нарушения сердечного ритма, уступающая по частоте лишь экстрасистолии, мерцательной аритмии и пароксизмальной желудочковой тахикардии. Мерцание желудочков - форма мерцательной аритмии - нарушение ритма сердца с частыми и нерегулярными возбуждениям миокарда и полной разнородностью сердечных сокращений по частоте, силе, причем длительность сердечных циклов значительно колеблется и носит случайный характер. При мерцании частота волн на ЭКГ более 6300/ мин (обычно 500-800/ мин), а при трепетании - менее 300/мин. Глянцевая поверхность миокарда при этом мерцает, напоминая рябь на поверхности воды, в связи с чем это состояние получило название "мерцание" предсердий. Фибрилляция - наличие сокращений миокардиальных волокон при отсутсвии сокращения всего миокарда как целого. Сердечные волокна сокращаются разрозненно и разновременно не выполняя насосную функцию: УО и МО = 0, гибель через 5 мин, человек не может жить. Причины: тяжелая гипоксия, ишемия миокарда, интоксикация, нарушение электролитного баланса, повреждение механическое и электротоком, низкая темпиратура, нервно-психическое возбуждение, применение симпатомемитических средств при наркозе. Наиболее распространенные теории: 1) наличие множества гетеротропных очагов, из-за которых мышечные волокна сокращаются изолированно, а не все вместе, и 2) теория циркуляции волны возбуждения на основе механизма повторного входа из-за множественныых локальных нарушений проводимости в миокарде и проводящей системе сердца. При этом ритм сокращения пораженных волокон отличается от других волокон и создаются условия для фибрилляции желудочков. Патогенетическая терапия - дефибрилляция: 1) приведение всех миокардиоцитов одномоментно в одно состояние абсолютной рефрактерности, применяя одиночный короткий 0,01 сек мощный разряд электрического тока (при прямой дефибрилляции 10-12 А, при наружной - до 30 А) и 2) затем ритмическая стимуляция сокращений сердца электрическим током малой силы как в кардиостимуляторе. Однако есть определенная опасность - при дефибрилляции гибнут миокардиоциты. Инфаркт миокарда (ИМ) (infarctus myocardii) - острое заболевание, обусловленное развитием одного или нескольких очагов некроза в серд. мышце, проявляющиийся различными нарушениями сердечной деятельности и клиническими синдромами, связанными с развитием острой ишемии и некроза миокарда. Некроз может быть и не сосудистого происхождения - электролитно-стероидный. Различают крупноочаговый и мелкоочаговый ИМ с указанием зоны поражения (перегородка, стенка...). В зависимости от распространения некроза по толщине стенки выделяют: а) трансмуральный (поражение распространяется на всю толщину миокарда и прилежащие эндокард и перикард), б) интрамуральный - некроз развивается внутристеночно, в) субэпикардиальный - некроз в слое миокарда, прилежащем к висцеральному листку перикарда и г) субэндокардиальный - у эндокарда. Наиболее частой причиной ИМ является прекращение притока крови к участку миокарда в измененных атеросклерозом коронарных артериях. Эмболия коронарных артерий встречается крайне редко. Чаще всего ИМ развивается при ишемической болезни сердца (ИБС). Огромное влияние имеют функциональные расстройства коронарного кровообращения, рефлекторный спазм коронарных артерий. К факторам риска относят пожилой возраст, увеличение содержания липидов в сыворотке крови, артериальную гипертензию, генетическую предрасположенность, сахарный диабет, ожирение, подагру, гиподинамию, повышенную эмоциональность, курение. Большое значение в развитии ИМ придают нарушениям микроциркуляции, гиперкоагуляция и гиперагрегация, повышение адгезивных свойств тромбоцитов. Резкое сужение просвета коронарных артерий (например, атеросклеротической бляшкой) может создать условия для возникновения острой коронарной недостаточности. В формировании клинических проявлений ИМ участвует ряд патогенетических факторов: 1) Перераздражение интерорецепторов миокарда, эндокарда и висцерального листка перикарда с иррадицией раздражения в спинной мозг, подкорковые структуры и кору головного мозга, что формирует стрессовую реакцию. Это активирует систему гипоталамус - гипофиз - кора надпочечников с повышением в крови катехоламинов - первая фаза стресса. С ней связаны артериальная гипертензия и тахикардия, гипергликемия, эозинопения. Однако чрезвычайно интенсивная боль может вызвать развитие артериальной гипотензии и быть причиной коллапса (collapsus). 2) Острое уменьшение УО вследствие прекращения сократительной деятельности некротизирующегося учаска миокарда является одной из причин развития как преходящей артериальной гипотензии, так и необратимого кардиогенного шока, сердечной астмы, отека легких, поражения внутренних органов. Снижение МО как реакция системы кровообращения, на его поддержание развивается спазм периферических сосудов, повышение АД = централизация кровообращения (мозг, сердце за счет остальных органов). 3) Развитие резорбционно-некротического синдрома и асептического воспаления в связи с высвобождением из некротизированных клеток ферментов и токсических продуктов → увеличение количества тромбоцитов, нейтрофильный лейкоцитоз, увеличение СОЭ. 4) Перераспределение электролитов в области, прилежащей к очагу некроза ведет к возникновению электрической нестабильности миокарда в периинфарктной зоне и создает предпосылки к развитию нарушений ритма: желудочковые экстрасистолии и тахикардии. На ЭКГ - монофазная кривая. В дальнейшем формируется соединительно-тканный рубец, кардиосклероз, истончение стенки сердца и формирование аневризмы. Хроническая сердечная недостаточность (ХСН) часто развивается при недостаточности кровообращения, сопровождается стенокардией в двух формах: 1) повышение уровня метаболизма миокарда при неспособности его обеспечить при физических или эмоциональных нагрузках - стенокардия напряжения; 2) при нормальной метаболической активности миокарда сужен просвет коронарных артерий - стенокардия покоя. ХСН имеет 3 стадии: 1) Начальная, скрытая, проявляется только при физической нагрузке, а в покое гемодинамика и функции органов не нарушены. 2) Выраженная, длительная недостаточность кровообращения с застойными явлениями в малом и большом круге кровообращения, с нарушениями функций органов и обмена веществ в покое. Период А - незначительные расстройства гемодинамики и нарушения функции сердца или только какого-либо его отдела. Период Б - конец длительной стадии с глубокими нарушениями гемодинамики. 3) Терминальная, дистрофическая стадия недостаточности кровообращения с тяжелыми, стойкими нарушениями метаболизма и функции всех органов и необратимыми изменениями внутренних органов. Причины: 1. хроническая коронарная недостаточность → коронаросклероз, ИБС; 2. пороки сердца - врожденные и приобретенные нарушения клапанного аппарата сердца: недостаточность → ретроградный возврат и переполнение камер сердца, стеноз → препятствие кровотоку → увеличение периферического сопротивления; 3. патологические процессы в миокарде - миокардиты, миокардиодистрофии; 4. экстракардиальные причины: а) гипертоническая болезнь, б) увеличение ОЦК, в) болезни легких → затруднение кровотока в правом отделе сердца, г) гипертиреоз - все это истощает энергитику сердца. Клинические проявления ХСН: Одышка - наиболее ранний и частый симптом. Одышка возникает из-за накопления в крови молочной и других кислот, изменения pH, снижение ЖЕЛ. Для выраженной одышки характерны ночные приступы удушья, которые могут перейти в отек легких. Отеки - один из характерных признаков СН - вначале скрытые, сначала на ногах, пояснице, затем по всей подкожной клетчатке. Постепенно увеличивается печень в связи с застойными явлениями при правожелудочковой недостаточности. Набухают и пульсируют шейные вены. Увеличивается селезенка. Страдают функции почек, ЖКТ. На гипоксию реагируют различные системы, но ведущая роль принадлежит сердцу. Формы приспособления сердца при ХСН: гиперфункция и гипертрофия. Гиперфункция - увеличение функции без увеличения массы: а) сначала тахикардия; б) гетерометрическая форма гиперфункции - сердце переполнено избыточным объемом крови при недостаточности клапанного аппарата, увеличение ОЦК, увеличение диастолического наполнения и увеличение УО за счет большего растяжения миокардиоцитов. Сердце перегружено незначительно, почти в норме, в) при стенозах, при препятствиях к выбросу крови увеличивается периферическое сопротивление - диастолическое наполенние камер не меняется, но сила сокращения увеличивается - изометрическая форма. Очень быстро изнашивается миокард, очень опасно. Самая существенная форма приспособления - гипертрофия: полноценный тип мощной долговременной формы приспособления (сердце может увеличиваться до 3 раз). Стадии развития гипертрофии: а) неустойчивой гипертрофии - аварийная - в сердце увеличена мышечная масса, но нагрузка на миокардиоциты больше нормы → истощение энергетических и пластических ресурсов; б) устойчивая - компенсаторная гипертрофия - масса возрастает до восстановления нормальной нагрузки на мышечное волокно, восстанавливаются энергетические ресурсы, работа как в норме; в) но затем истощение - т.к. при нарастании массы миокарда нет параллельного роста сосудов и нервного аппарата - развивается недостаточность сосудистой и нервной регуляции.
АРТЕРИАЛЬНЫЕ ГИПЕРТЕНЗИИ Артериальная гипертензия (АГ) (от греч. hyper – чрезмерный, лат. tensio – напряжение) - стойкое повышение артериального давления - важный симптом патологических состояний и заболеваний, сопровождающихся либо увеличением сопротивления артериальному кровотоку, либо повышением сердечного выброса, либо сочетанием этих факторов. В норме АД=110-140 / 65-90 мм рт. ст., а 150 / 94 - переходная зона, еще не гипертензия. СДЦ играет главную роль в нейрогуморальной регуляции кровообращения, в нем можно выделить 3 взаимосвязанных отдела: а) группа нейронов, расположенных в латеральных частях продолговатого мозга - их постоянная активность через пре - и постганглионарные симпатические нейроны оказывает тоническое активизирующее влияние на функцию сердца и гладкой мускулатуры сосудов; б) медиально расположенные нейроны, обладающие противоположным (тормозным) действием на пре - и постганглионарные симпатические нейроны и уменьшающие влияние адренергической иннервации на кровообращение; в) дорсально расположенное ядро блуждающего нерва, оказывающего тормозящее влияние на сердце. Эфферентные механизмы (периферическое звено функциональной системы) реализуются через симпатический отдел нервной системы и эндокринную (гипофиз, надпочечники, щитовидная железа – повышение АД). Но есть и механизмы обратной связи - депрессорный механизм - при растяжении дуги аорты и синокаротидной зоны (при растяжении стенки общей сонной артерии) усиливается депрессорное влияние на СДЦ и тормозит его Длительная или значительная артериальная гипертензия сама по себе формирует патологическое состояние, которое проявляется перегрузкой и гипертрофией сердца, напряжением адаптационных механизмов регионарного кровообращения. Гипертензия - системное повышение давления в артериях большого круга кровообращения, а гипертония - повышение мышечного тонуса - спазмирование сосудов. Актуальность: высокая частота, ведущее место - гипертоническая болезнь - у 5-6% населения, высокая опасность атеросклероза, инсульта, тромброза сосудов и т.д. Артериальная гипертензия - одна из форм сосудистой недостаточности, как и артериальная гипотензия - сосудистая недостаточность в форме гипотензии (есть еще и сердечная недостаточность - но чаще смешанные формы - сердечно-сосудистая недостаточность).
Виды, причины и механизмы артериальных гипертензий: 1. Гипертоническая болезнь - самостоятельная нозологическая форма, ведущим и первичным признаком является повышение АД (90-95 % артериальных гипертензий) 2. Вторичные - симптоматические артериальный гипертензии - в связи с каким либо заболеванием, первично не связанные с повышением АД, но оно повышается по ходу заболевания как симптом болезни: а) нефрогенная (почечная - 7-8 %), б) ренопривная (при удалении обеих почек), в) эндокринопатическая (надпочечниковая), г) неврогенная, д) гемодинамическая, е) застойная (при пороках сердца, осложненных сердечной недостаточностью). По характеру повышения АД различают: а) систолическую АГ (повышение систолического АД при нормальном или сниженном диастолическом развивается за счет повышения УО, б) систоло - диастолическую при увеличении и УО и сопротивления кровотоку и в) диастолическую при повышении периферического сопротивления кровотоку при снижении пропульсивной функции левого желудочка сердца. По течению выделяют 5 вариантов АГ: а) транзоторная артериальная гипертензия - редкие, кратковременные и незначительные повышения АД, нормализуется без лечения, б) лабильная (умеренное и нестойкое частое повышение АД, нормализующееся под влиянием лечения), в) стабильная АГ - устойчивое и часто значительное повышение АД, снижение которого возможно только при активной гипотензивной терапии, г) злокачественная АГ - с очень высоким АД, особенно диастолическим (выше 120 мм), с быстрым прогрессированием, значительной толерантностью к лечению + ренопатия и быстро развивается почечная недостаточность, д) АГ с кризовым течением, причем пароксизмальные повышения АД могут быть на фоне любых исходных значений - пониженного, нормального или повышенного АД.
Патогенез вторичных артериальных гипертензий. В возникновении и поддержании многих форм симптопатический гипертеннзии большое значение имеет гуморальная система ренин – ангиотензин - альдостерон. Фермент ренин вырабатывается гранулярными клетками юкстагломерулярного аппарата почек. При взаимодействии с α2-глобулиновой фракцией плазмы крови - ангиотензиногеном (вырабатываемым печенью), образуется ангиотензин-I (также не оказывающий влияния на тонус сосудистой стенки. Но под влиянием конвертинэнзима превращается в ангиотензин-II, обладающий мощным вазопрессорным действием. Есть прямая связь между содержанием ангиотензина-II и альдостерона. Альдостерон (гормон коры надпочечников - минералокортикоид) повышает реабсорбцию натрия в почках и задержку его в мышечных элементах артериол, что сопровождается их набуханием и повышением чувствительности рецепторов сосудистой стенки к прессорным влияниям (например, норадреналина). Между содержанием в крови альдостерона и активностью ренина существует в норме обратная зависимость. В физиологических условиях уменьшение почечного кровотока в клетках юкстагломерулярного аппарата вызывает обильную грануляцию и усиление синтеза ренина. Эти клетки выполняют роль волюморецептров и участвуют в регуляции уровня АД, реагируя на изменения количества притекающей к клубочку крови. Образующийся ангиотензин повышает АД, улучшает перфузию почек и уменьшает интенсивность синтеза ренина. Однако обратная зависимость между выработкой ренина и АД нарушается при многих патологических состояниях - в первую очередь при нефрогенной и особенно при реноваскулярной гипертензии.
1. Почечная артериальная гипертензия: а) артериальная гипертензия может быть при нефропатии беременных; при аутоиммуно-аллергических заболеваниях почек, как воспалительных (диффузные гломерулонефриты, коллагенозы), так и при дистрофических (амилоидоз, диабетический гломерулосклероз). Например, у больных с хроническим диффузным гломерулонефритом имеется пролиферативно-склерозирующий процесс в почечной ткани с запустеванием части клубочков, сдавлением приводящих сосудов и в итоге повышением АД. б) при инфекционных интерстециальных заболеваниях почек - при хроническом пиелонефрите наблюдается гипертрофия и гиперплазия юкстагломеруллярного аппарата и стойкое усиление секреции ренина. Нефрогенный характер артериальной гипертензии при хроническом одностороннем пиелонефрите подтверждается результатами хирургического лечения - если вторая почка без патологии, то после удаления больной почки АД нормализуется. в) реноваскулярная или вазоренальная - при нарушении кровоснабжения почек и при врожденных сужениях артерий, или гипоплазии их, аневризмах, при приобретенных поражениях артерий при атеросклерозе, тромбозе, кальценозе, сдавлении рубцами, гемотомами, новообразованиями (в эксперименте - винтовой зажим, резиновая капсула). В этом случае ведущая роль в стимуляции секреции ренина принадлежит уменьшению кровотока в почечных артериях.Образующийся ангиотензин-II оказывает прямое прессорное действие и стимулирует синтез альдостерона, который в свою очередь увеличивает накопление Na+ в сосудистых стенках и усиливает прессорные реакции. г) при урологических заболеваниях почек и мочевыводящих путей (врожденных - гипоплазия почек, поликистоз) или приобретенных (почечнокаменная болезнь, опухоли структуры мочевыводящих путей), при травмах почек, с образованием гематом в околопочечниковой клетчатке. д) ренопривная артериальная гипертензия развивается после удаления обеих почек. В норме в почках вырабатываются антигипертензивные факторы - кинины и простагландины и при их недостатке повышается АД. Особенное значение при этой гипертензии имеет нарушение равновесия в содержании в тканях и тканевых жидкостях Na+ и K+. Ренопривная гипертензия сопровождается отеками, причем отеки исчезают и АД нормализуется, если при лечении применяется аппарат "искусственная почка" с соответствующим подбором электролитов в перфузуонной жидкости.
2. Неврогенные симптоматические артериальные гипертензии: а) центрогенные - связанные с поражением головного мозга - энцефалит, опухоли, кровоизлияния, ишемия, травмы (в эксперименте - путем создания у животных отрицательных эмоций - страха, ярости, невозможности избежать опасности; перенапряжения ВНД - выработка сложных дифференцировочных рефлексов, перестройка стереотипов, извращение суточных ритмов, перевязка сосудов, сдавление мозговой ткани). б) периферические - связанные с поражением периферической НС - при полиомиэлите, полиневрите; рефлексогенная (растормаживания) у больных атеросклерозом сосудистая стенка малорастяжима → уменьшение раздражения барорецепторов и повышение АД (в эксперименте при перерезке депрессорных нервов от аорты или каротидных синусов).
3. Эндокринопатическая артериальная гипертензия: а) при гормональных опухолях гипофиза – акромегалия + повышение АД, болезнь Иценко-Кушинга + повышение уровня кортизола; б) при опухолях коры надпочечников – повышение уровня глюкокортикоидов, минералокортикоидов → гиперальдостеронизм, феохромоцитома → повышение уровня норадреналина; в) при диффузном токсическом зобе – повышение уровня тироксина → гиперкинезия; г) при дискринии в период климакса.
4. Гемодинамическая артериальная гипертензия: а) при снижении эластичности стенок аорты и крупных сосудов не происходит адекватного растяжения сосудистой стенки пульсовой волной, проходящей по сосудам; б) гипертензия при недостаточности аортального клапана обусловлена увеличением конечного диастолического объема крови в левом желудочке в следствие регургитации крови из аорты в период диастолы; в) гипертензия при коарктации аорты связана с одной стороны с резким повышением сопротивления кровотоку на участке сужения аорты, а с другой стороны - с нарушением кровоснабжения почек, поскольку почечные артерии отходят ниже места коарктации; г) сужение сонных, позвоночных или базиллярной артерии ведет к ишемизации мозга - цереброишемическая артериальная гипертензия; д) чисто диастолическая артериальная гипертензия развивается при повышении периферического сопротивления артериальному кровотоку из-за снижения пропульсивной функции левого желудочка при миокардитах или надостаточностью его из-за перенапряжения или нарушения венозного возврата крови к сердцу.
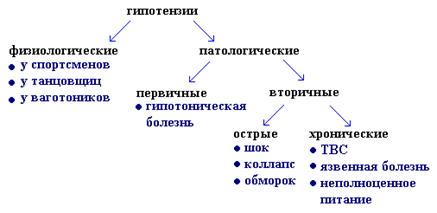
Гипертоническая болезнь (ГБ)- эссенциальная, первичная - основными проявлениями которой являются: 1. повышенное АД с частыми церебральными расстройствами сосудистого тонуса; 2. стадийность в развитии симптомов; 3. выраженная зависимость от функционального состояния нервных механизмов регуляции АД; 4. отсутствие видимой причинной связи болезни с первичным органическим поражением каких-либо органов или систем. Это и отличает ГБ от вторичных (симптоматических артериальных гипертензий), в основе которых лежит поражение внутренних органов или систем, регулирующих АД. Ведущий, пусковой фактор ГБ - спазм артерий в следствие растормаживания СДЦ и возникновения в нем патологической доминанты (застойного, длительного, иннертного возбуждения, подкрепляющегося неспецифическими раздражителями и не имеющего биологической целесообразности для организма). Основной причиной ГБ является острое или длительное эмоциональное перенапряжение, ведущее к развитию невроза и нарушению нервных механизмов регуляции АД на фоне слабости основных корковых процессов. Очевидно, есть еще какие-то приобретенные или врожденные особенности организма (в т.ч. особенности личности). Возможно, к развитию ГБ предрасполагают генетически обусловленные особенности обмена веществ - отмечено, что у родственников больных ГБ частота этого заболевания выше, чем среди населения в целом. Отмечена высокая заболеваемость ГБ у однояйцевых близнецов. Определенное значение имеет избыточное потребление поваренной соли И есть еще одна теория - роль наследственного дефекта клеточных мембран, изменяющего проницаемость мембран для электролитов и как следствие этого: 1. повышается концентрация Na+ в клетке и снижается концентрация K+ и 2. увеличивается концентрация свободного Ca2+, что повышает сократимость клетки и высвобождает агенты симпатоадреналового действия. Согласно этой теории - это и есть причина ГБ, а эмоциональный стресс - как условие для выявления патологии. Уже в начальном периоде ГБ в патогенез включаются изменения со стороны гуморальных прессорных и депрессорных систем. Их активация носит компенсаторный характер и возникает как реакция на перенапряжение и нарушение трофики нервных клеток головного мозга. Быстро формируется гиперкинетический тип кровообращения - повышение сердечного выброса и мало меняется общее периферическое сопротивление сосудов. Но очень часто рано повышается сосудистое сопротивление в почках - развивается ишемизация и усиливается активность ренин-ангиотензиновой системы. В этот период, пока растяжимость и эластичность аорты еще сохранены, происходит перенастройка барорецепторов синокаротидной зоны и дуги аорты, что выражается в сохранении нормальной активности аортального нерва при повышенном АД (а в норме - депрессорный эффект). Возможно, эта "перенастройка" барорецепторов обеспечивает задачи регуляции кровоснабжения, сдвигая его параметры на оптимальный для новых условий уровень. Но затем утолщение стенок аорты и сонных артерий и уменьшение их эластичности на более поздних стадиях ГБ приводит к снижению чувствительности барорецепторов и уменьшению депрессорных реакций. Влияние ЦНС на тонус артерий и особенно артериол, а также на функцию миокарда опосредуется через симпато-адреналовую систему, включая сосудодвигательные центры подбугорья, симпатический нерв, надпочечники, α- и β-адренергические рецепторы сердца и сосудов, что в итоге ведет к гиперкинезии сердца и констрикции сосудов. В начальных стадиях из-за повышения сердечного выброса почечный кровоток может бытьусилен и это ведет к повышению мочеотделения и экскреции Na+. Потеря натрия стимулирует секрецию альдостерона, задерживающего натрий в тканях и стенках артериол, что повышает их чувствительность к прессорным воздействиям. Т.о., формируются порочные круги: 1) усиление секреции катехоламинов + почечный фактор → ренин-ангиотензиновый механизм → СДЦ → повышение уровня катехоламинов; 2) ренин-ангиотензиновый и альдостероновый механизмы потенцируют друг друга; 3) ослабление депрессорного механизма способствует растормаживанию СДЦ → повышение АД и снижение возбудимости депрессорных барорецепторов. Стабильность и выраженность артериальной гипертензии при гипертонической болезни определяется не только активностью прессорных систем организма, но и состоянием ряда депрессорных систем, в том числе кининовой системы почек и крови, активностью ангиотензиназы и почечных простагландинов. Повышение активности депрессорных механизмов на ранних стадиях гипертонической болезни следует рассматривать как реакцию на артериальную гипертензию. В физиологических условиях депрессорные системы нейтрализуют действие факторов, вызывающих повышение АД, поскольку между прессорными и депрессорными системами есть четкое взаимодействие. Период стабилизации гипертонической болезни характеризуется новыми гемодинамическими сдвигами: постепенным уменьшением сердечного выброса и нарастанием общего периферического сосудистого сопротивления. Большую роль в этот период играет снижение компенсаторных резервов депрессорных нервных и гуморальных механизмов (гуморальные депрессорные системы, чувствительность барорецепторов дуги аорты и синокаротидной зоны). Постоянное напряжение гипоталамических структур, ответственных за регуляцию АД, приводит к тому, что первоначально нестойкое и кратковременное повышение тонуса артериол (и в особенности артериол почек) становится постоянным.Поэтому в патогенезе гипертонической болезни в период стабилизации все большую роль играют гуморальные факторы. Функциональное (вазоконстрикция), а затем и органическое (артериаологиалиноз) сужение почечных артериол вызывает гиперфункцию и гипертрофию юкстагломеруллярного аппарата и повышение секреции ренина. В патогенез нередко включаются новые звенья - в частности повышение прессорной активности гипоталамических структур под влиянием ишемии, связанной с вазоконстрикцией и ангиопатией сосудов головного мозга. У значительной части больных развивается атеросклероз аорты, ведущий к потере ее эластичности, что способствует дальнейшему повышению систолического давления и разрушению барорецепторных зон. Атеросклероз артерий головного мозга и почечных артерий создает предпосылки к стабилизации повышенного АД в связи с постоянной ишемией мозга и почек. Рано возникает перегрузка сердца и развивается сердечная недостаточность. АРТЕРИАЛЬНЫЕ ГИПОТЕНЗИИ Гипотензии - понижение артериального давления ниже 100/60 мм рт.ст. (для лиц старше 30 лет - ниже 105/65 мм рт. ст.) или при снижении среднединамического АД ниже 75 (90/60:2=75). Классификация:
Первичная (эссенциальная) артериальная гипотензия некоторыми авторами рассматривается как гипотоническая болезнь - гипотензивный тип нейро -циркуляторной дистонии. Предполагается, что в патогенезе первичной артериальной гипотонии играют роль нарушения высших вегетативных центров вазомоторной регуляции, это ведет к стойкому уменьшению общего периферического сопротивления при недостаточном увеличении сердечного выброса. Течение и клиническое проявления первичной артериальной гипотензии не закономерны. Весной и летом чаще обострения, а так же после острых инфекционных заболеваний. Встречается заболевание чаще у женщин 31-40 лет. При развитии у детей и подростков придают значение наследственной отягощенности, несоблюдению режима дня, конфликтным ситуациям в школе или дома, перенесенным инфекционным заболеваниям. Острая артериальная гипотензия чаще всего является следствием острой сердечно-сосудистой недостаточности или сосудистой недостаточности при шоке различного генеза или коллапсе, при внутреннем кровотечении и кровопотере, при внезапном перераспределении массы циркулирующей крови, при тяжелых интоксикациях, инфекциях (грипп, сыпной и брюшной тиф, пищевые токсикоинфекции, дизентерия), отравлении различными ядами, при неправильном применении нейролептиков, ганглиоблокаторов, симпатолитиков. Из островозникающих гипотензий наиболее важное место занимает шок - типовой фазово-развивающийся патологический процесс, возникающий вследствие расстройств нейрогуморальной регуляции, вызванных экстремальными воздействиями и характеризуется уменьшением кровоснабжения тканей, нарушением обменных процессов, гипоксией и угнетением функций организма. Коллапс - остро развивающаяся сосудистая недостаточность с падением сосудистого тонуса и острым понижением ОЦК. При этом уменьшается приток венозной крови к сердцу, снижается серд. выброс, понижается АД и венозное давление, нарушается перфузия тканей и обмен веществ, развивается гипоксия головного мозга и угнетаются жизненноважные функции организма. Коллапс развивается как осложнение при тяжелых патологических состояниях и острых заболеваниях внутренних органов - при перитоните, остром панкреатите, что связано с эндогенной интоксикацией. Инфекционный коллапс развивается как осложение при острых менингоэнцефалитах, брюшном и сыпном тифе, острой дизентерии, и т.п. в связи с интоксикацией эндо- и экзотоксинами микроорганизмов, преимущественно влияющей на ЦНС или на рецепторы пре- и посткапилляров. Гипоксический коллапс может быть в условиях понижения O2 особенно в сочетании с пониженным барометрическим давлением. Причиной циркуляторных нарушений здесь будет недостаточность приспособительных реакций организма, что ведет к гипоксии, воздействующей прямо или косвенно через рецепторный аппарат системы на СДЦ. Развитию коллапса способствует гипокапния (следствие гипервентиляции, что ведет к расширению сосудов, депонированию и понижению ОЦК). Ортостатический коллапс (возникает при быстром переходе из горизонтального в вертикальное положение и обусловлен перераспределением крови с увеличением общего объема венозного русла и снижением венозного возврата к сердцу. В основе его лежит недостаточность венозного тонуса. Он может возникать в послеоперационном периоде при быстрой эвакуации асцитической жидкости или в результате спинномозговой или перидуральной анестезии. Одной из частых форм является геморрагичесий коллапс, развивающийся при острой массивной кровопотере в связи с быстрым уменьшением ОЦК. Такое же состояние может возникнуть в следствие обильной плазмопотери при ожогах, водно-электролитных расстройствах при тяжелой диарее, неукротимых рвотах, при нерациональном применении мочегонных средств. Коллапс может быть при острых заболеваниях сердца, сопровождающихся резким и быстрым понижением УО (инфаркт миокарда, гемоперикард, острый миокардит, при тромбоэмболиях легочной артерии). Острая сердечнососудистая недостаточность при этих состояниях часто называется синдром малого выброса (при кардиогенном шоке). В патогенезе коллапса можно условно выделить два основных механизма, которые часто сочетаются. Один механизм заключается в падении тонуса артериол и вен в результате воздействия инфекционных, токсических, физических, аллергических, и других факторов непосредственно на сосудистую стенку, СДЦ и сосудистые зоны. При недостаточности компенсаторных механизмов снижение периферического тонуса сосудов (парез сосудов) ведет к патологическому повышению емкости сосудистого русла, понижению ОЦК с депонированием крови в некоторых сосудистых областях, понижением венозного притока к сердцу, повышением ЧСС, понижением АД. Другой механизм связан непосредственно с быстрым понижением массы циркулирующей крови (например, при массивной кровопотере и плазмопотере, когда это превосходит компенсаторные возможности организма). Возникающий в ответ на это рефлекторный спазм мелких сосудов + повышение ЧСС под влиянием повышенного выброса катехоламинов может оказаться недостаточными для сохранения нормального уровня АД. Понижение ОЦК снижает возврат крови к сердцу и соответственно понижает УО, нарушает систему микроциркуляции. Кровь скапливается в капиллярах, понижается АД. Развивается гипоксия циркуляторного типа и метаболический ацидоз, которые ведут к повреждению сосудистой стенки, повышению ее проницаемости. Это способствует переходу воды и электролитов из крови в межклеточное пространство. Нарушаются реологические свойства, возникает гиперкоагуляция крови, патологическая агрегация эритроцитов и тромбоцитов, создаются условия для образования микротромбозов. Обмо |
||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 294; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.226.28.97 (0.02 с.) |