Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Лечении гнойно-септических инфекцийСодержание книги
Поиск на нашем сайте
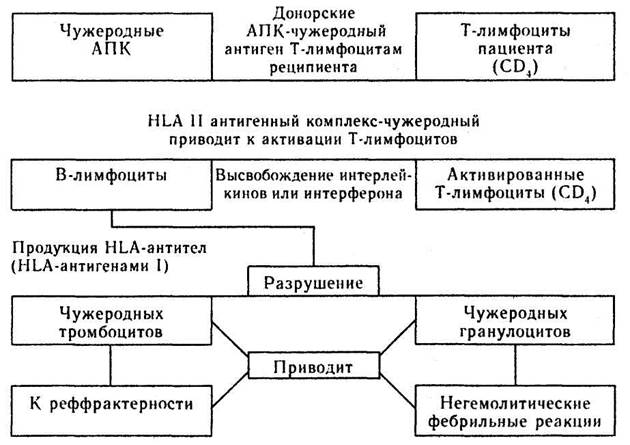
В качестве критерия эффективности антибактериального лечения оценивают в основном клинические данные, т. е. снижение температуры тела, положительные сдвиги в гемограмме и урограмме, снижение Fi O2 с 0,8—0,6 до 0,21 у больных на ИВЛ и при этом сохраняющаяся синхронность больного с респиратором служит еще одним из показателей адекватной антибактериальной терапии у больных реанимационного профиля. Большое значение имеет систематический микробиологический контроль. Критериями эффективности проводимой терапии являются: элиминация возбудителя из гнойно-септического очага или из крови после предшествующей бактериемии, уменьшение степени обсемененности микробов в ране. Положительным фактом является исчезновение микробных ассоциаций при сохранении одного возбудителя, обладающего высокой чувствительностью к разным антибактериальным препаратам. В настоящее время все более широкое применение в комплексной терапии гнойно-септических осложнений кесарева сечения, паретических состояний кишечника находят такие современные методы как плазмаферез в сочетании с озонотерапией. При вышеуказанных осложнениях, как правило, перитонеальный экссудат, наложения фибрина, инфицированные кровяные сгустки и девитализированные ткани служат питательной средой для микроорганизмов и не всегда доступны воздействию антибиотиков и антисептиков. Плазмаферез и озонотерапия расширяют возможности лечебных воздействий на системном и регионарном уровнях. Это объясняется их детоксикационными, иммунокорригирующими, реокорригирующими и бактерицидными свойствами. Лечебный плазмаферез проводится в двух режимах — в прерывистом с использованием мешков «Гемакон 500/300» и в непрерывном на сепараторе крови «Vivacel 1», «Haemonetics» и др. Техника прерывистого плазмафереза включает в себя следующие этапы: 1. Пунктируют локтевую вену. 2. Начинают введение плазмозамещающего раствора. Количество раствора, вводимого до забора крови, зависит от тяжести состояния женщины, в среднем составляет от 200 до 400 мл. 3. Производят эксфузию крови (400 мл) в пластиковые контейнеры типа «Гемакон 500/300». 4. Продолжают введение плазмозамещающих растворов. 5. Отделяют форменные элементы крови от плазмы в рефрижераторной центрифуге (скорость вращения 4000 об/мин, время 15 мин). 6. Плазму переводят в мешок-спутник, форменные элементы крови разводят 150 мл физиологического раствора и реинфузируют. 7. Процедуру повторяют 2—3 раза, что позволяет удалить 500—700 мл плазмы (без гемоконсерванта). Курс лечения состоит из трех сеансов плазмафереза с интервалом 1—2 дня с последующей озонотерапией. Основными свойствами озона, обусловливающими целесообразность его применения в профилактике и лечении гнойно-септических осложнений, являются его бактерицидное и противовирусное действия. Механизм бактерицидного действия озона заключается проницаемость для него биомембран. Вследствие этого первичной мишенью биоцидного действия озона являются плазматические мембраны. Непосредственной причиной гибели бактерий при действии озона являются локальные повреждения плазматической мембраны, приводящие к утрате жизнеспособности бактериальной клетки и/или способности ее к размножению. Озон обладает химически обезвреживающим действием на микробные токсины. Значительным является трофическое воздействие на питание клеток. Это объясняется особенностью озоновых молекул, которые переносят большую часть энергии, присущей им с момента образования. Озон значительно влияет на течение воспалительного процесса: с одной стороны ослабляет влияние стресса, обладает болеутоляющим действием; с другой — регулирует ход защитных реакций, уменьшая деструктивную фазу воспаления, что в свою очередь предотвращает рубцевание. При воздействии озона на кровь резко повышается парциальное давление кислорода и усиливаются окислительно-восстановительные вне- и внутриклеточные процессы, связанные с выработкой и утилизацией энергетических субстратов, преобразованием и синтезом биологически активных веществ (катехоламины, серотонин, гистамин и др.). При этом отмечается усиление активности иммунокомпетентных клеток периферической крови с включением эндогенных дезинтоксикационных механизмов (утилизация недоокисленных продуктов, восстановление рН, уменьшение в крови конечных продуктов азотистого обмена, нормализация функции печени, почек, легких). Курс озонотерапии при гнойно-септических осложнениях включает в себя 5 процедур, В первый день применяют высокие концентрации 4—5 мг/л озона в 400 мл 0,9% р-ра NaCl внутривенно один раз в сутки. Во время 2-й и 3-й процедур концентрация озона составляет 3 мг/л в 400 мл 0,9% раствора NaCl внутривенно один раз в сутки. Во время 4—5-й процедур концентрация озона равна 2 мг/л в 400 мл 0,9% р-ра NaCl внутривенно один раз в сутки. Высокоэффективным методом терапии гнойно-септических осложнений в послеоперационном периоде является эндоваскулярное лазерное облучение крови (ЭЛОК). Лазерное воздействие на кровь обусловливает аналгезирующий, иммунокорригирующий, антибактериальный, противоотечный и противовоспалительный эффекты. В связи с этим воздействие лазера эффективно используется для профилактики и лечения гнойно-септических осложнений. На основании многочисленных клинических данных установлено, что под действием лазерного излучения на кровь в организме происходят изменения, которые реализуются в первую очередь на субклеточном, затем клеточном, тканевом, системном и органном уровнях. Основное действие лазерного излучения на кровь заключается в изменении активности окислительно-восстановительных процессов на субклеточном уровне. Гнойно-септические заболевания сопровождаются деструктивными процессами в очаге и развитием синдрома эндогенной интоксикации в организме. Уменьшение продуктов деструкции тканей после лазеротерапии свидетельствуют об уменьшении воспалительного процесса, вследствие чего снижается уровень эндогенной интоксикации в организме. Важным эффектом ЭЛОК является улучшение микроциркуляции, в результате чего усиливается доставка субстратов кислорода к очагу воспаления, происходит нормализация КОС и газов крови. Применение лазеротерапии оказывает положительное влияние на свертывающую систему крови (снижение уровня фибриногена, ИТП), что значительно уменьшает риск возникновения тромбоэмболических осложнений. ЭЛОК выполняется при помощи установки УЛФ-01 и АДЕПТ. Для внутрисосудистого облучения крови используют моноволоконный кварцевый световод, вводимый через пункционную иглу в локтевую вену. Длительность процедуры составляет 15—30 мин. Лечение проводится раз в сутки, курс составляет 7—10 сеансов. При отсутствии венозного доступа проводят неинвазивное лазерное облучение путем воздействия на бедренный сосудистый пучок в области паха. Мощность излучения 35—140 мВт, продолжительность процедуры 15—30 мин. Лечение проводится раз в сутки в течение 7—10 сеансов. Основными положительными эффектами использования данных методов при послеоперационных осложнениях является подавление адгезивного процесса, выраженный фибринолитический и некролитический эффекты, снижение частоты возникновения полиорганной недостаточности, улучшение результатов лечения больных с послеоперационными осложнениями. Частым и опасным осложнением абдоминального родоразрешения являются кровотечения, частота их в 3—5 раз выше, чем после самопроизвольных родов. Кровотечения после кесарева сечения развиваются как в раннем, так и в позднем послеоперационном периоде. Лечение кровотечений должно быть ранним, комплексным и включать общие принципы интенсивной терапии такие как: катетеризация одной или двух магистральных вен, почасовой контроль ЦВД, диуреза; определение концентрационных показателей крови (гемоглобин, гематокрит, количество эритроцитов). При кровотечении в раннем послеоперационном периоде следует использовать шанс остановки кровотечения консервативными средствами, которые включают: — своевременное опорожнение мочевого пузыря, — наружный массаж матки, — внутривенное введение утеротонических средств (окситоцин, метилэргометрин, простагландин), — пальцевое или инструментальное опорожнение матки (при развернутой операционной и под внутривенным обезболиванием калипсолом), — введение утеротонических средств в шейку матки, — инфузионно-трансфузионная терапия (свежезамороженная плазма, эритроцитная масса, трансаминовая кислота и др.). Эффективность указанной терапии, по нашим данным, составляет 82,4% При отсутствии эффекта и при выраженном ДВС-синдроме иногда прибегают к перевязке внутренних подвздошных артерий. Нормализацию гемодинамики следует начинать с инфузионно-трансфузионной терапии. Основой лечения является восстановление системной гемодинамики путем введения растворов с высокой молекулярной массой. Средствами выбора в данном случае являются препараты оксиэтилированного крахмала (6 и 10% HAES Steril, Infukol HAS) из расчета 10—20 мг/кг/час, волекама от 500 до 1000 мл. Гемодинамический эффект данных препаратов в 2—3 раза превышает эффект раствора альбумина при длительности гемодилюционного эффекта 4—6 ч. Учитывая развитие гипогликемии при массивной кровопотере, целесообразно включение в инфузионно-трансфузионную терапию растворов концентрированных углеводов (10 и 20%). Введение растворов глюкозы способствует не только восстановлению энергетических ресурсов, но и потенцирует гемодинамический эффект оксиэтилированного крахмала. Для коррекции гемокоагуляционного потенциала и восстановления онкотического равновесия необходима трансфузия свежезамороженной плазмы в дозе 15 мл/кг веса. Восстановление глобулярного объема путем переливания эритромассы (не более 3 сут хранения) или введение эритропоэтина по 400—500 мл осуществляется только при наличии уровня гемоглобина ниже 80 г/л, величины гематокрита менее 25 л/л. В послеоперационном периоде нередко встает вопрос о терапии анемии. Лечение препаратами железа, как правило, длительное и имеет побочные эффекты (чаще со стороны желудочно-кишечного тракта) и в ряде случаев безуспешно. Гемотрансфузию производят в редких случаях и только по витальным показаниям. В настоящее время лечение анемии человеческим рекомбинантным эритропоэтином следует рассматривать как альтернативу традиционной терапии. Эритропоэтин — это гликопротеиновый гормон, регулирующий эритропоэз, который повышает продукцию эритроцитов. В связи с этим в послеоперационном периоде при анемии необходимо использовать эритропоэтин в дозе 60 ЕД/кг массы 1 раз в день внутривенно в течение 5 дней. Данная терапия должна проводиться на фоне глюкокортикоидной терапии и введения ингибиторов протеолиза, рассматривающихся в качестве протекторов шока и нормализующих процессы гемокоагуляции. Нормализация микроциркуляции осуществляется введением дезагрегантов (трентал, реополиглюкин). Гемотрансфузия и введение плазмы должно проводиться с обязательным использованием фильтров. За последние годы значительно расширилось применение фильтров при переливании крови и ее компонентов. Известно, что в течение нескольких часов хранения крови происходит агрегация тромбоцитов. Лейкоциты начинают терять свою активность и постепенно связываются со склеивающимися тромбоцитами. В последующем осевшие нити фибрина скрепляют образовавшейся конгломерат и завершают процесс формирования стабильного микроагрегата. Попадание микроагрегатов в кровеносное русло чревато развитием ряда осложнений. Прежде всего при инфузии крови возможна окклюзия прекапиллярных артериол легких. Кроме того, компоненты, входящие в состав микроагрегатов, могут инициировать высвобождение биохимически активных веществ, которые в свою очередь способствуют развитию респираторного дистресс-синдрома (РДС). Факторами, предрасполагающими к развитию РДС у акушерских больных, могут быть: 1. Длительное хирургическое вмешательство (кесарево сечение + миомэктомия, сопутствующие опухоли брюшной полости). 2. Исходная анемия, требующая переливания крови. 3. ДВС-синдром. 4. Аспирация желудочного содержимого. 5. Бактериемия (хориоамнионит, плацентит и др.). 6. Воспалительные заболевания легких, гениталий. 7. Экстрагенитальная патология (пиелонефрит, заболевание печени и др.) Сочетание двух или более предрасполагающих факторов резко повышает вероятность развития респираторного дистресс-синдрома и ухудшает прогноз для больной при проведении гемотрансфузии. Одной из возможностей, позволяющей избежать осложнений при переливании крови и ее компонентов, является использование микроагрегатных фильтров фирмы «Pall Biomedical». Известно, что после трансфузии 3—4 единиц крови с использованием стандартного фильтра (диаметр пор 170 мкм, задерживает только достаточно крупные сгустки) развивается тромбоцитопения, которую нельзя объяснить только лишь проводимой гемодилюцией. Особенно важно это у женщин с исходной тромбоцитопенией. Еще один компонент плазмы крови, концентрация и активность которого снижается после гемотрансфузии — это фибронектин, который является гликопротеином, обладающим активностью опсонина и способствующим захвату бактерий, инородных тел ретикулоэндотелиальной системой. Это особенно важно у женщин с аутоиммунными нарушениями и иммунодефицитом. По мере увеличения срока хранения крови растет концентрация гистамина, который содержится в базофильных гранулоцитах, являющихся одним из компонентов микроагрегатов. У 1—2% больных, получавших трансфузионную терапию, возникают негемолитические фебрильные реакции, особенно часто возникающие у больных с В-талассемией. Клинически это выражается: повышением температуры тела, учащением пульса, ознобом. Использование указанных фильтров позволяет значительно снизить выраженность посттрансфузионной тромбоцитопении, снизить количество вводимого извне вместе с кровью гистамина и частоту развития НГФР на 77%. Потенциальной проблемой при гемотрансфузии является и возникновение аллоиммунизации к чужеродным HLA-антигенам, особенно у больных с заболеваниями крови. Эритроциты, тромбоциты и гранулоциты сами по себе не могут вызвать аллоиммунизацию, так как они являются мишенью HLA-антигенов класса II. Продукция HLA-антител требует наличия клеток, несущих на себе одновременно HLA-антигены класса I и HLA-антигены класса II. Все ядросодержащие клетки и тромбоциты имеют HLA-антигены класса I, антигены класса II имеются лишь на поверхности моноцитов, макрофагов, В-лимфоцитов и активированных Т-лимфоцитов, которые называются антиген-представляю-щими клетками (АПК) и ответственны за процессы аллоиммунизации (рис. 3). Использование фильтров, снижает частоту развития данных осложнений, а также передачу человеческого Т-клеточного лимфотропного вируса (HTLV-1), вируса Эпштейна—Барра, ВИЧ, гепатита и предотвращает развитие цитомегаловирусной инфекции.
Рис. 3. Механизм HLA аллоиммунизации и последующие клинические проявления гемотрансфузии.
При неэффективности указанной терапии, развитии у больной полиорганной недостаточности необходимо использовать эфферентные методы. Плазмаферез проводят в первые часы после достижения хирургического гемостаза. При этом эксфузируется не менее 70% ОЦП с адекватным возмещением донорской свежезамороженной плазмой. Данная методика при своевременной ее реализации позволяет полностью исключить развитие синдрома полиорганной недостаточности. Правильное и своевременное проведение инфузионно-трансфузионной терапии в сочетании с эфферентными методами позволяет значительно улучшить результаты терапии и предотвратить смертность при данном осложнении. Тромбоэмболические осложнения — одна из трех главных причин материнской смертности, относятся к самым опасным из акушерских осложнений. Риск их развития после кесарева сечения в 10—15 раз выше, чем после родоразрешения через естественные родовые пути, и достигает 8,5%. Материнская смертность при этом составляет 1 —1,6 на 10 000 родов. У здоровых женщин гемостатический процесс является нормальной реакцией организма на беременность, роды и оперативное вмешательство. Риск развития послеоперационных тромбоэмболических осложнений резко возрастает у беременных с экстрагенитальной патологией, осложнениями беременности и отягощенным акушерским анамнезом (сердечно-сосудистые заболевания, анемии, заболевания почек, сахарный диабет, поздние гестозы, аборты, миома матки, варикозное расширение вен, антифосфолипидный синдром и т. д.). Существует ряд причин, способных привести к тромбообразованию. Это повреждение сосудистой стенки, гемодинамические нарушения, нарушения функции дыхания, системы гемостаза. К сосудистым факторам, имеющим непосредственное отношение к тромбообразованию, следует отнести простациклины, эндотелиальный фактор расслабления, эндотелии, активатор плазминогена тканевого типа, продукт липидного обмена — 13-гидроксиоктадекадиеновая кислота, гепарин и др. Таким образом, сосудистая стенка играет важную роль в обеспечении гемостатических реакций. В здоровом организме женщины независимо от способа родоразрешения, вызвавшего нарушения целостности или функциональной активности стенки сосудов, происходит инициация процессов, направленных на предупреждение и уменьшение выраженности геморрагических нарушений и на ограничение процессов тромбообразования. Осложнения беременности, родов, экстрагенитальная патология, кровотечения, послеродовые осложнения приводят к дисбалансу протромбогенных и антитромбогенных сосудистых факторов, тем самым способствуя усилению коагуляционных свойств крови. Фактором, способствующим повышению свертываемости крови, является попадание околоплодных вод во время операции в брюшную полость. Они легко всасываются и способствуют гиперкоагуляции крови. Гемодинамические нарушения, нарушения функции дыхания, системы гемостаза также могут спровоцировать тромбообразование, влияя не только на функциональную активность эндотелиальных клеток и тромбоцитов, но и повышая реакции плазменного звена гемостаза и адгезию тромбоцитов. Причиной возникновения тромбоэмболических осложнений могут быть изменение содержания фибриногена, протеина С, фактора V, появление в крови антител к фосфолипидным комплексам, дефицит фактора XII и др. Для профилактики тромбоэмболических осложнений у беременных, рожениц и родильниц необходимо учитывать наличие следующих факторов риска, способствующих данному виду осложнений. К ним относятся: 1. Аутоиммунные и инфекционно-иммунные заболевания (АФС, аллергическая болезнь, тромбоваскулиты, гнойно-воспалительные заболевания и др.); 2. Заболевания крови (гемореологические формы — полицитемии, парапротеинемии, тромбоцитемии, гипертромбоцитоз, нарушение сосудистого тромбоцитарного звена и др.); 3. Экстрагенитальная патология (диабет, поражения сердца, гипертоническая болезнь, заболевания почек, печени, наследственная гиперлипидемия и др.); 4. Тяжелые формы гестозов, привычное невынашивание беременности и др. Спонтанное тромбообразование в послеоперационном периоде возможно при массивной кровопотере, возникновении полиорганной недостаточности, гнойно-септических осложнениях. Причем необходимо знать, что при беременности развитие тромбозов возможно в любом триместре, особенно у женщин с наличием феморального тромбоза, длительно принимавших оральные контрацептивы, наличии АФС-синдрома и др. Существенную роль в развитии венозных и артериальных тромбозов играет нарушение реологических свойств крови, а именно повышение ее вязкости, полиглобулии, полицитемии — при высоком уровне гематокрита, гемоглобина, эритроцитов, тромбоцитов, ускорении СОЭ, увеличении содержание фибриногена. К развитию тромбообразования могут привести и недостаточность основных физиологических ингибиторов коагуляции или их кофакторов (антитромбина III, гепаринового фактора II, протеина С, S, ингибитора комплекса фактора VIla). Снижение их уровня может наблюдаться у женщин с заболеванием печени, сепсисе, диабете, при длительной гепаринотерапии и др. Довольно часто тромбообразование обусловлено воспалительными осложнениями, возникающими в послеродовом периоде. Основными причинами при этом являются наличие в крови эндотоксина и высвобождение из клеток цитокинов. Сравнительно часто причиной гематогенных тромбофилий является дефицит и аномалии протеина С, недостаточность антитромбина III, который блокирует активность тромбина, факторов IХа, Ха, XI. В присутствии гепарина эффект антитромбина резко возрастает. Недостаточность данных факторов может быть первичной или вторичной. Наследственная форма представляет собой аутосомно-доминантно наследуемое заболевание. При этом тормозится синтез естественных антикоагулянтов. Появление в крови антител к фосфолипидным комплексам (волчаночный антикоагулянт) также может вести к данному осложнению. При этом тромбофилий происходят на фоне ДВС-синдрома при длительном приеме гепарина, при приеме синтетических прогестинов. Угнетение фибринолиза может развиться под влиянием появления в крови мощных ингибиторов активаторов плазминогена и плазмина, что нередко возникает при гестозах. Дефицит плазминогена также может явиться причиной тромбоза при системных васкулитах, ДВС — синдроме, а также при введении больших доз активаторов плазминогена и препаратов дефибринирующего действия. При появлении в крови иммунных комплексов, активированных компонентов системы комплемента, возможно повышение адгезивно-агрегационной активности тромбоцитов, появление в плазме активной формы гликопротеина, что нередко возникает при гломерулонефрите, острых инфекциях, сепсисе, шоке и др. Таким образом, для профилактики гематогенных тромбофилий необходимо учитывать факторы риска. Наиболее грозным тромбоэмболическим осложнением является тромбоэмболия легочной артерии. При подозрении на тромбоэмболию легочной артерии необходимо ввести внутривенно от 10 000 до 50 000 ЕД гепарина. После установления диагноза проводят тромбоэмболическую терапию в течение 2—3 сут (стрептаза, стрептокиназа в дозе 2 000 000— 3 500 000 ЕД). Гепарин в первые два дня вводят в дозе 30 000—50 000 ЕД с реополиглюкином внутривенно капельно, в дальнейшем подкожно под контролем показателей гемостазиограммы. Гепарин достаточно сложно использовать для лечения и профилактики тромбоза в течение длительного времени в связи возможностью возникновения геморрагических осложнений. Поэтому, когда нужна длительная противотромботическая терапия, необходимо использовать антикоагулянты непрямого действия (дикумарин, маркумар, фенилин и др.), которые не препятствуют образованию сгустка при непосредственном контакте с кровью или плазмой и действие их обусловлено снижением в плазме уровня — витамин К-зависимых факторов — II, VII, IX, X. Эффективность терапии контролируют путем определения концентрации фибриногена, тромбинового времени, ангиопульмонографии, рентгенографии легких. Профилактика тромбоэмболических осложнений после кесарева сечения включает в себя своевременное выявление и лечение экстрагенитальных заболеваний и осложнений беременности, протекающих с хронической формой ДВС-синдрома, нарушениями микроциркуляции. Некоторые авторы у данной категории больных рекомендуют введение во время операции, после зашивания раны на матке, одномоментно внутривенно тест-дозы гепарина — (5—10 ЕД). Контроль за действием гепарина осуществляют по времени свертывания крови с расчетом гепаринового коэффициента. По данным E.Clement (1990), такая профилактика позволяет снизить частоту послеоперационных тромбоэмболических осложнений с 1,1 до 0,34 %. В данном исследовании гепарин вводили не только женщинам группы высокого риска развития этих осложнений, но и всем беременным и роженицам во время кесарева сечения. При неэффективности терапии рекомендуется проведение экстракорпоральных методов лечения (плазмаферез, гемофильтрация) и эндоваскулярное лазерное облучение крови, обладающих реокорригирующим действием. Эмболия околоплодными водами, или амниотическая эмболия — одно из самых опасных акушерских осложнений, которое к тому же встречается чаше, чем диагностируется. Летальность при данной патологии составляет 86%. Если учесть, что в части случаев амниотическая эмболия с летальным исходом, несомненно, проходит под другими диагнозами, то опасность этой патологии станет еще более очевидной. Амниотическая эмболия наблюдается в виде двух главных синдромов — кардиопульмонального шока и коагулопатического кровотечения. Первый синдром встречается в 60—70% случаев амниотической эмболии, причем если больная остается живой, то почти всегда присоединяется и второй синдром. Доказано, что околоплодные воды никогда не попадают в кровоток естественным путем. Для того чтобы это случилось, необходимы, по крайней мере, два условия — преобладание амниотического давления над венозным и зияние венозных сосудов матки. Лмниотическое давление становится выше венозного чаще всего на фоне гиповолемии любого генеза. Следовательно, операция кесарева сечения, обеспечивающая второе условие (зияние венозных сосудов матки), у женщин с патологией беременности и сопутствующей гиповолемией чревата опасностью амниотической эмболии. При развитии кардиопульмонального шока интенсивная терапия чаще всего, по сути, является реанимацией. Меры реанимации можно разделить на три группы: 1) поддержание дыхания, кровообращения и метаболизма искусственным путем; 2) прерывание рефлекторных реакций танатогенеза; 3) ликвидация последствий кардиопульмонального шока. Своевременное начало реанимационных мероприятий — залог успешного исхода, так как при молниеносной форме амниотической эмболии больные, как правило, погибают быстро, а чем короче период умирания, тем больше надежд на успешную реанимацию и реабилитацию. Что касается рефлекторных механизмов танатогенеза, то, возможно, их ликвидируют клиническая смерть и реанимация. Ведь сердце останавливается из-за того, что агрессивные вещества, задержанные легочным капиллярным фильтром, запустили сложную цепь реакций. В ходе механического массажа сердца и ИВЛ эта высокая концентрация амниотической жидкости будет разведена кровью и более или менее равномерно распределится по всему организму. Поскольку инициатором танатогенетических реакций является ПГ F2a, можно использовать антипростагландиновые средства (ацетилсалициловая кислота, индометацин и др.). Кроме того, сразу же вводят внутривенно нейролептики, анальгетики и гепарин. Нейролептанальгетики прерывают рефлекторные реакции, стабилизируют вегетативные функции, устраняют страх, боль, катехоламинемию, т. е. поводы к фибрилляции желудочков сердца. Гепарин применяют не только как антикоагулянт, прерывающий ДВС, но и как антагонист серотонина. Для снятия бронхиолоспазма и улучшения микроциркуляции крови внутривенно вводят алупент, эуфиллин, проводят загрудинную блокаду 0,25% раствором новокаина (50—100 мл). Острая гиповолемия устраняется инфузией реополиглюкина, который одновременно препятствует развитию ДВС-синдрома — постоянного компонента амниотической эмболии в любом ее варианте. Ликвидация последствий кардиопульмонального шока состоит в устранении метаболического ацидоза, стимуляции диуреза для профилактики острой почечной недостаточности, применении режима с сохранением повышенного давления к концу выдоха, как при искусственной, так и при спонтанной вентиляции легких, чтобы противостоять их наклонности к ателектазированию, связанной с амниотической эмболией. Для лечения данной патологии в настоящее время с успехом могут быть использованы методы эфферентной хирургии крови (плазмаферез, плазмафильтрация). Их применение патогенетически обосновано, так как эффект обусловлен такими механизмами, как удаление из кровеносного русла токсических веществ, аутоантител, иммунных комплексов, продуктов метаболизма, компонентов разрушенных тканей и клеток, быстрым устранением гиповолемии, улучшением микроциркуляции. Особого внимания заслуживает ведение пациенток с гестозами, особенно с их тяжелыми формами (эклампсия, HELLP-синдром), которые чаше всего являются причиной возникновения таких послеоперационных осложнений как кровотечения, тромбоэмболия. К одним из проявлений тяжелых форм гестоза относится — HELLP-синдром (гемолиз, увеличение активности печеночных ферментов и тромбоцитопения). Ранними клиническими симптомами HELLP-синдрома могут быть тошнота, рвота, отеки в верхних отделах живота. Отмечается тромбоцитопения меньше 100•109/л. Присоединение HELLP-синдрома указывает на крайнюю степень дезадаптации систем организма матери. В тяжелых случаях это приводит к развитию внутрисосудистого свертывания и тяжелым акушерским кровотечениям. Для лечения HELLP-синдрома можно рекомендовать в послеоперационном периоде проведение плазмафереза с заменным переливанием свежезамороженной плазмы, введение больших доз преднизолона, эритроцитарной и тромбоцитарной массы. Эклампсия — наиболее тяжелая форма позднего гестоза. Особенно опасна эклампсическая кома, когда у женщины даже вне судорожного припадка нарушено сознание. При данной патологии конец операции не означает окончание анестезиологического пособия. При эклампсической коме или эклампсическом статусе в послеоперационном периоде проводится длительная искусственная вентиляция легких вплоть до стабилизации основных параметров гомеостаза. Показаниями к ИВЛ являются: отсутствие или нарушение сознания вне припадков, артериальная гипертония, не устраняемая общепринятой гипотензивной терапией, судорожная готовность, не устраняемая общепринятой противосудорожной терапией. Как правило, ИВЛ приходится проводить в режиме выраженной гипервентиляции (при РаСО2 20—22 мм рт. ст.). Только так удается достигнуть адаптации больных к респиратору. Нередко трудной задачей является устранение тяжелой гипоксемии, поэтому целесообразно использовать повышение давления к концу выдоха (10—12 см вод. ст.). На фоне ИВЛ проводят массивную седативную, противосудорожную и гипотензивную терапию (седуксен, нейролептанальгетики). В случае стойкой артериальной гипертонии прибегают к использованию ганглиоблокаторов (пентамин по 0,5—1,5 мл 5% раствора внутривенно). У отдельных больных даже ганглиоблокаторы могут не оказывать гипотензивного действия и только многокомпонентная, комплексная терапия дает эффект. Однако необходимо отметить, что «интенсивная» терапия при данной патологии — это не значит много и в большом количестве. Прежде всего это интенсивное мышление врача, который соответственно состоянию больной назначает разумно минимальный объем лечения с минимальным количеством побочных влияний и последствий. Наряду с описанной терапией высокоэффективным является применение плазмафереза наряду с инфузией белковых препаратов, солевых растворов, препаратов реологического действия. Необходима тщательная коррекция всех метаболических нарушений при ежедневном биохимическом анализе крови и мочи. Большое значение, особенно при возникновении легочных осложнений, имеет устранение гиперкоагуляции путем введения гепарина. Для уменьшения проницаемости сосудистой стенки, профилактики и лечения отека мозга рекомендуется применять гидрокортизон (500—800 мг в сутки) или преднизолон (90—60 мг в сутки). Осторожно следует относиться к так называемой дегидратационной терапии (салуретики, осмотические агенты). Они малоэффективны, углубляют нарушения водно-электролитного баланса, часто провоцируют усиление судорожного синдрома, особенно, если их вводят на фоне повышенного осмотического давления плазмы. Прекращать ИВЛ у больных эклампсией можно только при отсутствии судорожных припадков и судорожной готовности без применения противосудорожной и седативной терапии в течение 3 сут. Вторым обязательным условием является отсутствие легочных осложнений. Переводить больных на самостоятельное дыхание следует постепенно, под контролем клинических, лабораторных исследований по всем правилам реанимационной техники. Очень важны послеоперационная физиотерапия и лечебная физкультура. Перед операцией желательно беременную обучить ряду упражнений. После операции проводятся следующие упражнения: 1. Дыхательные упражнения: больная делает глубокий вдох через нос и выдох через рот. Это упражнение выполняется 5 раз в течение каждого часа под наблюдением методиста. Главная цель дыхательных упражнений — восстановление диафрагмального дыхания, которое бывает временно нарушено после абдоминальных операций. 2. Помощь больной при кашле: медсестра мягко нажимает руками на живот по обе стороны раны. После этого больная может откашляться без неприятных ощущений. 3. Активные движения. Выполняются для улучшения периферического кровообращения в целях предупреждения развития тромбофлебита. Больная проделывает следующие упражнения: каждый час она 5 раз сгибает и выпрямляет ноги в коленях и 5 раз сгибает и разгибает стопы, свободно и при создании препятствия. В случае послеоперационного кровотечения дыхательную гимнастику и активные движения выполняют с большой осторожностью. Нужны особые меры предосторожности, если у больной имеется кашель. 4. Поворот на бок в целях предупреждения тромбофлебита и пролежней, а также для улучшения кровообращения. Методист одной рукой поддерживает больную за плечи, другой за спину и помогает ей переворачиваться на бок, пока больная не почувствует себя удобно в новом положении в постели. 5. Помощь больной при подъеме с постели: больная переворачивается на бок и приподнимается, опираясь на правый локоть и левую руку, если она перевернулась на правый бок, и на левый локоть и правую руку, если она перевернулась на левый бок. После этого методист или медсестра отделения кладет руки под голову и плечи больной и помогает ей медленно сесть на постели и опустить ноги вниз. Больная сидит некоторое время на краю кровати, опустив ноги вниз, затем встает и делает несколько шагов, методист осторожно помогает ей. Диета с 1-го дня после кесарева сечения включает бульон, кисель, манную кашу, со 2-го дня назначают стол № 10, с 3—4-го дня — общий стол. Пища должна быть калорийной, качественной и разнообразной с достаточным количеством белка и растительной клетчатки. Для оценки течения послеоперационного периода, кроме клинического наблюдения, используются исследования по общепринятым методикам (клинический анализ крови и мочи, биохимический анализ крови, гемастазиограмма). Ультразвуковое сканирование матки с оценкой ее инволюции и эхоспецифических изменений в области швов производят на 5—6-й день. По данным УЗИ, расширение полости матки до 1—1,5 см является нормой. Неблагоприятным признаком является наличие газа в полости матки и в области послеоперационного шва. При обнаружении каких-либо патологических изменений (наложение фибрина, расширение полости матки и др.) необходимо использование утеро
|
||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 458; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.140.195.8 (0.02 с.) |