
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Лабораторная работа 12. Анализ анионовСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Если анализы на присутствие анионов подвергают твердое вещество, то прежде всего пытаемся анионы перевести в раствор как ВВ или СВ (см начало раздела «Анионы»). Напомним, что некоторые мало растворимые соли - сульфиды, сульфаты, фосфаты, силикаты, а также галогениды аргентума плохо меняют свой анион на CO32- (из-за слишком малой константу равновесия реакции превращения осадков). Если по систематическому анализу соответствующих анионов в содовой вытяжке не обнаружит, то их следует искать в остатке от содовой вытяжки. Анализ начинаем с предварительных испытаний по методикам раздела 11.1. Протокол этих проб записываем в лабораторном журнале и выводы из него используем в дальнейшем анализе. Эти пробы логично вместить в общую отчетную карту анализа анионов. Дерево, отражающий дальнейший анализ, мы отражать не будем - слишком много анионов из всех аналитических групп оно должно охватить. Следуя методические разработки профессора Л. П. Адамовича, представим отчетную карточку для случая наличия всех анионов, которые изучались в учебном процессе (табл. 14). В ней предварительные испытания не внесены. Подробности операций представлены в описании лабораторной работы 11 и в комментариях, приведены после таблицы. Номера комментариев соответствуют номерам операций в отчетной карте. Комментарии к отчетной карточки (табл. 14) 1. Выявление СО32-. Если объектом является твердое вещество, то используют или непосредственно ее, или водяную вытяжку. Пробу осуществляем в специальном устройстве (опыт 11.2), добавив окислитель, чтобы устранить помехи от газа SО2. 2. Осаждение 1- й группы. Используем содовую или водяную вытяжку (последнюю, если нужно, подщелачивают раствором амо-ниаку к слабому запаха). Выпадает белый осадок солей анионов 1-й группы по катионом Са2+. Если концентрация SO42- высока, то может выпасть и СаSO4. Осадок промываем дважды водой с примесью СаАс2. Если осадок окрашен в желтый цвет из-за адсорбции иона CrO42-, то его промываем пока промывные воды не перестанут давать осадок с ионами Pb2+. Первую промывную воду добавляем к 2, остальную отбрасываем. 3. Разделение 1-й группы на подгруппы является нечетким. Окислители и восстановители со 2-й подгруппы могут взаимодействовать, когда осадок растворяют. Так, IO3 окисляет превосходящие в кислой среде SO2 или As(OH)3. Мы не можем предотвратить все эти осложнения. Если осложнений нет, то, обрабатывая кислотой осадок, содержащий СаSO3, можем почувствовать запах SO2, чем мешает собственный запах нас. Через летучесть SO2 проявлять SO32- с F3 следует сразу. 4-5. Выявление SO32- (вторая подгруппа 1-й группы). Добавляя BaCl2 к подкисленного минеральной кислотой F3, осаждают ВаSO4, если ион SO42- попал сюда из-за частичной растворимость СаSO4, или образовался из окисления других анионов, содержащих серы. Этот осадок отвергаем, а в раствор добавляем Н2О2, что окисляет SO32- к SO42-. Нагреваем, разрушая избыток Н2О2. Образованная теперь муть может содержать ВаSO4, тогда имеющийся SO32-. 6. Выявление Аs(ОН)4. В среде с с (НСl) = 3 моль/л только Аs(ОН)4, что может содержаться в F3, способен давать желтый осадок с Н2S, что образуется в кислой среде с прилагаемого Na2S. К сожалению, если в F3 обнаружено SО32-, то в кислой среде образуется белая муть серы (опыт 11.14.4), что усложняет и без того нечеткий анализ 2-й подгруппы. 7. Выявление РО43-. 5 капель F3+10 капель молибденовой жидкости нагреваем до» 40°С и потрем стенки пробирки стеклянной палочкой. Желтый кристаллический осадок свидетельствует о наличии РО43-. Аналогичный осадок с АsО43- не образуется, так как мышьяк маскируем в устойчивый комплекс с ионами тартрата. Ионы SО32- или S2О32- восстанавливают осадок к «молибденовой сини».
Таблица 14 Ход анализа анионов (Р0 - выходное сухое вещество, F0 - ВВ или СВ)
Таблица 14(продолженние)
Таблица 14(продолженние)
Таблица 14(продолженние)
Таблица 14(продолженние)
8-11. Выявление АsО43-. 5 капель F3+10 капель концентрированной HNO3 + 10 капель молибденовой жидкости нагрейте до»40°С и потрем стенки пробирки стеклянной палочкой. Если РО43- не обнаружено, то желтый кристаллический осадок свидетельствует о наличии АsО43-. Если же РО43- обнаружено, то F8 переводят в MgNH4PO4(s) и в MgNH4AsO4(s). Только As(V), помещенного в осадке, способен в операции 11 окислять І-. Реакции не дает Р(V). 12. 1-й подгруппы 1-й группы. Действие раствора с с (НСl) =3 моль/л на Р3 переводим СаSіО3 полностью или частично в H2SіО3. Эти вещества остаются в осадке, а SiF62- полностью поступает в раствор. H2SіО3 здесь выпадает как осадок, подобный студня. 13. Выявление SiF62-. До F3 добавляем избыток NaAc, создавая умеренно кислая среда (рН»5) и снова выпадает легкая муть СаSiF6. 14-15. Выявление ІО3. Для реакции берем сухой реагент Na2SO3 в очень небольшом количестве, так как его избыток может вызвать восстановление IO3 не только к I2, но и к I- (опыт 11.21.2), и слой CCl4 останется бесцветным. Если здесь проба на IО3- привела к отрицательного результата, то, принимая во внимание, что разделение IО3- на группы не является четким, его следует попытаться выявить в F12 и даже в F3. 16-20. Выявление SiО32-. Н2SiО3 склонна образовывать коллоидные растворы, поэтому ее дегидратують, дважды высушивая с с (НСl)=12 моль/л на водяной бане. Приобретенный SiO2 стоплюемо с КNaСO3 в петле из платиновой проволоки. Вилужившы водой стоп, наличие иона SiО32- в растворе обнаруживаем реакцией с молибдатом и бензидином (опыт 11.6.3). Если SiО32- не обнаружено, эту реакцию можно осуществить с F0. Поскольку она не является специфической (ее дают и другие гетерополикислоты - фосфорно-молибденовая, Арсен-молибденовая; бензидинова синь может образоваться под воздействием других окислителей, например, СrО42- т.п.) - то из исходного раствора сначала выделяем SiO2, прокипятив F0 с NН4Сl и 2-3 раза подсушив осадок с НСl. Промытый осадок стоплюемо с КNaСO3 и дальше поступаем так, как указано выше. 21. Осаждение 2-й группы. Если с ВаСl2 выпадает желтый осадок, то есть СrО42-, а если осадок чисто белый, то СrО42- отсутствует. Если нет ни одного осадка, то отсутствуют как СrО42-, так и SО42-, но В(ОН)4, не поддается четкому разделению на группы, следует все равно искать. Осадок 2-й группы дважды промывают водой. 22. Проявлять В(ОН)4 лучшее из части F0 (в которой не по-винно быть катионов Ba2+ и Cu2+). Бор обнаруживаем, как описано в опыте 11.2.2. 24. Выявление СrО42- (или Сr2О72-). Применяем реакции, изучены для анализа катионов (например, бензидиновая, реакция 4.3.3). 25. Выявление SО42-. Поскольку на этом этапе работы как-растворенный может остаться не только осадок ВаSО4, но и, например, SіО2, то осадок следует проверить на наличие в нем сульфат-ру - по реакции «серной печени», 11.9.3). 26-27. Осаждения 3-й группы и выявления S2-. Желтый осадок, выпадающий за операцией 26 является признаком иона S2-. Чтобы это проверить, осадок смочим каплей раствора CuSО4. Осадок CdS имеет сменить цвет на черный. Ион В(ОН)4 в этом осадке не обнаруживают. 28. Выявление S2О32-. Раствор иона І3- в этих условиях может обесцветить только ион S2О32. Образование неустойчивого фиолетового комплекса Fe(S2O3)2- наблюдаем, если отсутствует SCN-. 28a. Изъятие S2О32-. Обнаружив S2О32-, его разрушаем во всем объеме F26, нагревая последний из раствором Н2SО4, с (Н2SО4)=3 моль/л, пока не исчезнет запах SО2. Серу выпавшую отделяем. 29-31. Выявление SСN. Часть раствора, содержащего четвёртой и пятой группах анионов, но без S2О32-, обрабатываем избытком рас-на AgNO3. Промытый осадок стряхиваем с насыщенным раствором NaCl. Из-за смещения равновесия реакции AgSCN(s) + Cl‑ D AgCl(s) + SCN‑ в растворе устанавливается небольшая концентрация ионов SCN-, которую обнаруживаем за бледно-розовой окраской, когда добавляют каплю раствора FeCl3. 32-33. Разрушение SCN- и получения раствора галогенидив. Поскольку SCN- мешает выявлению ионов галогенидив, то его следует удалить, прокаливая осадок Р29, 2 AgSCN(s) + 4 О2 D 2 Ag(s) + 2 CО2 + 2 SО2 + N2. Галогениды аргентуму в этих условиях стоплюються, не меняясь химически. Если в дальнейшем стоплену остальные осадка подвергнуть действию Zn и H2SO4, то в раствор переходят ионы галогенидов, например, 2 AgI(s) + Zn(s) + 2 H+ D 2 Ag(s) + Zn2+ + I‑. 34-35. Выявление І- и Br-. І- и Br-, контактируя с Сl2, спо-чала образуют свободный I2, что, растворяясь в СCl4, окраску-ет слой последнего в фиолетовый цвет. Избыток Сl2 обесцветит раствор I2 + 5 Cl2 + 6 H2O D 2 IO3‑ + 10 Cl‑ + 12 H+,
а бром окисляется до элементного состояния 2 Br‑ + Cl2 D Br2 + 2 Cl‑, окрашивая слой СCl4 в желтый цвет. 36-38. Выявление Cl-. Из смеси AgCl(s) и AgI(s) раствор NН3 действует только на AgCl(s) с произведением растворимости, гораздо больше, чем для AgI(s). Итак, если AgBr(s) отсутствует, то Р36 обрабатывают раствором с с (NН3)=3 моль/л. Подкисляющее полученный раствор, муть наблюдаем лишь при наличии Cl-. Для смеси AgCl(s) и AgBr(s) раствор только NН3 как средство отделения никак пригоден, так как он заметно растворяет AgBr(s). Тогда принимаем реактив Фаургольта (Ag+ - буферный раствор с превосходящими компонентами Ag(NН3)2+ и NН3). Наличие в нем продукта растворения, иона Ag(NН3)2+, ослабляет растворимость как AgCl(s), так и AgBr(s). Последний почти не растворяется, позволяя вы-явить ион Cl- в присутствии Br-. 39. Отделение 4-й группы анионов от 5-й. К F26 добавляем AgАс, пока осаждения не будет полным. Осадок отбрасывают (в банку для сбора солей аргентума), так четвёртую группу уже проанализированно. В растворе обнаруживаем пятую группу анионов. 40. Выявление NО2-. Используем весьма чувствительную реакцию Ґрисса (опыт 11.7.1), где образуется розовый краситель - п-сульфобензоазонафтиламин. Можно также воспользоваться «ре-цию на кольцо», которая известна как реакция на ион NО3- (опыт 11.6.1). В отличие от только что упомянутой реакции, здесь вместо концентрир ной Н2SО4 следует использовать разведенную или НАс. Поскольку отдельных слоев жидкости здесь не образуется, результатом будет не кольцо, а бурая окраска всего раствора. 41. Отделение NО2-, что мешает выявлению NО3-, удобно осуществлять действием реактива Мартинченко-Красивицького (опыт 11.7.3. Слагаемое NаОН после реакции осаждает избыток реагента, а в растворе ищем NО3- и ClО3-. Если нитритон отсутствует, то к F39 добавляем (NН4)2SО4 и кипятим в течение 30 мин. При этом NО2- изымается за реакцией NH4+ + NO2‑ D N2(g) + 2 H2O. Однако в определенной степени происходит и преобразование NO2- в NO3-, 3 NO2‑ + H2O D NO3‑ + 2 NO + 2 OH‑, поэтому этот процесс нельзя считать вполне удовлетворительное. 42-45. Выявление NO3-. К F41 можно применить реакцию «бурого кольца» (опыт 11.6.1). Поскольку F41 по сравнению с F0 весьма разбавленным, а реакция не является достаточно чувствительной, то рекомен- дуем, випарившы его, предварительно сконцентрировать раз в 5-8 и осуществить еще одну реакцию обнаружения NO3- через восстановление в NН3 (опыт 11.6.2). Ион ClО3- при этом восстанавливается до Cl-, который можно обнаружить описанными выше реакциями (опыт 11.3.1). 46-49. Выявление Ас-. Операция 46 подобна окисления SO32- в операции 5. Иначе запах SO2(g) мешать выявлению продуктов Ас- за их запахом. Окислители опасны, потому что могут разрушать реагентов для реакций определения Ас- (особенно с С2Н5ОН в среде концентрированной Н2SO4 в операции 49). Зови-чайно, осаждая ионы, мешающие должны добавлять (к пов-ноты процесса) не ацетаты соответствующих катионов, а хлориды или (если хлориды отсутствуют в лаборатории) нитраты. Операции 48 и 49 осуществляем, как описано в опытах 11.4.1 и 11.4.2.
ВОПРОСЫ К КОЛЛОКВИУМА ПО ТЕМЕ «КАЧЕСТВЕННЫЙ АНАЛИЗ КАТИОНОВ И АНИОНОВ» Отвечая на вопрос, приводите, где необходимо, уравнения реакций и теоретические обоснования на их основе. Кислотно-основная схема систематического анализа катионов 1) Что такое групповой реактив? 2) Какие реагенты называют селективными, специфическими? 3) Что такое проба на полноту осаждения? Почему она нужна? 4) Какой реактив является групповым на первом аналитическую группу? Почему NaCl или NH4Cl? 5) Очередность выпадения осадков хлоридов 1-й аналитической группы катионов. 6) Выбор концентрации группового реагента. 7) Возможно практически полностью осадить катион Pb2 + действием HCl? 8) Как выполняют реакцию открытия Рb2+ действием KI? 9) Как удалить PbCl2(s) из осадка хлоридов катионов 1-й группы? 10) О чем свидетельствует полное растворение осадка хлоридов арґентуму, ртути (I) и свинца при извлечении из него PbCl2(s)? 11) На чем основывается растворения осадка AgCl(s) в растворе аммиака? 12) Что произойдет при действии раствора аммиака на осадок Hg2Cl2(s)? 13) Из осадка хлоридов 1 й группы изъяли хлорид свинца. Остаток полностью растворяется в растворе аммиака? Что наглядно в системе? 14) Как разрушают комплекс аргентума с аммиаком? Что при этом наблюдается? 15) Доказать расчетами, что разводя раствор AgCl(s) в концентрированной НCl, снова получаем осадок AgCl(s). 16) Какие осложнения в анализе вызывает большая концентрация ионов хлорида? 17) Какие осложнения вызывает ион Hg22+ в исследуемом растворе? 18) Возможно ли использовать ионы сульфида, чтобы выявить катион Pb2+? Или мешать образования Ag2S(s)? 19) Какая сопоставима растворимость сульфатов различных катионов 2-й группы? 20) Как снизить растворимость сульфата кальция? 21) Как переводят в раствор сульфаты катионов 2-й группы? 22) Как растворяют карбонаты катионов 2-й группы? 23) Каким реактивом проявляют Ва2+ при наличии Sr2+ и Ca2+? 24) Какие условия практически полного осаждения BaCrO4(s) действием К2Cr2O7? 25) Почему устраняют катион Ва2+ перед обнаружением Sr2+ и Са2+? 26) Почему при действии «гипсовой воды» на катион Sr2+ образуется не осадок, а только «муть» SrSO4? 27) Как выполняют микрокристаллоскопических реакцию на ион Са 2+? 28) Как устранить Pb2+ с осадка сульфатов катионов 2-й группы? 29) Почему следует устранить сульфат свинца осадка сульфатов 1-й и 2-й групп? 30) Для чего, осаждая сульфаты Ca2+, Sr2+ и Ba2+, добавляют этанол? 31) Реакции отделения и обнаружения катионов 1-й и 2-й групп. 32) Как проводить анализ, если «задача» содержит осадок? Которые могут возникнуть осложнения? 33) Какой из осадков выпадет первым, если смешать: а) раствор с с (I-)=0,1 моль/л и с (Cl-)=0,3 моль/л с раствором с (AgNO3)=1,0 моль/л; б) раствор с с (Ag+)=0,1 моль/л и с (Pb2+)=0,3 моль/л с раствором с (HCl)=1,0 моль / л; в) раствор с с (CrO42-)=0,3 моль/л и с (CO32)=0,1 моль/л с раствором с (Pb(NO3)2)=0,5 моль/л; г) раствор с с (Ag)=0,01 моль/л и с (Pb2+)=0,1 моль/л с раствором с (KI)=1,0 моль/л. 34) Какое свойство гидроксидов катионов 3-й группы позволила выделить их в отдельную аналитическую группу? 35) Для каких катионов 3-й группы характерны окислительно-восстановительные превращения? 36) Какие анионы образуются при окислении Cr3+ в щелочной среде? В кислой среде? 37) Как получают Al(OH)3(s) и Sn(OH)4(s) из раствора алюмината и станната? 38) Каким реактивом отделяют Zn2+ от других катионов 3-й группы? 39) Почему перед реакцией на хром с бензидином необходимо раствор, обработанный щелочью и перекисью водорода, нагревать, пока не прекратится выделение кислорода? 40) О чем свидетельствует отсутствие окраски раствора смеси катионов 3-й группы? 41) В среде проявляют ион цинка действием дитизона? 42) Почему, проявляя цинк действием (NH4)2[Hg(NCS)4], добавляют очень разбавленный раствор CoCl2? 43) С какой целью, проявляя Al3+ ализарином капельным методом, добавляют K4[Fe(CN)6]? 44) Какие свойства гидроксидов 4-й группы? 45) Почему, разделяя катионы 3-й и 4-й групп, кроме избытка щелочи, рекомендуют добавить пероксид водорода? 46) На чем базируется отделения Mg2+ от других катионов 4-й группы? 47) Какое свойство спoлук Sb (III) и Sb (V) является основой их обнаружения? 48) Какие катионы 4-й группы можно обнаружить, употребляя окислительно-восстановительные реакции? 49) Какие катионы 4-й группы можно обнаружить дробным методом? 50) При действии щелочей на смесь катионов 4-й группы выпал белый осадок. Какие катионы отсутствовали в растворе? 51) Какова роль Н2О2 при растворении MnO(OH)2(s) в разбавленных растворах? 52) Какова роль нитрата арґентуму при окислении Mn2+ пероксодисульфатом аммония (NН4)2S2O8? 53) Какой ион образуется при реакциях Mn2+ с сильными окислителями в кислой среде? Каково его окраску? 54) Как разделить смесь: Fe2+, Mn2+, Mg2+? 55) Действием какого реагента можно разделить основные соли Bi(III) и Sb(III)? 56) По какой свойством катионы 5-й группы выделяют в отдельную группу? 57) Почему амминокомплексы Со(III) образуется только при значительном избытке аммиака? 58) В какой цвет окрашены амониакаты катионов 5-й группы? 59) Что произойдет при подкислении амминокомплексы Cu(II)? Как при этом изменится окраска раствора? 60) Каким реактивом возможно осадить ионы меди как их сульфид? 61) Какие условия образования комплекса Со(NCS)42-? 62) Какой характер взаимодействия солей ртути (II) с иодид ка-лию? 63) Действием концентрированного раствора аммиака на смесь катионов 5-й группы получено бесцветный раствор. Какие катионы отсутствуют в смеси? 64) Какими реагентами можно разделить такие катионы: Zn2+ и Cu2+; Al3+ и Ni2+; Mg2+ и Cd2+; Mg2+ и Fe3+; Cu2+ и Cd2+? 65) Какие катионы могут быть в анализируемой смеси, растворяя ее в воде, образуется белый осадок? 66) Действуя на смесь катионов 3-5 групп избытка щелочи и перекиси водорода, образовавшегося черно-белый осадок. Какие катионы могли это вызвать? 67) Как растворить осадки Fe(OH)3, Мg(OH)2,Cd(OH)2, MnO(OH)2? 68) Чем отличается 4-a группа катионов кислотно-основного классификации от других групп? 69) Почему, проявляя К+ Гидротартрат натрия, необходимо нейтральную среду? 70) Возможно ли катион К+ осадить винной кислотой практически полностью? 71) Возможно ли выявить катион К+ при наличии катиона NH4+? 72) Возможно ли выявить катион Na + при наличии катиона NH4 +? 73) Какая из реакций обнаружения катиона NH4+ является специфической? 74) Почему, проявляя NH4+ через выделение NH3, следует нагреть раствор и смочить индикаторная бумага? 75) Какие реактивы используют, чтобы выявить К+? 76) Как обнаруживают Na+ действием UO2Ac2 микрокристаллоскопических методом? 77) Почему, анализируя смесь катионов 6-й группы, сначала обнаруживают катион NH4+? 78) Как устранить катион NH4 + с анализируемого раствора? 79) Как проверить, полностью устранены ион NH4+? 80) Схема анализа смеси катионов 1-2 аналитических групп. 81) Схема анализа смеси катионов 3-й аналитической группы. 82) Схема анализа смеси 4-5 аналитических групп. Другие схема систематического анализа катионов 83) Сероводородная схема систематического анализа катионов а) назовите групповые реагенты и состав групп; б) свойства объединяют катионы в группы? 84) Фосфатно-амониакова схема систематического анализа катионов а) назовите групповые реагенты и состав групп; б) свойства объединяют катионы в группы? 85) Какие преимущества и недостатки кислотно-основного, сероводородной и фосфатно-амониаковои схем систематического анализа? 86) Какие органично реагенты применяют в качественном анализе катионов? 87) По каким реакциями проявляют катионы дробным методом? Систематический качественный анализ анионов 88) Какие особенности анализа анионов по сравнению с анализом катионов? 89) Назовите групповые реагенты и состав групп систематического анализа анионов. 90) Что такое «водяной вытяжка» и «содовая вытяжка»? 91) Предварительные испытания на присутствие окислителей, восстановителей, летучих и неустойчивых соединений. Их необходимость и суть. 92) Схема анализа смеси анионов 1-й аналитической группы. 93) Схема анализа смеси анионов 2 и 3-й аналитических групп. 94) Схема анализа смеси анионов 4 и 5-й аналитических групп. 95) По каким реакциями обнаруживают анионы CO32-; PO43-; CrO42-; BO2-; Cl-; Br-; I; NO2-; NO3-. Обоснуйте их условия. 96) Какие анионы препятствуют выявлению PO43- по реакции с молибдата аммония дробным методом? 97) Какие анионы можно обнаружить реакцией «серное печенье»? Как ее применить, чтобы выявить ион SO42-. 98) Почему ион I- окисляется хлорной водой до IO3-, а Br- ион не окисляется до BrO3-? 99) Какой состав реактивов Фаургольта и Грисса? Продукты реакций?
МОДУЛЬ 1. Примеры решения задач 1.Запишите значения констант следующих равновесий: 1) H2AsO4- D HAsO42- + H+; 1) AgCNS ↓ + 2CNS- D Ag(CNS)32-; 2) SrCrO4 ↓ + H+ D HCrO4- + Sr2+. Решение: 1) H2AsO4 HAsO42- + H+. Это константа диссоциации мишяковои кислоты по второй ступенью. Из таблиц констант находим: AsO 4 3‑, арсенат‑ион H+ lg K H1 = 11,50, D H = ‑27,6; lg K H2 = 6,96, lg K H3 = 2,24. Учитываем связь между константами диссоциации и конс- тант протонирования: Ka2 = KH2-1 =10-6,96 ЗДМ: Ka2 = 2) AgCNS ↓ + 2CNS- D Ag (CNS)32- Равновесие состоит из двух процессов: 1) Равновесие растворения осадка с константой произведения растворимости 1. AgCNS↓ D Ag+ + CNS-, KS = 10-11,97 2) равновесие комплексообразования с общей константой b3 2. Ag+ + 3CNS- Û Ag(CNS)32-, b3 = K1·K2·K3 = 109,5 Суммарный процесс: AgCNS↓ + Ag+ + 2 3CNS-Û Û Ag+ + CNS-+ Ag(CNS)32-, KS · b3 = 10-2,47 (Константа суммарного процесса равна произведению KS · b3 = 10-11,97 · 109,5 = 10-2,47) ЗДМ: 3) SrCrO4↓ + H+ D HCrO4- + Sr2+. Это уравнение состоит из: равновесия растворения осадка с константой произведения рас-силу SrCrO4↓ D Sr2+ + CrO42-, KS =10-4,65 и равновесия протонирования: по первой ступенью CrO42- + H+ D HCrO4-, KН1 = βH1 = 103,17 SrCrO4↓ + H+ D HCrO4- + Sr2+, KS · KН1 = 10-4,65 · 103,17 = =10-1,48 =
2. Какой из осадков выпадет первым, если осаждать смесь Катио-нов одинаковых концентраций, с=0,1 моль/л, (Ag+; Hg22+; Pb2+) IO3-? Решение: Запишем уравнение закона действующих масс AgІО3↓ D Ag+ + ІО3-, KS = [Ag+ ] + [ІО3-] = 10-7,51; Hg2(IO3)2↓ D Hg22+ + 2 ІО3-, KS = [Hg22+]·[ІО3-]2 = 10-17,89; Pb(IO3)2↓ D Pb2+ + 2 ІО3-, KS = [Pb2+]·[ІО3-]2 = 10-12,61; [IO3-]Ag+ = KS /[Ag+] = 10-7,51/10-1 = 10-6,51; [IO3-]Hg2+ = (KS / [Hg2+])1/2 = (10-17,89/10-1)1/2 = 10-8,44; [IO3-]Pb2+ = (KS /[Pb2+])1/2 = (10-12,61/10-1)1/2 = 10-5,65. Ответ: первым будет выпадать Hg2(IO3)2↓, вторым - AgIO3↓, третьим - Pb(IO3)2↓. 3. Вычислить рН насыщенного раствора СО2, если его раствор ность при 200С составляет 2,2 г/л. Дано: S = 2,2 г / л _____________________ рН -? Решение: Для расчета молярной концентрации используем уравнения: H2CO3 D СО2+ H2O H2CO3 D H+ + HCO3-, KН2 = 10-6,35; C 0.05 - - DC -x +x +x [ ] 0.05-X X x ЗДМ: x» рН = -lg 10-3,83 = 3,83. Ответ: рН = 3,83.
Задачи для самостоятельного решения
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 507; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.14.26.141 (0.012 с.) |

 .
.
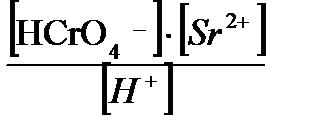
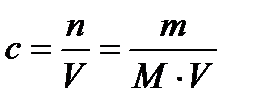 где, n - количество вещества, m - масса, M=44 - молярная масса,
где, n - количество вещества, m - масса, M=44 - молярная масса, 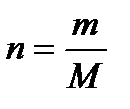 , V - объем раствора,
, V - объем раствора,  ,
, 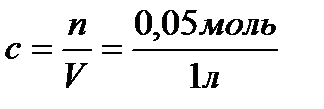 =0,05 моль/л,
=0,05 моль/л, ;
;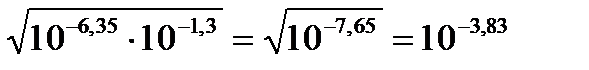 ,
,


