Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Избранные кинетические методы анализаСодержание книги
Поиск на нашем сайте
Во многих методах анализа к состоянию равновесия доводят химические превращения, по которым аналит переводят в другие соединения, которые формируют выходной сигнал (массу или объем, излучение или светопоглощения, электропроводность или потенциал электрода и т.д.). Это в основном удобно, так как позволяет, в частности, не контролировать точно время протекания реакции, а также сравнительно легко сохранить простое для расчетов соотношения между количеством вещества аналита и соединения, формирует выходной сигнал, на основе стехиометрии химических реакций. Однако, именно такая связь со стехиометрии затрудняет разработку методик для ультрамалых концентраций аналита. Например, если исходный сигнал - светопоглощения, то ограничены как коэффициент молярного светопоглощения (наибольшие значения - примерно 105 л/(моль•см), так и длина кюветы (на практике 1-10 см). Следовательно, для оптимальных значений светопоглощения, 0,2< А <1,2, нужна концентрация соединения, поглощает мир ло, не менее 10 мая моль/л по порядку величины. А практические возможности концентрирования (с опасностью загрязнения и ростом трудоемкости методики!) также не является неограниченными. Другое дело, если аналит (или продукт, образовавшийся из него в стехиометрических соотношениях) выступает в роли катализатора реакции, продукт которой формирует выходной сиґнал, хотя бы уже упомянутое светопоглощения. После ряда реакций катализатор, принимает в них участие, восстанавливается и может участвовать в новом цикле реакций. Практически используют значение числа таких циклов (кругообертного числа), равна нескольким сотням. Система, в которой протекает такая каталитическая реакция, неравновесная. Но - представьте себе - можно достичь такого соотношения между количеством вещества аналита и соединения, формирует выходной сигнал, на основе стехиометрических соотношений в равновесных системах?! Понятно, что с кинетическими методами анализа должны обязательно ознакомиться ученики химических и биологических спе-циальностей (последнее эти методы близки через роль ферментативных реакций в биохимии). В кинетических методах зависимость концентрации продукта от времени и концентрации реагентов определяет кинетическое уравнение. Конкретные виды этих уравнений приведены ниже относительно определенных лабораторных работ. Если измеряют концентрацию катализатора, используют в основном начальный период, где концентрации исходных реагентов относительно почти не изменилась, и поэтому реакция - псевдопершого порядке, то есть концентрация продукта пропорциональна времени протекания реакции и концентрации катализатора. В некоторых реакциях приходится учитывать наличие индукционного периода, когда скорость реакции еще не успела достичь постоянной величины.
В каталиметрии используют три вида зависимостей, обусловленные кинетическим уравнением. Им соответствуют три вида градуировки: по постоянному тем, по постоянным сиґналом и метод тангенсив. Первый из этих методов, постоянного времени, объяснено на следующих рисунках (сигнал - светопоглощения):
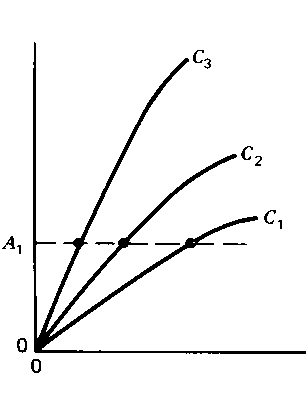
Рисунок слева объясняет принцип метода, он вспомогательный. На нем изображен зависимости светопоглощения от времени, различные кривые соответствуют различным концентрациям. Пунктирная линия отвечает некотором выбранном времени, t 1. Это время соответствует линейным участкам зависимости, где реакция псевдопервого впорядке. Рисунок справа - зависимость светопоглощения в момент t 1 от концентрации катализатора. Именно такую зависимость определяют экспериментально, она градуировочным графиком. Второй из этих методов, постоянного сигнала, объяснено на следующих рисунках (сигнал - светопоглощения):
И здесь вспомогательный рисунок слева объясняет принцип метода. От аналогичного рисунка в описании метода постоянного времени он отличается направлением пунктирной линии, здесь соответствует некоторой выбранной величине светопоглощения, А 1. И здесь выбрано линейные участки зависимости, где реакция псевдопервого впорядке. Рисунок справа - зависимость от концентрации катализатора, c, времени, что требуется, чтобы светопоглощения достигло величины А 1. Именно такую зависимость определяют экспериментально, она градуировочным графиком.
Метод тангенсов несколько кропотлив. В нем строят экс-экспериментальные графики зависимости сигнала от времени, которые в приведенных выше описаниях предыдущих методов мы считали обьянительными, которые строить для градуировки было необязательным. Для экспериментальних графиков подсчитывают тангенсы углов наклона линейных отрезков, и именно они являются координатами градуированного графика метода тангенсов. Этот метод применен в одной из лабораторных работ. Серию графиков рассмотрено в приложении «Применение програмы MATCAD в расчетах лабораторных работ по физико-химическим методам анализа». Мы выражаем благодарность возглавляемой доцентом И. Ф. Долмановою группе сотрудников кафедры аналитической хи-мии Московского университета - специалистов по кинетическим методом, которые дали нам методики работ, удобные для школьного практимума. Заметим, что, кроме каталитических, в химическом анализе используют и некаталитические реакции. К тому же, важны и другие неравновесные процессы. Самые распространенные из тех, которые могут включать или не включать химических реакций, является хроматографическое отделения аналитов, основанный на многократной последовательности процессов сорбции и десорбции. Это отделение является чрезвычайно эффективным и решает проблему многокомпонентного анализа с применением неселективных датчиков, регистрирующих выходной сигнал. Другой, ныне модный пример использования кинетических явлений - проточно-инжекционный анализ. Лабораторная работа № 5.1
|
||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 304; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.159.163 (0.011 с.) |