
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Теоретические основы потенциометрииСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Для решения аналитической задачи потенциометрические измерения можно проводить двумя способами. Первый способ - прямая потенциометрия, заключается в том, что в исследуемый раствор погружают необходимый индикаторный электрод и измеряют его потенциал относительно электрода сравнения, чаще хлоридсеребрянного. Потом по градуировочному графику, построенном в координатах Е - рс (с – концентрация стандартных растворов иона, который определяют), находят концентрацию иона, который определяют в анализированном растворе. Второй способ заключается в измерении потенциала индикаторного электрода в процессе химической реакции между ионом,который определяют, и соответствующим титрантом. По кривой титрования можно найти объем титранта, который необходим для достижения конечной точки титрования, и вычислить концентрацию иона, который определяют. Этот способ называют потенциометрическим титрованием. Из уравнения Нернста следует, что равновесный потенциал Ер зависит от соотношения активностей (концентраций) окисленной и восстановительной форм окислительно-восстановительной пары, то есть является функцией состава раствора: Ep = E0Oх/Red + Зависимость (3.1) и положено в основу потенциометрии. Равновесным называют потенциал, который приобретает изолированный электрод при погружении в раствор для анализа. Поэтому измерения потенциала необходимо проводить в условиях, максимально приближенным к термодинамическим: при отсутствии тока во внешней цепи ячейки (I=0) через время, необходимое для установления равновесия. Только при таких условиях можно рассматривать состав анализируемого раствора по измеренным потенциалам электрода.
3.1.2. Измерение потенциала
Прибор для измерения потенциала - потенциометр было предложено Поггендорфом (1841). Схема потенциометра приведена на рисунке 3.1. В верхнем контуре непрерывно течет ток от батареи. Это приводит к падению напряжения между точками Аи В.По закону Ома с учетом того, что сопротивление вдоль АВизменяется линейно, можно записать: EAB = IRAB = rIlAB, EAC = IRAC = rIlAC. Отсюда получаем EAC = EAC(lAC / lAB). Из этого уравнения следует, что при ЕАС = ЕХ або ЕAC = Ест ток в нижнем контуре не протекает. Если в цепь введена стандартная ячейка Ест,то EAC ст = E ст = EAB(lACст / lAB); если ключом II введена ячейка, которая измеряет Ех,то EACх= Eх= EAB(lACх / lAB). Из этих уравнений можно получить, что Eх = Eст(lACх / lACст), где lACхиlACст – участки линейного сопротивления, которые соответствуют сбалансированной цепи (ток в нижнем контуре отсутствует), который состоит из Ех =Ест. Следовательно, для определения Ехнеобходимо знать потенциал стандартного элемента Ести измерить lACх и lACст. Батарея
Для удобства измерения шкалу градуируют непосредственно в Вольтах. Как стандартный элемент с известной ЭДС используют элемент Вестона (рис. 3.2), схематично его можно представить так: Cd(Hg)│CdSO4∙ 8∕3 H2O(нас.), Hg2SO4(т)│Hg, где анод – амальгамма кадмия, катод – металическая ртуть. При замыкании цепи происходят полуреакции: на аноде Cd(Hg) → Cd2+ + Hg (р)+2е‾, на катоде Hg22+ + 2e‾ → 2Hg (р). При 25 0С ЭДС элемента Вестона равна 1,0183 В.
Для градуировки шкалы в цепь с помощью ключа П(див. рис.3.1) вводят элемент Вестона Eст и устанавливают скользящий контакт С на отметку 1,0183 В. Периодически замыкая на короткое время телеграфный ключ К, регулируют величину сопротивления R так, чтобы гальванометр показал отсутствие тока в нижнем контуре цепи. Теперь можно перейти к измерению потенциала ячейки Ех. Для этого, не нарушая балансировки цепи, ключ П переводят в положение, которое включает ячейку Ех в цепь. Периодически замыкая на короткое время ключ К, перемещают скользящий контакт С до тех пор, пока гальванометр не будет показывать отсутствие тока в нижнем контуре цепи. Поскольку шкала АСХ градуированная в вольтах, остается только записать показатели. Точность измерения потенциала с помощью потенциометра главным образом зависит от чувствительности гальванометра: чем меньше ток способен определить гальванометр, тем выше точность. При измерении потенциалов ячеек с высоким сопротивлением гальванометр заменяют электронным усилителем. Усиленный ток течет в несбалансированной цепи, затем определяют по шкале миллиамперметра. Такие потенциометры, которые имеют электронный усилитель тока, называют рН-метрами (эти приборы позволяют быстро и точно измерять потенциал). Шкалы этих приборов градуированные в милливольтах (мВ) и в единицах рН. К прибору прилагается набор индикаторных электродов (платиновые, стеклянные) и электроды сравнения (каломельные и хлоридсеребрянные).
Типи электродов [3] Индикаторные электроды. Индикаторными электродами для потенциометрических измерений могут быть металлические и мембранные (йоноселективни) электроды. Для металлических электродов характерна электронная проводимость, для мембранных – ионная. Металлические электроды. Различают активные и инертные металлические электроды. Активные металлические электроды изготовляют из металлов Ag, Си, Cd, Pb, образующих восстановленную форму оборотной окислительно-восстановительной полуреакции. Любой из таких электродов в растворе, содержащем собственные ионы, приобретает потенциал, который изменяется при изменении активности этих ионов. Например, зависимость потенциала серебряного электрода от активности ионов Ag+ в соответствии с уравнением оборотной полуреакции Ag++ e ‾ ↔ Ag выражается уравнением Нернста: E = E0Ag+ / Ag+ 0,059 lg aAg+ Это означает, что по измеренному потенциалом серебряного эле-ктрода можно судить об активности ионов Ag+ в растворе. Электроды, подобные серебрянному, потенциал которых зависит от активности собственных ионов в растворе, называют электродами I рода. Активные металлические электроды можно использовать для определения не только собственных ионов, но и для определения анионов, образующих с этими ионами малорастворимые или комплексные соединения. Например, если серебряный электрод погрузить в раствор, содержащий С1‾ -ионы, то согласно уравнениям Ag++e‾↔AgиAg++Cl‾↔AgCl потенциал серебряного электрода будет зависеть от активности С1‾-ионов: Е=E0Ag+/Ag+0,0591 lgaAg+=E0Ag+/Ag+0,0591lg E0Ag+/Ag + 0,0591 lgKSAgCl – -0, 0591lgaCl = E0AgCl/Ag - 0, 0591lgaCl . Электроды, потенциалы которых зависят от ак-тивности ионов, образующих малорастворимые соединения, называют электродами II рода. Такие электроды являются электродами сравнения. Инертные металлические электроды изготовляют из платины или золота. Их потенциалы зависят от соотношения активностей окисленной или восстановленной форм полуреакции. Например, потенциал платинового электрода, погруженного в раствор, содержащий ионы Fе (III) та Fе (II), согласно уравнению Нернста E= E0Fe(III) / Fe(II) + 0,0591 зависит от соотношения активностей Fe (III) и Fe (II). Измеряя потенциал электрода, можно проследить за изменением соотношения аFe(III) /аFe(II) при прохождении любой химической реакции с участием Fe (III) или Fe (II). Поэтому такой электрод можно использовать для потенциометрического титрования Fe (III) или Fe (II). Ионоселективные электроды. Важнейшей составной частью ионоселективного электрода является полупроницаемая мембрана. Это тонкая пленка, отделяющая внутреннюю часть электрода (внутренний раствор) от анализируемого раствора и имеет способность пропускать ионы только одного знака заряда (катионы или анионы). Во многих случаях эти мембраны проницаемы преимущественно для ионов только одного вида при наличии других ионов того же знака заряда. Можно, например, изготовить электрод для определения ионов Na+ при наличии ионов других щелочных металлов. Расположим полупроницаемую мембрану между двумя растворами с различными концентрациями иона А+. Один из таких растворов - анализируемый (или внешний) имеет концентрацию c1,, другой - стандартный (или внутренний)c2. На внешней и внутренней поверхностях мембраны будет происходить обмен ионами, то есть ионы из раствора будут проникать в фазу мембраны. Из-за того, что активности ионов в растворе и в фазе мембраны разные, на обеих поверхностях мембраны возникнут предельные потенциалы Е1 и Е2 (рис. 3.3). Если во внешний и внутренний растворы погрузить электроды сравнения, то можно измерить разность потенциалов ∆Е, которая равна мембранному потенциалу Ем: Eм = E1 − E2 = 0,0591 lg(a1 / a2).
Поскольку активность ионов А+ во внутреннем растворе постоянка,то Eм
Рис. 3.3. Мембранный электрод: электрод сравнения (1 − внешний, 2 − внутренний) Если анализируемый раствор вместе с ионами, которые определяются (А+), содержит и другие ионы, то необходимо учесть их влияние на потенциал мембранного электрода. В этом случае возможна реакция обмена A+м + B+p=p ↔ B+м + A+p=p, в результате которой посторонние ионы В+ проникають проникают в фазу мембраны. Глубина протекания этой реакции описывается кон константы равновесия, которую называют константой обмена КA-В, которая зависит от природы мембраны и ионов В+: KA-B = Проникнув в мембрану, ионы движутся в ней, из-за разницы подвижностей ионов в фазе мембраны UA и UB возникает диффузный потенциал, который делает вклад в потенциал измеряемого мембранного электрода. Потенциал электрода с мембраной, которая реагирует на присутствие в растворе ионов А+ та В +, описывают уравнением Ем = const + 0,0591 lg(а А + KA -B где aА− активность ионов, которые определяют А+; ав – активность посторонних ионов В+; UА и UB – активности ионов А+иВ+ в фазе мембранны; KА-В – константа обмена. Величину КА-В Уравнение (3.2) можно записать так: Ем = const + 0,0591 lg (a A+ kA,Ba B), что подтверждается для однозарядных ионов А+ и В +. Для ионов А, В, С,... с зарядами zА, zB,zc,... зависимость потенциала мембранного электрода выражают уравнением, которое предложил Б. В. Никольский, его называют модифицированным уравнением Нернста: Eм= const + + Главные характеристики ионоселективного электрода - интервал выполнения электродной функции, селективность и время отклика. Интервал выполнения электродной функции относительно иона А, который определяют, характеризуется длиной линейного участка зависимости потенциала электрода от логарифма активности (концентрации) иона А. Если эта зависимость имеет угловой коэффициент (при 25 0С), близкий к 59,16/zA мВ/раA, то электрод выполняет функцию Нернста в данном интервале активностей. Протяженность линейного участка и близость углового коефециента к теоретическому зависят от природы мембраны. При низких концентрациях (для очень хороших электродов при концентрации близко к 10 -7 М) наблюдается отклонение от линейной зависимости, то есть электрод теряет электродную функцию. Точка перехода на графике (рис. 3.4) характеризует предел определения с помощью данного электрода.
Рис. 3.4 Интервал выполнения електрофункции и граница определения ионоселективного электрода. Селективность электрода относительно иона А, который определяется, в присутствии постороннего иона В характеризуется потенциометрическим коэффициентом селективности kА,В. Если kА,В<1, то электрод селективный относительно иона А; если kA,B>1, то относительно иона В.
Время отклика ионоселективного электрода характеризует время достижения постоянного потенциала электрода. Чем мен ше время отклика, тем лучше электрод. Время отклика может колебаться от секунд до нескольких минут. Это зависит от природы мембраны, а также от методики измерения потенциала, то есть от того, переносят электрод с более разбавленного раствора в более концентрированный или наоборот. Для большинства электродов потенциал електрода за 1 мин. достигает >90 % от конечной величины.
Класификация ионоселективных электродов В зависимости от того, какой материал используют для изготовления, различают твердые, стеклянные и жидкие мембраны.
LaF3 + 30H- ↔ La(OH)3 + 3F-), поэтому электрод нельзя применять в щелочной среде. В очень кислых растворах электродная функция нарушается вследствие реакции образования малодиссоциированной HF. Фторид-селективный электрод. Много лет выпускаемый промышленностью и применяют для определения фтора в различных объектах (почва, пепел растений, минералы, воды, воздух, пищевые продукты, биологические жидкости, зубная эмаль). На основе этого электрода создан автоматический датчик для контроля процесса фторирования питьевой воды. Хорошим материалом для изготовления твердых мембран является Ag2S, так как он характеризуется малой растворимостью (Ks ~10-51), достаточно низким электрическим сопротивлением и высокой стойкостью к действию окислителей и восстановителей. Функция Нернста электрода в рас творах серебра нитрата выполняется в пределах pAg от 0 до 7. Этот электрод можно использовать для определения и сульфид-ионов, его потенциал определяется уравнением Е = const-
Рис. 3.6 Схемы стеклянного электрода (а), та ионселективных электродов с жидкой (б) и твердой мембраной (в). 1−стеклянная мембрана, 2−внутренний раствор, 3−стеклянная трубка, 4−внутренний электрод, 5−жидкий ионообменник, 6−мембрана,насыщенная жидким ионообменником, 7−гомогенная или гетерогенная твердая мембрана. Стеклянные мембраны изготавливают из специального стекла. Их состав подбирают таким образом, чтобы мембрана проявляла повышенную селективность к иону, который определяют. Первым электродом со стеклянной мембраной был электрод, селективный относительно E = 0,0591lgaH+. Это означает, что электрод имеет водородную функцию и его можно использовать для измерения рН. Однако надо помнить, что и в очень кислой и в очень щелочной среде электрод дает неправильные результаты, так как наблюдается большая погрешность (ΔрН) измерений. В сильно щелочной среде заниженные результаты объясняют влиянием ионов щелочных металлов вследствие реакции обмена на поверхности гидратированного геля: H+Gel- + M+ ↔ M+Gel- + H+. стекло раствор стекло раствор Константа равновесия этой реакции Кн-м зависит от сорта стекла, поэтому мембраны из различных видов стекла будут характеризоваться различными коэффициентами селективности Жидкие мембраны готовят так: растворяют органическое ионное соединение (например, кальциевую соль эстерортофосфорной кислоты) или нейтральную (например, валиномицина) соединение в органическом растворителе. Этот раствор наносят на пористый полимерный носитель. По конструкции электрод с жидкой мембраной похож на стеклянный. Важнейшие представители электродов с жидкой мембраной - Са-селективний электрод на основе кальциевой соли эстерортофосфорной кислоты [(RO)2POO]2Ca (R содержит от 8 до 16 атомов С) и К-селективный электрод на основе валиномицина. Существуют еще ферментные электроды. Согласно рекомендациям ИЮПАК ферментный электрод - ионоселективный электрод, покрытый слоем фермента, который вызывает реакцию органического или неорганического вещества (субстрата) с образованием частиц (ионов, молекул), обусловливающие отзыв электрода. В основе работы ферментного электрода является ферментативная реакция: Фермент Вещество, которое определяется (субстрат) Продукты(молекулы, ионы)
В результате образуется частица, за изменением кон-центрации которой можно проследить с помощью ионоселективного электрода. Каждый фермент катализирует только один тип реакции, поэтому ферментные электроды имеют высокую селективность. Для примера рассмотрим электрод на основе фермента уреазы для определения карбамида CO(NH2)2 (рис. 3.7). В слое геля, содержащего уреазу, происходит реакция: Уреаза CO(NH2)2 + 2H2О + H + 2NH+4 + HCO-3 Буферр Н+ Концентрацию NH+4 – ионов, которые образуются, измеряют с помощью NH+4-селективного электрода. При постоянной активности фермента потенциал этого электрода является функцией логарифма концентрации CO(NH2)2.
Среди ион-селективных электродов выделим как важнейшие: стеклянные (H+, Na+, NH4+, Ag+, Tl+, Li+, Cs+), твердомембранные (F‑, Cl‑, Br‑, I‑, CN‑, SCN‑, S2‑, Ag+, Pb2+, Cd2+, Cu2+), жидкомембранные (Са2+, NO3‑, CO32‑, поверхностно-активных веществ), газочувствительные (NH3, CO2, SO2, H2S), биоспецифические (ферментные, имуноферментные, бактериальные, микробные). Титруя потенциометрически, регистрируют изменение потенциала в зависимости от количества титранта. Поскольку в окрестности точки стехиометрии буферность мала, то э.д.с. ячейки резко изменяется с изменением количества титранта. На кривой титрования в координатах объем раствора титранта - э.д.с. наблюдаем «скачок», с крутой частью которого отождествляем конечную точку титрования. Преимущества Потенциометрического титрования по сравнению с титрованием с индикатором заключается в возможности точнее зафиксировать стехиометрического точку, возможность титровать мутные и окрашенные растворы. Используя математические методы, можно определять координату точки стехиометрии по информации из широкого оттенка значений переменной - расходы титранта. В методах кислотно-основного титрования применяют как индикаторный электрод, обратимый относительно ионов Н+, наиболее распространенный - стеклянный. В окислительно-восстановительном титровании обычно используют платиновый электрод. В комплексонометрическом и осадительной титровании индикаторный электрод должен быть селективным в отношении одного из ионов, участвующих в реакции.
Лабораторная работа № 3.1 Измерения рН водных растворов методом ионометрии Цель работы: 1. Освоить принципы и технику прямых потенциометрических определений и работу со стеклянным электродом. 2. Проградуировать ячейку со стеклянным электродом. Определить рН воды, биологических или химических растворов. 1. Общие сведения Э.д.с. (Е) цепи, содержащей стеклянный электрод и электрод сравнения, равна: Ei = E Æ − q · pH. (1) 2. Реактивы и оборудование Весы лабораторные ВЛР-200 с соответствующими гирями; Иономер ЕВ-74 или рН-метр; Электрод хлорсеребряный ЭВЛ-1М4 и электрод стеклянный ЭСЛ-63; Стаканчик емкостью 50 мл; Колба емкостью 50 или 100 мл; Стандарт-титры для приготовления эталонных буферных растворов для pH-метрии; Хлорид калия, хч, насыщенный раствор; Кислота соляная, хч, раствор с молярной кнцентрацией 0,1 моль/дм3; Гидрофталат калия, чда; Тетраборат натрия, хч; Дигидрофосфат калия, хч; Гидрофосфат натрия, чда; Тетраоксалат калия, хч; Вода дистилированная. 3. Подготовительные операции и порядок измерений 3.1.1. Приготовление стандартных буферных растворов Стандартные буферные растворы рекомендуют готовить из стандарт-титров. В случае их отсутствия их можно готовить с реактивов. Раствор тетраоксалата калия, рН = 1,68, с концентрацией 0,05 моль/дм3 (12,7 ± 0,02 г KH3C4O8·2H2O, в 1 дм3 раствора при 20 оС). Раствор гидрофталата калия, рН = 4,01, с концентрацией 0,05 моль/дм3 (10,21 ± 0,02 г KHC8Н4O4 в 1 дм3 раствора при 20 оС). Раствор дигидрофосфата калия, рН = 6,86, с концентрацией 0,025 моль/дм3, и гидрофосфата натрия, с концентрацией 0,025 моль/дм3 (3,40 ± 0,01 г KH2РО4 и 3,55 ± 0,01 г Na2HРО4 в 1 дм3 раствора при 20 оС) Раствор тетрабората натрия, pH = 9,18, с концентрацией 0,01 моль/л (3,81 ± 0,01 г Na2B4O7·10H2O, буры, в 1 дм3 раствора при 20 оС) Реагенты должны быть высушенными до постоянной массы при таких условиях: тетраоксалат калия при 57 ± 2 оС, гидрофталат калия и дигидрофосфат калия − при 110 ± 5 оС, гидрофосфат натрия при 120 ± 5 оС. Буру выдерживают до постоянной массы при комнатной температуре в эксикаторе над смесью сырого хлорида натрия и сахара. Все соли должны быть специальной квалификации «для рН-метрии» или реактивами марки «хч», не загрязненные при хранении. Готовя буферные растворы фосфатов (рН = 6,86) и буры (рН = 9,18) используют освобожденную от углекислоты дистиллированную воду. Хранить буферные растворы рекомендуют в герметичной стеклянной или полиэтиленовой посуде. Срок хранения фосфатного буферного раствора - 2 мес, остальных - 3 мес. 3.2. Порядок измерений Схема прибора приведена на рис. 3.2. Измеряют в режиме ЭДС («mV») и узком поддиапазоне («-1-4»). а) Рабочие части электродов ополаскивают дистиллированной водой. Капли воды с электродов осторожно устраняют (без трения) кусочком фильтровальной бумаги. б) Электроды погружают в небольшую порцию анализируемого раствора и выливают ее. Для измерений заливают свежую дозу раствора, что полностью покрывать сферическую стеклянную мембрану на (40-60 мл).
Рис. 3.2 1 − штатив, 2 – стакан с раствором, 3 – стеклянный электрод, 4 – электрод сравнения, 5 − иономер Штатив, муфта, лапки; пробирки, шпатели. Рабочие части электродов не должны касаться друг друга, стенок и дна стакана. 4. Ход работы 4.1 Градуируют, используя стандартные буферные растворы рН. Результаты измерений заносят в таблицу
Параметры E Æ и q рассчитывают по методу наименьших квадратов. Измеряя только по двум стандартными буферными растворами, параметры рассчитывают по формулам: q = (Е 2 − Е 1) / (рН s 2 − рН s 1), E Æ = Е 1 −qрН s 1. 4.2. Чтобы определить рН раствора, измеряют ЭДС (Е і) соответственно вышеуказанных требований (3.2) рН в растворе рассчитывают из уравнения рН = (Еі - E Æ) / q. Лабораторная работа № 3.2 Определение фторидов в зубной пасте методом ионометрии Цель работи: 1. Освоить принципы и технику прямых потенциометрических определений; 2. Определить емкость свободного иона F - в зубной пасте. 1. Общие сведения Определение основано на измерении э.д.с. ячейки, содержащей фторидселективний электрод (FСЕ) и электрод сравнения, с предварительной построением градуировочной зависимости. Фторидселективний электрод имеет кристаллическую мембрану из фторида лантана LaF3 с добавлением европия. Ионная проводимость мембраны обусловлена подвижностью ионов фторида в кристаллической решетке LaF3. В корпус электрода помещены растворы фторида натрия и хлорида калия. В раствор погружен хлорид-серебряный электрод. Поскольку концентрации внутреннего раствора зафиксирована, то потенциалы хлорид-серебряного электрода и внутренней поверхности мембраны - величины постоянные. На границе раздела фаз мембраны электрода и раствора, которая содержит фторид, возникает разность потенциалов, пропорциональная логарифму градиенту концентрации. Изменение суммарного потенциала F--СЕ связана с изменением активности ионов фторида во внешнем растворе. Другие ионы (за исключением ионов OH-, радиус которых близок к радиусу F-) не способны замещать фторид в кристаллической решетке LaF3 и не влияют на потенциал мембраны. На концентрацию ионов F-влияют химические преобразования, в частности реакции с иономводорода и с ионами ме таллов (Al3+, Fe3+, и.т.д). Поэтому следует регулировать рН: среда должна быть кислым, но не слишком.С КЛД видно, что рН можно понижать до 4-5. В качестве среды используют буфер регулирования общей ионной силы, или БРЗИС, содержащий уксусную кислоту (которая регулирует рН), трилон-Б (демаскирует ион F-), хлорид натрия (обеспечивает ионную силу). Э.д.с. цепи линейная от логарифма концентрации иона F, Ei = E Æ - q × lg [F-]. (1) Используя FСЭ, необходимо, чтобы EÆ и q хранились при градуировке и работы с исследуемыми растворами. Во все растворы вводят одинаковые концентрации БРЗИС.Так как концентрация F--иона во всех растворах низкая (от 10-5 до 10‑2 моль/л), а ионная сила стабилизирована, вместо равновесной концентрации в уравнении (1) применяют аналитическую, с (F‑). 2. Реактивы и оборудование Иономер ЭВ-74 или рН-метр-милливольтметр; Электрод фторидселективний типа ЕF-N; Полуэлимент сравнения ЕВЛ-ІМ3 или аналогичный; Магнитная мешалка; Штатив для закрепления электродов; Электрохимическая ячейка по форме стаканчика емкостью 100-150 мл; Колбы мерные обьемом 100 мл; Пипетки мерные обьемом 20, 10, 5 мл; Пипетка градуировочная обьемом 1 мл; Промывалка; Бумага фильтровальная; Раствор фторида натрия, с (F-) = 0,01 моль/л (исходный); Буферный раствор регулирования общей ионной силы (БРЗИС). В 500 мл дистиллированной воды при постоянном перемешивании на магнитной мешалке растворяют 58 г NaCl, добавляют 57 мл уксусной кислоты (w = 100%), 200 мл раствора этилендиаминтетраацетата натрия (c (ЕДТА) = 0,05 моль/л) и 120 мл гидрооксида натрия (с (NaOH) = 5 моль/л). Раствор охлаждают до комнатной температуры и добавляют раствор NaOH по капле до рН = 5,0−5,5 (контролируют рН‑метром). 1. Алгоритм измерений 3.1. Построение градуировочной зависимости F--СЕ 3.1.1. Приготовление градуировочных растворов Последовательно разводя исходный раствор NaF, готовят растворы с молярными концентрациями с (NaF) = 1×10-5, 3×10-5, 1×10-4, 3×10-4, 1×10‑3, 3×10-3 моль/л. 3.1.2. Измерения и расчеты Измерить э.д.с. в каждом растворе. Для этого 20 мл раствора вносим пипеткой в стакан обьемом 100 или 150 мл, добавляем пипеткой 5 мл БРЗИС и осторожно перемешивают раствор круговыми движениями. Размещаем стаканчик под электродами и опускаем держатель электродов так, чтобы они погрузились в раствор не менее чем на 0,5 см. Результаты измерений оформляем в таблицу
Строим градуировочный график зависимости э.д.с. от lg с (F-). Определяем оттенок линейности градуировочной характеристики. В этом диапазоне методом наименьших квадратов рассчитываем параметры E Æ и q градуировочной функции (1). 2.2. Определение содержания фторида Точную навеску около 1 г зубной пасты растворяем в 100 мл дистиллированной воды в мерной колбе. Нерастворенную часть пасты отделяем центрифугированием. Отмеряют пипеткой 20 мл исследуемого раствора в стакан обьемом 100 или 150 мл, добавляем пипеткой БРЗИС. Перемешивают раствор на магнитной мешалке и оставляют на 20 мин, чтобы завершить демаскирование. Измеряют э.д.с. (Е) при включенной магнитной мешалке. Молярную концентрацию фторида определяем по градуировочной зависимости (1) и пересчитываем на массовую долю F- в пасте.
Лабораторная работа № 3.3
|
|||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 484; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.14.234.146 (0.017 с.) |


 ln
ln  (3.1)
(3.1)

 =
=
 const + 0, 0591 lga1, то есть потенциал мембранного электрода зависит от активности ионов А+ в анализируемом растворе.
const + 0, 0591 lga1, то есть потенциал мембранного электрода зависит от активности ионов А+ в анализируемом растворе.
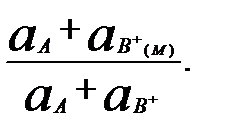
 ), (3.2)
), (3.2) называют потенциометрическим коэффициентом селективности, kА,Вотражает относительное влияние ионов В+ на потенциал электрода, селективного к ионам А+, и характеризует способность электрода различать имеющиеся в растворе ионы А+иВ+.
называют потенциометрическим коэффициентом селективности, kА,Вотражает относительное влияние ионов В+ на потенциал электрода, селективного к ионам А+, и характеризует способность электрода различать имеющиеся в растворе ионы А+иВ+. lg
lg 


 Рис. 3.5. Фторид – селективный электрод: 1 – пластина с LaF3; 2–стандартный внутренний раствор NaF+NaCl;
3 – внутренний электрод сравнения; 4 – изоляция; 5 – токоотвод
Рис. 3.5. Фторид – селективный электрод: 1 – пластина с LaF3; 2–стандартный внутренний раствор NaF+NaCl;
3 – внутренний электрод сравнения; 4 – изоляция; 5 – токоотвод
 в сильно щелочной среде эта зависимость имеет наклон 29,6 мВ/р аS в пределах pS от 2 до 6. Благодаря низькому электрическому сопротивлению Ag2S часто используют как инертную матрицу для создания электродов на основе смесей; например, AgBr и Ag2S для определения бромид-ионов или CuS и Ag2S для определения ионов меди (II). Иногда такие электроды изготавливают без внутреннего раствора (рис. 3.6), что удобно на практике. Такие электроды называют твердотельными.
в сильно щелочной среде эта зависимость имеет наклон 29,6 мВ/р аS в пределах pS от 2 до 6. Благодаря низькому электрическому сопротивлению Ag2S часто используют как инертную матрицу для создания электродов на основе смесей; например, AgBr и Ag2S для определения бромид-ионов или CuS и Ag2S для определения ионов меди (II). Иногда такие электроды изготавливают без внутреннего раствора (рис. 3.6), что удобно на практике. Такие электроды называют твердотельными.
 Н+-ионов, который вытеснил все другие электроды, которые использовали для измерения рН. Затем были созданы стеклянные электроды для определения других ионов (К+, Na+, Ag+). Стеклянный электрод для измерения рН изображен на рис. 3.6. Главная его часть - тонкая стеклянная мембрана в виде шарика, которая припаяна к стеклянной трубки. Для изготовление мембраны чаще всего используют стекло, содержащее 22 % Na2О, 6 % СаО, 72 % SiО2. Внутрь шарика наливают 0,1 М раствор соляной кислоты, насыщенный хлоридом серебра, и вставляют серебряный провод, который является внутренним электродом сравнения. Структуру стекла составляет решетка из атомов кислорода, которые связаны друг с другом через атомы кремния. Кремний связан с четырьмя атомами кислорода, а кислород участвует в двух группах SiО4, поэтому образуется трехмерная решетка. Полости в ней заняты катионами, которые содержатся за счет электростатических взаимодействий с кислородом. Чем выше заряд катиона, тем крепче он содержится, поэтому в реакции обмена с протонами, которая происходит при гидратации стекла, способны участвовать практически только однозарядные катионы. Если стеклянный электрод долгое время выдержать в воде, то на обеих поверхностях мембраны образуется тонкий слой (~ 10 -4 мм) гидратированного геля. Все полости занимают ионы Н+, которые вытеснили ионы натрия, которые там находились. Потенциал хорошо вымоченного стеклянного электрода описывают уравнением
Н+-ионов, который вытеснил все другие электроды, которые использовали для измерения рН. Затем были созданы стеклянные электроды для определения других ионов (К+, Na+, Ag+). Стеклянный электрод для измерения рН изображен на рис. 3.6. Главная его часть - тонкая стеклянная мембрана в виде шарика, которая припаяна к стеклянной трубки. Для изготовление мембраны чаще всего используют стекло, содержащее 22 % Na2О, 6 % СаО, 72 % SiО2. Внутрь шарика наливают 0,1 М раствор соляной кислоты, насыщенный хлоридом серебра, и вставляют серебряный провод, который является внутренним электродом сравнения. Структуру стекла составляет решетка из атомов кислорода, которые связаны друг с другом через атомы кремния. Кремний связан с четырьмя атомами кислорода, а кислород участвует в двух группах SiО4, поэтому образуется трехмерная решетка. Полости в ней заняты катионами, которые содержатся за счет электростатических взаимодействий с кислородом. Чем выше заряд катиона, тем крепче он содержится, поэтому в реакции обмена с протонами, которая происходит при гидратации стекла, способны участвовать практически только однозарядные катионы. Если стеклянный электрод долгое время выдержать в воде, то на обеих поверхностях мембраны образуется тонкий слой (~ 10 -4 мм) гидратированного геля. Все полости занимают ионы Н+, которые вытеснили ионы натрия, которые там находились. Потенциал хорошо вымоченного стеклянного электрода описывают уравнением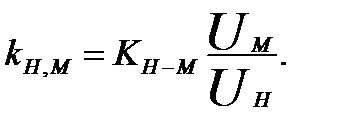 Погрешность измерения рН щелочных растворов также будет зависеть от сорта стекла.
Погрешность измерения рН щелочных растворов также будет зависеть от сорта стекла.




