
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химический анализ природных вод, графическоеСодержание книги Похожие статьи вашей тематики
Поиск на нашем сайте
Изображение их результатов и оценка пригодности Для различных целей
Введение
Вода является сильнейшим растворителем горных пород и представляет раствор сложного состава с очень широким диапазоном содержания растворенных веществ как по числу, так и по концентрации. Химический состав воды определяет возможность применения её для различных целей (хозяйственно-питьевого использования, орошения), а также агрессивное свойство по отношению к цементу бетона и пр.[1,2,4,5]. Важнейшими компонентами природных вод являются ионы: Са2+, Mg2+, Na+, K+, NH+4, HCO3-, CO32-, SO42-, NO3-, а также газы: CO2, H2S, O2 и др.Количественное содержание этих ионов в исследуемой воде устанавливается методами аналитической химии [6]. Целью данной практической работы являются – основываясь на знаниях, полученных по курсу «Общая химия» уметь анализировать химический состав природных вод, графически изображать их результаты, оценивать пригодность для различных целей.
Формы выражения результатов химического анализа
Различают весовую, молярную (эквивалентную) и процент молярную (эквивалентную) формы, каждая из которых имеет свои преимущества и недостатки [4,6,7].
Массовая или весовая форма
Массовая или весовая форма представляя собой основную форму выражения результатов химического вещества, характеризуется тем, что содержание ионов в исследуемой воде определяется в весовых единицах – в граммах или миллиграммах на дм3 (г/дм3, мг/дм3). Существенным недостатком весовой формы следует считать невозможность проверки результатов выполненного анализа, ввиду того, что суммы весового количества анионов и катионов между собой не совпадают.
Молярная (эквивалентная) форма Переходя к молярной форме содержание каждого иона, следует выражать не в весовых единицах (г/дм3, мг/дм3), а в молярных (моль/дм3, моль/дм3). Для пересчёта в молярную (эквивалентную) форму весовое количество иона, полученное при анализе воды делится на его молярный (эквивалентный) вес (таблица 4). Аналогичный результат достигается умножением весового содержания иона на соответствующий пересчётный множитель, представляющий собой величину обратную мольному весу.
Таблица 4 Молярные веса и пересчётные коэффициенты главнейших ионов
В связи с тем, что раздельное определение ионов Na+ и К+ при анализе воды в полевых условиях встречает большие трудности, содержание этих ионов находится суммарно как разность между суммой эквивалентов анионов и суммой эквивалентов катионов Са2+ и Mg2+. Ввиду того, что ионы реагируют между собой в молярных (эквивалентных) количествах, сумма эквивалентов анионов должна равняться сумме эквивалентов катионов. Пересчёт в молярную (эквивалентную) форму определяет, таким образом, возможность проверки результатов выполненного анализа.
Процент – мольная (эквивалентная) форма
Для вычисления содержания каждого иона в процентах (% - моль), сумму эквивалентов анионов (∑ r А) и сумма эквивалентов катионов (∑ r К) принимают в отдельности за 100%,после чего рассчитывают процентное содержание каждого иона по отношению к этой сумме. Пересчёт в процент – мольную (эквивалентную) форму осуществляется для выявления ионов, преобладающих в исследуемой воде, для сопоставления химического состава подземных вод различной минерализации, с целью классификации этих вод и графического изображения результатов анализа.
Определение состава природных вод
Жёсткость воды Жёсткость воды определяется содержанием растворённых солей, кальция и магния. Различают общую, устранимую и постоянную жёсткости воды. Общая жёсткость обусловлена суммарным содержанием ионов Ca2+ и Mg2+, устранимая представляет собой ту часть жёсткости, которая вызывается бикарбонатами Ca2+ и Mg2+ и устраняется кипячением воды, постоянная равно общей жёсткости минус устранимая. Общая жёсткость принято выражать в миллиграмм – моль (эквивалент) на дм3 (ммоль/дм3) и в немецких градусах (оН). Миллиграмм – моль жёсткости соответствует раздельному содержанию в дм3 воды эквивалентных количеств Ca2+, Mg2+ и CaО, а именно 20,04 мг Ca2+ , 12,16 мг Mg2+ или 28 мг CaО. Немецкий градус жесткости эквиваленте содержанию 10 мг CaО в литре воды. Сопоставляя названные показатели жесткости по величине CaО устанавливаем, что один ммоль жесткости равен 2,8 немецких градусов. Значение общей жесткости воды в ммоль/дм3 находится суммированием содержания иона Ca2+ и Mg2+ в молярной форме. Умножая полученную величину на 2,8 находим общую жесткость в немецких градусах.
Минерализация воды
Минерализация воды определяется содержанием растворенных минеральных веществ и рассчитывается как арифметическая сумма весовых количеств всех ионов в дм3 воды. При подсчете минерализации суммарное содержание ионов, выраженное в миллиграммах на дм3 переводится в граммы, с округлением до первого знака после запятой. Пример: сумма ионов составляет 14176 миллиграмм, минерализация воды 14,2 г/ дм3.
Содержание растворенных газов, температура, дебит Полный химический анализ воды предусматривает определение растворенных газов (СО2, Н2S и др.) содержание которых выражается миллиграммами на дм3 (мг/ дм3). При полевых исследованиях устанавливается температура природных вод (Т) и определяется дебит источников или скважин путем замера вытекающей или откачиваемой из них воды. Дебит (Д) выражается литрами в секунду (л/с) или кубометрами в сутки (м3/сутки).
Химическая классификация природных вод Классификация О.А. Алекина
Классификация О.А. Алекина (рисунок 8) сочетает принцип деления подземных вод по преобладающим ионам и по соотношению между ними. По преобладающему аниону О.А. Алекиным /4/ выделяются три класса вод: гидрокарбонатная, сульфатная и хлоридная. По ведущему катиону различают группы кальциевых, магниевых и натриевых вод. Соотношение ионов позволяет установить различные типы вод. При выделении которых содержание ионов выражается в молярной форме (r)
1 тип r 2 тип r 3 тип r 4 тип r 3 тип подразделяется: 3а rCl- < r Na++ r Mg2+ (хлормагниевый), 3б rCl- < r Na++ r Mg2+(хлоркальциевый).
Рисунок 8 Классификация природных вод по О.А. Алекину
Типы гидрокарбонатных: Ca - I,II,III; Mg – I,II,III; Na – I,II,III Типы сульфатных: Ca - IV,II,III; Mg – IV,II,III; Na – I,II,III Типы хлоридных: Ca - IV,II,III; Mg – IV,II,III; Na – I,II,III
Эти гидрохимические оценки можно записать и в более сжатой форме. Если классы вод обозначить условными индексами (С-гидрокарбонатные воды, S-сульфатные, Cl-хлоридные), а типы римскими выделить символами ведущих катионов (Ca,Mg, Na), а типы римскими цифрами (I-IV), то химическая характеристика вод указанного состава запишется так: Эту краткую форму записи следует использовать, указывая класс воды по Алекину в таблице результатов химических анализов природных вод (таблица 5).
Формула М.Г. Курлова При массовых определениях химического состава природных вод возникает необходимость обобщения, полученных результатов и изображения анализов воды в виде кратких формул, допускающих обзор и интерпретацию аналитического материала. Формула Курлова представляет собой псевдо-дробь, в числителе которой в порядке убывающего содержания записываются анионы, а в знаменателе катионы, выраженные в процентах (дробные величины процентов округляются до целых чисел). Слева от полученной «простой дроби» указывается содержание растворенных газов в мг/ дм3 и величина минерализации воды в г/ дм3, справа от нее температура воды и дебит скважины в м3 /сутки. Образец записи результатов анализа в виде формулы Курлова приводится ниже
Наименование водам дается по преобладающим (свыше 20% моль) анионам и катионам в порядке их возрастания (приведенный анализ читается – вода сульфатно-хлоридно-карбонатная, магниево-кальциевая).
|
||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-26; просмотров: 1011; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.218.108.8 (0.007 с.) |

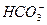 > r Ca2+ + r Mg2+ (гидрокарбонатный натриевый),
> r Ca2+ + r Mg2+ (гидрокарбонатный натриевый),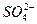 < r Ca2+ + r Mg2+ или r Сl- >r Na+
< r Ca2+ + r Mg2+ или r Сl- >r Na+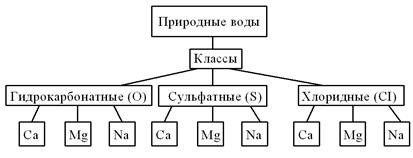
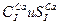 .
.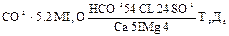 .
.


