Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Реакция оседания эритроцитов (РОЭ)Содержание книги
Поиск на нашем сайте
Казалось бы, что оседание эритроцитов легче всего объяснить разницей в удельном весе эритроцитов и жидкой части крови (средний удельный вес эритроцитов 1,100, а плазмы 1,030). Но эритроциты лошади оседают то быстро, то медленно, хотя различие в удельном весе остается прежним; в крови крупного рогатого скота осаждение происходит медленно, хотя разница в удельном весе эритроцитов и плазмы существует и у рогатого скота. Если удельный вес и играет некоторую роль в оседании эритроцитов, то существуют и другие факторы, которые оказывают на него влияние.
Рис. 168. Ретракция кровяного сгустка: I — норма; II — тромбопения.
Все эритроциты имеют одноименный электрический заряд, вследствие чего они отталкиваются друг от друга. Если этот заряд уменьшить или устранить, например, добавкой ОН-ионов в форме аммиака, то электростатическая сила их взаимного отталкивания исчезнет. Соответственно с этим увеличится и способность эритроцитов к оседанию. К силам, способствующим оседанию эритроцитов, принадлежит адсорбция на их поверхности альбуминов и глобулинов, вследствие чего эритроциты становятся тяжелее. Далее реакцию оседания эритроцитов ускоряют грубо-дисперсные (высокомолекулярные) глобулины. В плазме лошади имеется большое количество глобулинов, а в плазме рогатого скота больше альбуминов; у лошади РОЭ протекает быстро, в то время как у крупного рогатого скота она в тех же условиях почти не отмечается. РОЭ ускоряется при беременности из-за увеличения содержания глобулинов в крови и инфекционных заболеваниях ввиду наличия глобулиновых иммунных тел. На РОЭ сказывается изменение режима питания кроликов: у тех из них, которых кормят травой, РОЭ протекает значительно быстрее, чем у животных, получающих овес. Известное значение имеет количество находящегося в плазме фибриногена, который образует вязкий гель, оседая на эритроцитах. Соприкасаясь своими поверхностями, последние склеиваются в кучки, агглютинируются и падают на дно. С увеличением количества фибриногена скорость РОЭ соответственно увеличивается. Кроме того, на РОЭ оказывает влияние щелочной резерв крови, липоидно-холестериновый коэффициент и содержание различных солей. Уменьшение щелочного резерва замедляет ход РОЭ, повышение, напротив, ускоряет ее. Соли кальция и бария, а также холестерин действуют на РОЭ ускоряющим образом, а соли калия и натрия, как и лецитин, задерживают оседание.
Л. С. Пирогов и В. Г. Мухин основным фактором, определяющим быстроту оседания эритроцитов, считают количество красных кровяных телец: при его уменьшении оседание ускоряется, а при увеличении замедляется. В конечном итоге результат оседания зависит от суммарного влияния всех факторов, несмотря на преобладающее влияние какого-нибудь одного из них. Этим и объясняется, почему РОЭ иногда дает сходные изменения при совершенно различных патологических процессах. При учете реакции необходимо, кроме того, учитывать и внешние факторы, такие, как температура, концентрация раствора, чистота посуды и положение аппарата при определении РОЭ. Для определения реакции оседания эритроцитов наибольшее распространение в ветеринарной практике получили методы Неводова, Вестер-грена и Панченкова. Метод Неводова. Для постановки РОЭ необходим эритроседио-метр Неводова, представляющий собой снабженную резиновой пробкой градуированную пробирку объемом в 10 мл, шириной 9 мм и высотой 17 см. На эритроседиометре нанесены деления: 10 крупных и 100 мелких. Цифры от 2 до 14 на левой стороне указывают количество эритроцитов в миллионах, а цифры от 20 до 125 на правой стороне — процентное содержание гемоглобина. Учет производится после 24 часов отстаивания. В эритроседиометр предварительно насыпают 0,03 порошка щавелевокислого натрия, а затем набирают из яремной вены кровь до метки 0. После этого пробирку закрывают резиновой пробкой и 10—15 раз переворачивают для перемешивания крови и оксалата натрия (перемешивают осторожно, чтобы избежать появления пузырой).
Рис. 169. Реакция оседания эритроцитов в эритросе-диометре Неводова.
Пробирку ставят вертикально в штатив и через каждые 15 минут в течение часа отмечают уровень оседания эритроцитов. Затем выводятся средние данные за час. Метод Вестергрена. РОЭ определяют в аппарате Вестергрена, выпускаемом Госмедснабторгом с небольшими изменениями против оригинала. Аппарат состоит из деревянной рамы и четырех градуированных пипеток, одним концом вдавленных в каучук подставки, а другим прочно зафиксированным специальными клеммами на верхней раме. Длина пипетки 30 см, ширина 2,5 мм. На боковой стороне ее нанесены деления от 0 до 200 {иногда наоборот). Объем градуированной части пипетки составляет 1 мл.
В небольшой цилиндр предварительно наливают 1 мл 3,8% водного раствора лимоннокислого натрия. В раствор добавляют 4 мл крови, взятой из яремной вены. Кровь, тщательно перемешанную с цитратом (избегать вспенивания) встряхиванием или стеклянной палочкой, набирают до метки 0 в пипетку Вестергре- на. Последнюю обтирают и устанавливают в подставку, прочно фиксируя между клеммой и основанием подставки.
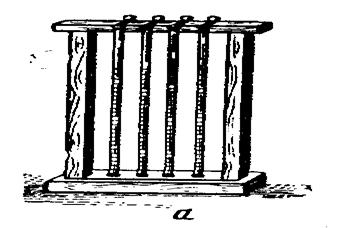
Рис. 170. Аппараты для определения РОЭ Панченкова (а) и Вестергрена (б).
Аппарат заряжают при горизонтальном положении пипетки с целью избежать преждевременного оседания эритроцитов, быстро переводят в вертикальное положение и сейчас же приступают к наблюдению за оседанием, заметив время. Столбик крови постепенно разделяется на две части: верхнюю—плазма и нижнюю — эритроциты. Оседание эритроцитов учитывают через 15, 30, 45, 60 минут, через 2 часа и последний раз через 24 часа. РОЭ у лошади составляет 75—145 мм за час, у крупного и мелкого рогатого скота — 1—3 мм. Метод Панченкова. Определение РОЭ по этому методу производится у мелких животных и с небольшим количеством крови. Специальные аппараты Панченкова и Вестергрена отличаются только тем, что пипетки первого меньше по емкости и градуированы только на сто делений. В капилляр набирают 0,25 мл 5% раствора лимоннокислого натрия, который затем выдувается в маленькую фарфоровую чашечку или на часовое стекло. После этого до метки 100 капилляра насасывают кровь из уха; ее вносят в цитрат и обе жидкости осторожно перемешивают. После этого цит-ратную кровь набирают до метки К и ставят в штатив. Регистрация оседания эритроцитов производится через 15, 30, 45 и 60 минут. РОЭ (по Панченкову) составляет в норме за час (в миллиметрах): у лошади 40—70; у крупного рогатого скота 0,5—1,5; у свиньи 2—9; у собаки 2—6; у кошки 9; у кролика 1—2; у птиц 1,5—3. РОЭ ставят сразу после взятия крови и не позже чем через 2 часа. По данным В. Г. Мухина, по прошествии трех часов получаются значительные колебания РОЭ как в сторону ускорения, так и замедления. У животных РОЭ протекает неодинаково. У крупного рогатого скота и собак она идет медленно, причем основная масса эритроцитов оседает в промежутке между 2 и 24 часами. У однокопытных реакция заканчивается в основном в течение первого часа (между 15 и 45 минутами), и только 5—8% эритроцитов оседают за остальные 23 часа. У молодых животных РОЭ несколько более ускорена, чем у взрослых. При патологических процессах чаще приходится наблюдать ускорение РОЭ и реже замедление. Отражая изменение физико-химических свойств крови, РОЭ имеет большое практическое значение. Ускорение РОЭ отмечается при многих лихорадочных и инфекционных заболеваниях, особенно при инфекционной анемии лошадей и кровопятни-стой болезни. В ряде случаев при этих заболеваниях оседание полностью заканчивается в течение первых 15—30 минут. Резкое ускорение РОЭ при массовом обследовании лошадей дает возможность выделять подозрительных по заболеванию. С улучшением процесса реакция изменяется в сторону замедления, однако только при полном выздоровлении РОЭ возвращается к нормальным показателям.
РОЭ замедляется при механических илеусах и при энцефаломиелите лошадей (при этих заболеваниях РОЭ по своему характеру напоминает реакцию у крупного рогатого скота). Менее значительное замедление можно встретить при заболеваниях, связанных с желтухами и сгущением крови. РОЭ, кроме диагностических целей, пытаются использовать для выявления утомляемости лошади, ее пригодности к определенной работе. С этой целью сравнивают показатели РОЭ до и после работы. У мало тренированных лошадей реакция после работы значительно замедляется. Если животное постепенно втягивается в работу, показатели постепенно меняются и приближаются к средним показателям здоровой лошади. Возможность определения количества эритроцитов в 1 мм3 по показателям РОЭ, а также установления волюметрического индекса и индекса оседания повышает клиническое значение этого метода. В пробирке Неводова количество эритроцитов отсчитывают на шкале, на которой показаны цифры оседания эритроцитов (после 24 часов оседания). В пипетках Вестергрена показатель уровня столба эритроцитов после 24-часового стояния умножается, на коэффициент 0,21, в результате чего получают цифру, показывающую количество эритроцитов в 1 мм3. Эти данные могут быть использованы только как ориентировочные. Более точные показатели получаются при подсчете в счетных камерах. Волюметрический индекс представляет отношение столба эритроцитов к общей массе крови. У здоровых лошадей он равняется 1: 2, 1: 3. При анемиях отношения значительно расширяются. Индекс оседания определяется делением числа, указывающего высоту столба плазмы после 15 минут оседания, на величину высоты конечного столба после 24-часового оседания. У здоровых животных индекс оседапия не превышает 0,5, при анемиях он увеличивается до 0,8—0,9. Осмотическая резистентность эритроцитов Плазма крови содержит такую концентрацию минеральных солей, что силы осмотического давления в ней и внутреннее осмотическое давление в эритроцитах взаимно уравновешиваются. Растворы, имеющие осмотическое давление, равное внутреннему осмотическому давлению эритроцитов, называются изотоническими. В таких растворах эритроциты сохраняют свою форму и величину. В гипертонических растворах эритроциты отдают свою воду и сморщиваются, принимая форму тутовой ягоды. В гипотонических растворах происходит обратное явление: эритроциты набухают вследствие поступления в них воды и увеличиваются в объеме. Гемоглобин набухших эритроцитов выщелачивается, и клетка в конечном итоге распадается. В изотонических растворах подобных изменений но происходит, так как при них нет условий для интенсивных осмотических явлений. Изотонической средой для эритроцитов животных является 0,85—0,9% раствор поваренной соли.
Гипо- и гипертонические растворы оказывают различное влияние на эритроциты в зависимости от концентрации. Растворы, близкие по концентрации к изотоническим, сохраняют основную массу эритроцитов и действуют отрицательно только на отдельные, малоустойчивые клетки, вызывая частичный гемолиз. Чем меньше концентрация раствора, тем больше эритроцитов подвергается разрушению. В растворах низкой концентрации наступает полный гемолиз, и жидкость окрашивается в вишнево-красный цвет. Начальная стадия гемолиза наименее стойких эритроцитов характеризуется слабым розоватым окрашиванием жидкости и наличием большого осадка сохранившихся эритроцитов. Концентрация гипотонического раствора, обусловливающего начальную стадию гемолиза, обозначается как показатель минимальной рсзистсптности эритроцитов. Концентрация, вызывающая полный гемолиз с вишнеЕО-красным окрашиванием прозрачной жидкости при отсутствии осадка (сохраняются единичные, наиболее устойчивые эритроциты), определяет максимальную резистентность. Амплитуду между минимальной и максимальной резистентиоетъю эритроцитов принято называть шириной резистентности. Наглядное представление о резистентности эритроцитов в растворах различной концентрации дает следующая таблица (по В. П. Петропавловскому).
У здоровых лошадей минимальная резистентность колеблется в пределах от 0,54 до 0,66%, максимальная — между 0,4—0,48%; у крупного рогатого скота минимальная резистентность — в пределах 0,64—0,74%, а максимальная— между 0,42—0,46%. Наибольшая устойчивость эритроцитов отмечена у кроликов (минимальная 0,46—0,42% и максимальная 0,34—0,32%). Принято считать, что молодые эритроциты мало устойчивы осмотически и сильно устойчивы к гемолитическим ядам; старые, напротив, устойчивы осмотически и мало устойчивы к гемолитическим ядам (Н. М. Шустров и др.). Следовательно, определение максимальной и минимальной устойчивости эритроцитов позволяет клиницисту делать выводы о процессах регенерации крови. Чем больше в крови молодых эритроцитов, т. е. чем энергичнее функционируют кровотворные органы, тем ближе к изотонии сдвигается граница минимальной резистентности. Наоборот, недостаточная работа кроветворных органов вызывает постарение крови и отклонение резистентности в сторону убывающей гипотонии. Если нормальная концентрация раствора, например, равна 0,6%, то отклонение в сторону 0,7—0,8% будет указывать на понижение резистентности, а в сторону 0,4—0,3%, напротив,— на повышение резистентности. В основе всех методов, рекомендуемых для установления резистентности эритроцитов, положен принцип: менее стойкие эритроциты разрушаются в растворах, близких к изотоническим, а наиболее стойкие сохраняются в растворах малой концентрации, в которых большая часть эритроцитов разрушается.
Метод Лимбека и Рибьера. Для опытов используются растворы поваренной соли в концентрации от 0,3 до 0,9% с интервалами в 0,02%. Растворы в количестве 1 мл набирают в центрифужные пробирки; в каждую пробирку добавляют пипеткой от гемометра Сали 20 мм3 крови. Перемешав жидкость и выждав 10—15 минут, пробирку устанавливают в центрифугу и через 5 минут учитывают результат. В пробирках, где произошел частичный гемолиз, жидкость окрашена в слабо-розовый цвет, и на дне их имеется значительный осадок. В пробирке с полным гемолизом жидкость окрашивается в вишнево-красный цвет и становится прозрачной. Легкое желтоватое окрашивание расценивается как показатель начала гемолиза, а слабое покраснение указывает на начало выраженного гемолиза. Метод Гамбургера. Для определения резистентности эритроцитов применяют сернокислый натрий в концентрации от 0,3 до 0,9%, с интерналами в 0,02%. Гемолиз наступает несколько позднее, чем в растворах поваренной соли, которая травмирует оболочку эритроцитов. Пробирки должны быть с притертыми пробками. С раствором их выдерживают при температуре 14°, а затем центрифугируют. Оценка результатов такая же, как и по методу Лимбека. Метод Яновского. Разрушенные и сохранившиеся эритроциты учитываются в счетной камере. Кровь набирают в смесители для подсчета эритроцитов и разводят растворами поваренной соли различной концентрации. К подсчету приступают спустя 10 минут после заполнения смесителей. Зиммель предложил для опытов раствор из 8,2 хлористого натрия, 0,2 хлористого калия, 0,2 хлористого магния, 0,2 хлористого кальция, 0,1 фосфорнокислого натрия, 0,05 углекислого натрия на 1 л воды. Этот раствор принимается за основной; из него готовят дальнейшие разведения—0,7%; 0,6%; 0,5%; 0,4%; 0,3%. Эти разведения и употребляют для определения резистентности эритроцитов. Подсчет сохранившихся эритроцитов Зиммель дополнил суправиталь-ным их окрашиванием с целью выявления молодых форм, содержащих гра-нулофиламентозную субстанцию. Это позволяет решать вопрос о том, какие эритроциты являются наиболее стойкими — старые или молодые. Для супра-витального окрашивания 1% раствор бриллианткрезильблау наносится на покровное стекло. Вначале определяют количество эритроцитов в основном растворе, а затем последовательно в растворах убывающей концентрации — 0,7%; 0,6%; 0,5%; 0,4%; 0,3%; одновременно учитывают содержание молодых эритроцитов. Техника заполнения смесителей и камеры, а также подсчета — обычная. Отличие заключается только в окрашивании покровного стекла перед наложением его на счетную камеру бриллианткрезильблау и учет молодых эритроцитов (табл. на стр. 325). Определение резистентности эритроцитов позволяет также судить при пробных испытаниях лошадей о степени их тренировки и способности выдерживать определенную нагрузку. У нетренированных лошадей максимальная резистонтность высока, у хорошо подготовленных она значительно ниже. Снижение резистентности в процессе подготовки лошади может служить критерием втягивания лошади в работу.
Резистентность эритроцитов у здоровых животных
|
|||||||||
|
Последнее изменение этой страницы: 2017-02-10; просмотров: 279; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.7.18 (0.015 с.) |