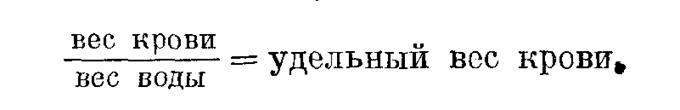Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Значение гемодиализа и история развития гематологииСодержание книги
Поиск на нашем сайте
Исследование крови сельскохозяйственных животных получило в последние годы широкое распространение. Интерес к нему определяется важной ролью, которую кровь выполняет в организме животного, и значением изменений, которые появляются в ней при патологических процессах. Если изменения крови в той или иной степени сказываются на состоянии органов и тканей, которые она питает, то и состояние этих органов отражается на циркулирующей крови, ее физико-химических и морфологических показателях. Тонкие изменения, происходящие в организме при заболеваниях, нередко совершенно ускользают от внимания клинициста. Исследования крови помогают своевременно выявить скрыто протекающие процессы и возникающие осложнения, дифференцировать сходные заболевания заразного и незаразного характера, судить о состоянии организма и функциональной способности отдельных органов, следить за эффективностью применяемого лечения и делать соответствующее предсказание. По количественным и качественным показателям крови в сочетании с клиническими данными представляется возможным ставить диагноз на анемии различного происхождения, лейкозы и кровопаразитарные заболевания. Показатели крови могут быть использованы также для изучения интерьера животных. Естественно, что каждая из перечисленных задач должна решаться самостоятельным методом. Механический подход к расшифровке полученных данных может привести к неправильным выводам. В одних случаях применяется физико-химический анализ крови, в других — морфологический, в третьих — исследование на наличие кровопаразитов, а иногда приходится комбинировать все эти методы и производить «полный» гематологический анализ. Для научных работ, кроме того, используются методики эксперимента и тканевых культур. В клинической практике чаще сочетают физико-химический анализ с морфологическим определением клеточного состава крови. Само собой разумеется, что для правильного толкования результатов исследования крови врачам и лаборантам необходимы практический опыт, соответствующая материальная база и теоретическая подготовка в области гематологии. Еще лет 25—30 назад ветеринарные специалисты делали лишь робкие попытки заниматься гематологическими анализами. Не имея соответствующего оборудования и научных работ, на которые можно бы было опереться в своих исследованиях, они употребляли иностранную аппаратуру, химикалии и руководствовались данными зарубежных авторов по показателям крови. В настоящее время положение изменилось коренным образом. Отечественная промышленность изготовляет аппаратуру, краски и химикалии в достаточном количестве и удовлетворительного качества. Советскими учеными разработаны гематологические показатели для всех видев животных с учетом физиологических колебаний (порода, пол, возраст, состояние беременности, физическая нагрузка, прием корма). Имеются твердо установленные данные по общему количеству крови и ее рН, резервной щелочности, количеству эритроцитов, гемоглобину, цветному показателю, РОЭ, насыщенности эритроцитов в 10~12, их размеру и резистентности, количеству лейкоцитов и тромбоцитов. Для всех животных выведены гемограммы, лейкоцитарный профиль по принципу Мошковского и сетка для гематологического профиля по Г. В. Домрачеву. Для лошади, крупного рогатого скота, овцы, свиньи и некоторых других животных разработаны миелограммы.
Установлено нормальное содержание в крови основных видов животных кальция, калия, натрия, магния, хлора, неорганического фосфора, а также сахара в крови и билирубина в сыворотке с учетом крайних физиологических колебаний. Собран значительный материал по вопросу изменений картины крови при ряде инфекционных и неинфекционных заболеваний.
СХЕМА ГЕМОАНАЛИЗОВ И ПОКАЗАНИЯ ДЛЯ КЛИНИЧЕСКОГО ИССЛЕДОВАНИЯ КРОВИ Полное исследование крови включает определение ее физико-химических свойств — цвета, скорости свертывания, ретракции кровяного сгустка, вязкости, удельного веса, скорости оседания, рН, щелочного резерва, гемоглобина, билирубина, индикана, остаточного азота, солей, ферментов, витаминов; оно охватывает количественный учет форменных элементов (эритроцитов, лейкоцитов и тромбоцитов) с установлением качественных изменений регенеративного. и дегенеративного характера со стороны протоплазмы и ядра эритроцитов и лейкоцитов и наличия особых клеточных форм, которые появляются в циркулирующей крови при некоторых патологических процессах.
В клинической практике обычно ограничиваются неполным анализом крови, заключающимся в подсчете количества эритроцитов и лейкоцитов, определении содержания гемоглобина, выведении лейкоцитарной формулы и постановке РОЭ. Более сложные методики гематологических исследований выполняются исключительно по специальным показаниям. Основанием для гематологического исследования и выбора методики служат клинические симптомы, заставляющие предполагать то или иное заболевание и подозревать изменения циркулирующей крови и кровотворных органов. В случаях выраженных анемических состояний, когда налицо беспричинное истощение животных, резкая бледность слизистых и конъюнктивы, а также отек кожи и подкожной клетчатки в связи с гидремией, кроме обычного гематологического исследования, требуется определить функциональную способность кроветворных органов. Для этой цели прибегают к суправитальному окрашиванию мазков циркулирующей крови или пунктатов костного мозга для учета эритроцитов с гранулофиламентоз-ной субстанцией. В обычных мазках выявляют количество ядерных эритроцитов и всех других форм, указывающих на регенерацию или дегенерацию красной крови. При малокровии или когда существует предположение о нарушении нормальной свертываемости крови, определяют количество тромбоцитов, состояние процесса свертывания крови и длительность кровотечения. Большое значение при анемиях имеет течение РОЭ, дающей представление о количестве эритроцитов, а также и об изменениях в соотношении белковых фракций крови и в электрическом заряде. Желтушное окрашивание различных оттенков и интенсивности, отмечаемое на слизистых и конъюнктиве, требует определения в сыворотке крови не только количества билирубина, но и характера реакции (прямая или непрямая) с целью выяснения формы желтухи. При желтухах, кроме того, целесообразно установить степень резистентности эритроцитов. Подозрение на кровопаразитарные заболевания (пироплазмоз, нуттал-лиоз, трипанозомоз) вызывает необходимость просмотра окрашенного мазка с целью обнаружения возбудителя болезни. Для подтверждения диагноза на заболевание печени имеет значение определение билирубина и сахара в сыворотке крови. У каждого животного, у которого предполагается недостаточность почек, устанавливают содержание остаточного азота, а если возможно, то и мочевины, мочевой кислоты, индикана. При минеральном голодании животных химическим анализом выявляют количество солей натрия, калия и кальция, иногда и хлора. В последнее время придается большое значение недостаточности микроэлементов (кобальт, йод, железо). На своевременном выявлении последней основываются рациональная терапия и профилактика минерального голодания у животных. Подозревая авитаминоз, целесообразно исследовать сыворотку крови на содержание витаминов. Так, установление дефицита аскорбиновой кислоты позволяет обнаружить гипо- или авитаминоз С. При заболеваниях инфекционного и неинфекционного происхождения, сопровождающихся нарушением обмена веществ, кислотно-щелочного равновесия, определяют щелочной резерв крови и количество в ней сахара, азотистых шлаков. Когда существуют выраженные системные поражения кроветворных органов — увеличение лимфатических узлов, селезенки и печени, а на слизистых оболочках рта обнаруживаются кровоизлияния, воспалительные, некротические и гангренозные поражения, кроме обычного анализа крови, целесообразно еще исследование кроветворных органов и подсчет в циркулирующей крови молодых форм лейкоцитов, а также атипичных клеток.
Выполняя гематологические исследования, необходимо соблюдать строгую педантичность и последовательность всех манипуляций. Кровь берут по возможности утром в одни и те же часы (до кормления и водопоя), после отдыха и успокоения животного, а у овец с развитым стадным инстинктом — в присутствии других животных этого вида.
СПОСОБЫ ПОЛУЧЕНИЯ КРОВИ
Небольшое количество крови можно получить у животных из мелких кровеносных сосудов внутренней поверхности ушной раковины, а также из краевой вены наружной поверхности, у кур — из гребня или сережек, у уток и гусей — из мякоти ступни ног. Более значительное количество крови для реакции оседания эритроцитов и химического анализа лучше всего брать у лошадей, крупного рогатого скота, коз и овец из яремной вены, у свиней — из крупных сосудов уха или хвоста, кончик которого надрезается, у хищных — из сосудов грудной или тазовой конечности, а у кур — из внутренней поверхности плечевой вены крыла. Волосяной покров на месте взятия крови коротко выстригают или выбривают. Затем кожу протирают спиртом, а потом эфиром. Эфир высушивает кожу и вызывает реактивное расширение сосудов после их первоначального сужения. Если кожа грязная, ее вначале моют теплой водой с мылом, а затем хорошо просушивают ватой и обезжиривают эфиром. Для изъятия малого количества крови из кровеносных сосудов лучше всего пользоваться оспопрививательным пером. У птиц кровь из гребня берут иглой Франка или тем же пером. При уколе в кровеносный сосуд ушную раковину с противоположной стороны поддерживают пальцем, с целью создания твердой опоры. Между пальцем и ухом кладут небольшой ватный шарик, чтобы предотвратить поранение пальцев. Кровеносный сосуд пересекают иглой поперек; при продольном проколе стенки сосуда быстро соединяются и кровь не выступает в ранку. Укол делают умеренной глубины, с расчетом не проколоть противоположную (вторую) стенку сосуда. Если ранка небольшая, кровь выделяется самопроизвольно небольшими каплями. Большие капли или вытекание крови струйкой нежелательны, особенно при приготовлении мазков. Первые капли для гематологического исследования непригодны — их удаляют ватным тампоном.
Из крупных кровеносных сосудов всех животных кровь получают обычно инъекционной иглой. При проколе вены последнюю сдавливают ниже места укола рукой или резиновым жгутом. Кровеносный сосуд и окружающие его ткани прокалывают в один прием. Инструментарий для взятия крови и цилиндры предварительно стерилизуют. Для бактериологических исследований кровь насасывают стерильным шприцем и выливают затем в закрытый цилиндр через резиновую трубку или специальную иглу, которой прокалывают пергаментную бумагу, закрывающую цилиндр. Так поступают для предотвращения засорения крови микроорганизмами из воздуха, с шерсти и рук.
Рис. 162. Иглы для взятия крови.
Чтобы получить плазму, в пробу крови добавляют лимоннокислый или щавелевокислый натрий (на 1 мл— 0,002). После отстаивания или центрифугирования форменные элементы крови оседают на дно, а плазму отсасывают пипеткой. Получение сыворотки крови отличается в принципе только тем, что в пробу не добавляют цитрата. После хранения при комнатной температуре кровь свертывается, и через некоторое время отсасывают сыворотку, отделившуюся от кровяного сгустка. Сыворотку можно получить также, дефибринируя кровь встряхиванием сосуда, в котором находятся стеклянные бусинки. При инфекционных и протозойных заболеваниях кровь берут во время повышения температуры у животных. Если кровь получают многократно из ушной раковины, необходимо поочередно менять уши или место укола, сначала делая его у кончика уха, а затем каждый раз ближе к основанию. Этим устраняется влияние местной реакции на показатели крови. Принудительной фиксации при изъятии крови лучше всего избегать; если же в ней встречается необходимость, то укрепление животных в нужном положении осуществляют одним и тем же способом, чтобы устранить влияние неодинаковых раздражителей не только на количественные показатели, но даже и на формулу крови.
Удельный вес крови определяют методами Гаммершляга и Шмальца. Более точзн пикнометрический метод Шмальца. Тонкую стеклянную трубочку с вытянутыми концами емкостью 0,2 мл тщательно промывают дистиллированной водой, а затем высушивают спиртом и эфиром и взвешивают на химических весах с точностью до ОД мг. Трубочку наполняют дистиллированной водой, обсушивают снаружи и вновь взвешивают при температуре 15°. После этого воду выдувают баллоном, трубочку высушивают, наполняют кровью и снова взвешивают. Делением веса крови на вес дистиллированной воды получают удельный вес испытуемой крови
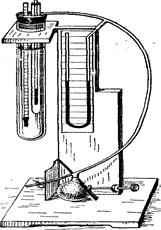
Для определения удельного веса крови по методу Гамме р-шляга необходимо иметь ареометр, цилиндр, бензол или толуол удельного веса 0,88 и хлороформ удельного веса 1,483. В цилиндр наливают смесь 50 частей бензола и 20 частей хлороформа. В эту смесь, удельный вес которой равняется приблизительно 1,050—1,060, быстро вносят каплю испытуемой крови по возможности осторожнее, чтобы на ней и вокруг нее не было пузырьков воздуха.
Рис. 163. Определение удельного веса крови.
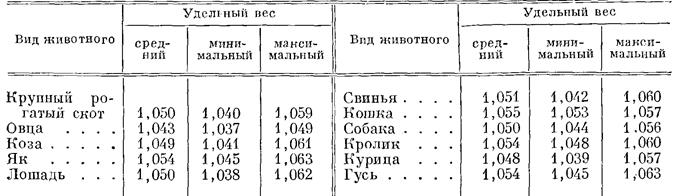
При одинаковом удельном весе крови и смеси бензола с хлороформом капля занимает в цилиндре срединное положение. Если капля всплывает, то добавляют жидкость низкого удельного веса (бензол), а если тонет, то, наоборот, — высокого удельного веса (хлороформ). После добавления той или иной жидкости смесь осторожно перемешивают стеклянной палочкой. Как только капля крови принимает срединное положение, удельный вес жидкости определяется ареометром. Исследование выполняют быстро, так как при медленной работе удельный вес крови изменяется вследствие процессов диффузии. Использованную смесь фильтруют и хранят в склянке с притертой пробкой для новых исследований. По В. Г. Мухину, бензол могут заменить бензин или керосин. Удельный вес обычного (желтого) бензина равен 0,757, очищенного бензина—0,750, мутного керосина—0,834, чистого керосина — 0,824. На 20 частей хлороформа берут 30 частей бензина или 40 частей керосина. Техника определения такая же, как и с бензолом. Удельный вес крови здоровых животных колеблется в следующих пределах (по разным авторам), что зависит от концентрации в плазме солей, сахара, эритроцитов, гемоглобина и отчасти белков.
Повышение удельного веса крови отмечается при ее сгущении и связано с потерей организмом воды при поносе, чрезмерном потении, лихорадках и механической работе. При воспалении почек повышение удельного веса крови может быть вызвано задержкой в ней плотных составных частей. Понижение удельного7веса крови чаще всего обусловливается анемиями и гидремическим состоянием при кахексии. Удельный вес крови поддерживается на определенном уровне регулирующими мехаршзмами водного и минерального обмена; на него оказывает влияние состояние почек, кожи и легких. Определение скорости свертывания крови производят следующими наиболее распространенными способами: а) Ситковского — Егорова; б) Фирор-да — в капилляре и в) Бюркера — на стекле. Способ Ситковского — Егорова. Скорость свертывания по этому методу определяют в аппарате Ситковского. Кровь набирают в капиллярную трубку до метки (3 см) и затем выливают в пробирку (воздушная баня), которая сообщается посредством резиновой трубки с баллоном, служащим для изменения воздушного давления, регистрируемого манометром. Верхний конец пробирки закрывают резиновой пробкой, через которую проходит верхний конец капилляра. Пробирку погружают в широкий стеклянный сосуд с водой через отверстие в закрывающей его пробке. Вода в сосуде должна иметь температуру тела исследуемого животного. Температура воды поддерживается и регулируется спиртовой горелкой. Баллон сжимается винтом, повороты которого то опускают, то поднимают столбик крови, причем размах его колебаний не превышает 1 см. Пока кровь не свертывается, капилляр остается чистым; первые сгустки на его стенках указывают на начало процесса свертывания. Постепенно сила сцепления в крови увеличивается, столбик начинает двигаться медленнее и, наконец, совершенно останавливается. Исследование заканчивают, когда столбик не сдвигается с места давлением воздуха в 60 мм ртутного столба. Этот момент отмечают как конец свертывания. Скорость свертывания крови, выпущенной из кровеносного сосуда, зависит от ряда факторов, которые приходится учитывать при определении; к ним относятся: температура окружающей среды, способ получения крови, соприкосновение крови с краями раны и др. Способ Фирорда. В капилляр длиной 5 см и диаметром 1 мм набирают 1 мл крови. Затем через кровь начинают протягивать хорошо обезжиренный белый волос длиной 10—15 см, продвигая его на 0,5 см вперед через каждые 30 секунд.
Рис. 164. Аппарат Ситковского—Егорова.
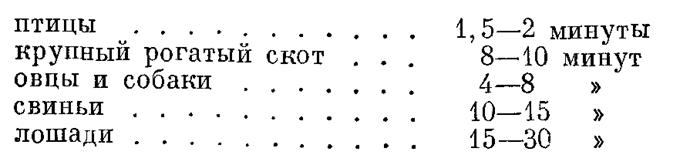
Начало свертывания узнается по красноватому окрашиванию волоса сгустками крови. Усиление свертывания характеризуется возрастанием интенсивности окрашивания. Полное свертывание отмечается в момент, когда волос совершенно перестает окрашиваться. Способ Бюркера. В углубление стекла помещают каплю крови и по ней через определенные отрезки времени проводят острием стеклянной палочки. Показателем свертывания служит появление на острие нитей фибрина. Этот метод может быть модифицирован следующим образом. На край тщательно очищенного и обезжиренного предметного стекла, поставленного под углом в 50°, наносят каплю испытуемой крови. Стекая по наклоненному стеклу, капля оставляет след. Через каждые 30 секунд по следу крови проводят острием булавки. Появление нитей фибрина на острие указывает на начало свертывания. По В. Г. Мухину, скорость свертывания крови, определенная этим способом, в норме равна: у крупного рогатого скота 5—6 минутам, у лошади 8—10 минутам и у собаки 10 минутам.
Определение скорости свертывания крови различными методами дает неодинаковые показания. В практике следует применять какую-либо одну методику, со ссылкой в протоколах на способ исследования. Приводимые ниже цифры дают представление о скорости свертывания крови различных животных в стеклянном сосуде при комнатной температуре (по Мареку):
Резкое замедление свертываемости крови у животных отмечается при пятнистом тифе, болезнях из группы геморрагического диатеза, анемиях различного происхождения, нефритах. Быстрое свертывание крови наблюдается при миогемоглобинурии и крупозном воспалении легких. Вязкость крови. Под вязкостью понимают внутреннее трение жидкости, которое отражается на скорости прохождения ее по капиллярной трубке при определенных температуре и давлении. В основе определения вязкости лежит закон, по которому скорость течения жидкости обратно пропорциональна ее вязкости. Вязкость крови зависит от ее газового состава (СО2), содержания гемоглобина, количества и особенно объема эритроцитов, а также от вязкости кровяной плазмы и колебания в ней количества белых кровяных телец. Наличие объемистых миелоидных клеток повышает вязкость крови.
Рис. 165. Вискозиметр Детермана.
Рис. 166. Вискозиметр Гесса.
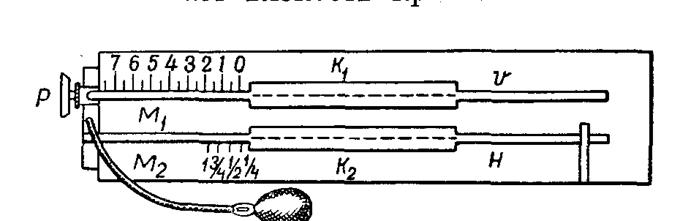
Вязкость крови определяется методами Детермана и Гесса соответствующими вискозиметрами этих авторов. Метод Детермана. В стеклянную муфту аппарата наливают теплую воду (20°). В капилляр, на котором написано «вода», до метки 0 насасывается дистиллированная вода, а в другой капилляр с пометкой «кровь» до 0 набирается испытуемая цельная кровь или сыворотка. Зарядив капилляры, вискозиметру немедленно (для предотвращения свертывания крови) придают вертикальное положение, и в момент, когда кровь стечет до единицы, аппарат снова переводят в горизонтальное положение. Вязкость крови определяется по разнице в скорости прохождения по капиллярной трубке крови и дистиллированной воды, вязкость которой условно принимается за единицу. Если кровь опустилась до единицы, а вода до 4,5 деления, то это значит, что вязкость крови в 4,5 раза больше вязкости воды. Метод Гесса. Исследование выполняется в том же порядке, но с использованием другого аппарата, (рис. 166). В вискозиметре Гесса кровь и вода насасываются через совершенно одинаковые, очень тонкие капилляры К 2 и К1. Более широкие капилляры М2
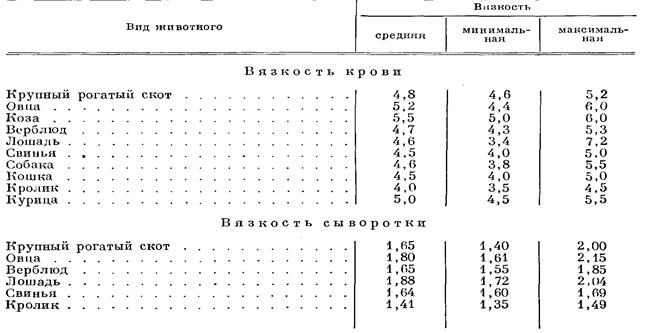
и М1 служат для измерения объемов воды и крови, прошедших через капилляры Кг и К1; шкалы указывают объемы в единицах для данного прибора. Капилляр М1 имеет деления от 0 до 8 с подразделением на десятые доли, капилляр М2 — только деления 0, 1/4, 1/2 и 1. Капилляр V является продолжением капилляра М1 и К1, а капилляр Н представляет отдельную трубку, которая присоединяется к капилляру К2 и удерживается пружиной. Баллон со стеклянной частью, имеющей отверстие, играет роль клапана. В системе, соединяющей баллон с капиллярами, кран Р позволяет включить и выключить обе группы капилляров. Техника исследования. К свободному краю капилляра V приближают пипетку с дистиллированной водой и, производя насасывание баллоном при открытом кране Р, разобщают систему капилляров. Затем трубку Н приводят в соприкосновение с каплей крови, которая вследствие волосности быстро заполняет ее просвет. Придав трубке вертикальное положение, чтобы кровь заполнила воронкообразное ее расширение, надевают ее на капилляр K.2. Установив таким образом трубку Н, приводят в действие баллон, продвигая кровь через капилляр К2 до метки 0 капилляра М2. Зарядив аппарат, открывают кран Р, благодаря чему соединяются обе капиллярные системы, и при помощи баллона одновременно присасывают обе жидкости. Как только кровь дойдет до метки 1 капилляра М2, а при высокой вязкости до 1/2 и даже 1/4 приостанавливают насасывание, закрывая кран Р, и устанавливают деление, на котором остановилась вода. Это деление и указывает вязкость крови. Если кровь доведена только до половины или четверти, то показания шкалы М1 умножают на 2 или 4. По окончании определения кровь сейчас же, чтобы не дать свернуться, удаляют из капилляра. Для этого при закрытом капилляре Р кровь вытесняют баллоном на пропускную бумагу, а затем капилляры К2 и М2 наполняют концентрированным раствором аммиака. Вязкость крови и сыворотки здоровых животных колеблется в следующих пределах (по данным различных авторов).
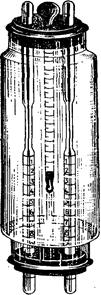
Вязкость крови, кроме того, можно определить сталагмометром — трубочкой с ампулообразным расширением и делениями, находящимися ниже и выше его. Кровь набирают до верхней черты, после чего сталагмометр ставят отвесно и в секундах отмечают время истечения крови до нижней черты. Параллельно ставят опыт с дистиллированной водой. Показатель времени истечения крови делят на показатель времени истечения воды, полученное частное является показателем вязкости крови. Установленная при помощи сталагмометра вязкость цельной крови у здоровых лошадей равна 3,80; вязкость дефибринированной крови — 2,89; вязкость плазмы — 1,92; вязкость сыворотки — 1,65—1,90; вязкость сыворотки крупного рогатого скота — 1,75 (А. П. Неводов). Вязкость крови повышается при лихорадочных заболеваниях — плеврите, воспалении легких, перитоните и при недостаточности сердца в период декомпенсации. Понижение вязкости обнаруживают при первичных и вторичных анемиях, а также при резкой кахексии.
Рис. 167. Сталагмометры.
Ретракция кровяного сгустка
Под ретракцией понимается самопроизвольное отделение сыворотки от кровяного сгустка при отстаивании. Кровь набирают в сухую и обезжиренную спиртом иэфиром уленгутовскую пробирку и отстаивают при комнатной температуре в течение суток. При исследовании необходимо придерживаться единой методики, так как результат во многом зависит от диаметра пробирки, ее положения и свойств стеклянной стенки. У лошади частичная ретракция кровяного сгустка наступает через 1—3 часа, а полное отделение через 12—18 часов. Индекс ретракции у здоровой лошади в среднем равняется 0,5 (0,3—0,7). У крупного рогатого скота ретракция протекает очень слабо и нередко отсутствует совершенно, у других животных она почти не изучена. Ослабление ретракции объясняют уменьшением в крови количества тромбоцитов и изменением концентрации солей. Уменьшение ретракции с индексом 0,3; 0,2 и 0,1 отмечается при многих лихорадочных процессах, а полное отсутствие ее— при эксудативном плеврите, контагиозной плевропневмонии, кровопятнистой болезни и инфекционной анемии лошадей. Особенно большое значение имеет изменение ретракции при стахиботриотоксикозе. При этой болезни в первое время происходит постепенное кровяного ослабление ретракции, которое заканчивается полной потерей способности кровяного сгустка отделять сыворотку— ирретрактильностью; другие изменения — тромбопения, лейкопения и изменение лейкоцитарной формулы присоединяются несколько позднее. Резкое падение ретракции и особенно ир-ретрактильность кровяного сгустка при кишечной форме стахиботриоток-сикоза указывают на переход заболевания в септическое страдание.
|
|||||||||
|
Последнее изменение этой страницы: 2017-02-10; просмотров: 266; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.190.239.189 (0.019 с.) |