
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Второе начало термодинамики. Цикл КарноСодержание книги
Похожие статьи вашей тематики
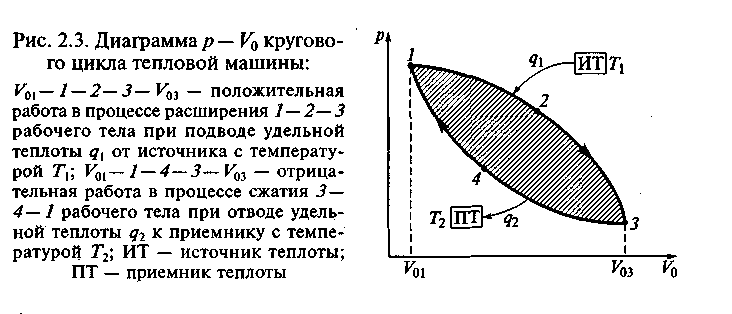
Поиск на нашем сайте С открытием первого закона термодинамики было осознано значение энергии в материальном мире и доказано, что все виды энергии в конечном счете превращаются в теплоту, которая затем рассеивается в окружающей среде. Мера этого рассеивания была названа энтропией. Чем больше рассеивается (обесценивается) энергия, тем с большей интенсивностью возрастает энтропия в системе. Было установлено, что энергия и энтропия являются неотъемлемыми свойствами материи, причем энергию стали признавать мерой движения материи, а энтропию — мерой ее рассеивания (деградации). Однако только с изучения возможности использования теплоты для совершения работы и начинается практическая термодинамика. Действительно, первый закон термодинамики, констатируя непреложность принципа сохранения количества энергии при ее превращениях, в то же время не дает ответа на главные вопросы практической теплотехники, а именно: при каких условиях, по каким направлениям и какая часть подводимой к рабочему телу теплоты может превращаться в работу? Ответы на эти вопросы, составляющие сущность теплотехники, были получены гениальным французским инженером С. Карно еще до открытия первого закона термодинамики. Так, С. Карно установил, что теплота может быть преобразована в механическую работу лишь тогда, когда имеется перепад температур, и величина этой работы зависит только от температур, при которых подводится и отводится теплота. Согласно этому положению, вошедшему в термодинамику как ее второе начало (второй закон), самопроизвольные процессы возможны лишь в том случае, когда в системе нет равновесия, причем эти процессы всегда протекают в направлении, при котором система приближается к равновесному состоянию. Второе начало термодинамики первоначально охватывало только процессы преобразования теплоты в работу и имело разные формулировки. Например, часто этот закон выражался таким образом: в круговом процессе располагаемая теплота не может быть полностью преобразована в работу. Смысл формулировки второго начала термодинамики, предложенной У.Томсоном, сводится к следующему: нельзя построить двигатель, все действие которого сводилось бы только к заимствованию теплоты из одного источника и совершению внешней работы. Такой двигатель называют вечным двигателем второго рода. Наиболее общая формулировка второго закона термодинамики принадлежит Ф. Клаузиусу, согласовавшему положение, высказанное С. Карно, с первым законом термодинамики в следующей форме: «Теплота не может самопроизвольно (без компенсации) переходить от менее нагретого тела к более нагретому». Под компенсацией понимают необходимость совершения некоего дополнительного процесса, уяснение смысла которого в технической термодинамике осуществляется на весьма абстрактных моделях равновесных и обратимых процессов. Как было отмечено ранее, равновесный процесс, представляемый непрерывным рядом бесконечно близких состояний, можно изобразить линиями на термодинамических диаграммах, например, Наиболее совершенными процессами с точки зрения преобразования теплоты в работу являются обратимые круговые процессы — циклы (рис. 2.3) [16]. Так как при их осуществлении отсутствуют явления трения и теплообмена рабочего тела с окружающей средой, оно перемещается с бесконечно малыми приращениями скорости и в конце процесса принимает свое начальное состояние. Следовательно, в таких процессах удельная теплота
1Все реальные термодинамические процессы протекают при конечной разности давлений и температур рабочего тела и окружающей среды. Следовательно, реальные процессы всегда неравновесные. Однако техническая термодинамика оперирует равновесными процессами, так как в противном случае потребовалось бы существенно усложнить аппарат моделирования посредством введения зависимостей параметров состояния от времени.
Наиболее совершенным круговым процессом является обратимый круговой процесс, или цикл, Карно, при осуществлении которого может быть достигнут максимальный термический КПД по сравнению с таковым для всех других процессов, происходящих при тех же температурах Анализируя формулу (2.13), отметим, что Такой цикл и был предложен С. Карно. Он состоит из двух обратимых изотермических и двух обратимых адиабатных процессов (рис. 2.4). Изотермический и адиабатный процессы наиболее предпочтительны с точки зрения получения максимальной работы, поскольку при изотермическом процессе вся теплота, подводимая к рабочему телу, превращается в работу, а адиабатный процесс протекает без теплообмена. Рассмотрим все процессы цикла Карно. Процесс 1 — 2 — изотермическое расширение рабочего тела при подводе удельной теплоты
В процессе адиабатного сжатия 4—1 газ нагревается до температуры
Если в процессе 3—4 сжимать газ, не охлаждая его (без отвода удельной теплоты
Рис. 2.4. Диаграммы цикла Карно в координатах р — V0 (а) и T—s (б): 1—2 — изотермическое расширение; 2—3 — адиабатное расширение; 3—4 — изотермическое сжатие; 4— 1 — адиабатное сжатие; провести лишь одну адиабату. Тогда в результате такого сжатия процесс пойдет не по изотерме 3—4, а по адиабате 3—2. В исходное состояние рабочее тело должно быть возвращено лишь по изотерме, так как при изотермическом процессе на сжатие затрачивается наименьшее количество работы. В итоге для сжатия в процессах 3—4 и 4—1 потребуется то же количество работы, которое было получено в процессах расширения 1 — 2 и 2—3. Полезная работа цикла Полезная работа
Из полученной формулы видно, что работы в адиабатных процессах 2— 3 и 4— 1 взаимно уничтожаются. Тогда формула (2.14) примет вид
КПД любого цикла тепловой машины (в том числе цикла Карно) определяется по формуле
Для адиабат 2—3 и 4— 1 справедливы следующие соотношения:
|
||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 602; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.43.244 (0.011 с.) |

 Понятие обратимости процессов связывают с бесконечно малым изменением параметров состояния термодинамической системы1.
Понятие обратимости процессов связывают с бесконечно малым изменением параметров состояния термодинамической системы1. воспринимаемая рабочим телом в результате ее подвода от источника и отвода к приемнику, не расходуется на приращение внутренней энергии рабочего тела и его перемещение, а полностью преобразуется во внешнюю работу / (заштрихованная часть диаграммы). В то же время среди обратимых круговых процессов наиболее совершенным будет тот, который имеет наибольший термический КПД:
воспринимаемая рабочим телом в результате ее подвода от источника и отвода к приемнику, не расходуется на приращение внутренней энергии рабочего тела и его перемещение, а полностью преобразуется во внешнюю работу / (заштрихованная часть диаграммы). В то же время среди обратимых круговых процессов наиболее совершенным будет тот, который имеет наибольший термический КПД:
 Рассмотрим этот классический процесс более детально.
Рассмотрим этот классический процесс более детально. возрастает при уменьшении
возрастает при уменьшении  и увеличении
и увеличении  Это означает, что, выбирая соответствующим образом процессы расширения и сжатия, протекающие с подводом и отводом удельной теплоты
Это означает, что, выбирая соответствующим образом процессы расширения и сжатия, протекающие с подводом и отводом удельной теплоты  можно изменять значение термического КПД. В связи с этим возникает вопрос: можно ли найти такой цикл, который обладал бы наибольшим КПД?
можно изменять значение термического КПД. В связи с этим возникает вопрос: можно ли найти такой цикл, который обладал бы наибольшим КПД? от источника с температурой
от источника с температурой  Количество удельной теплоты
Количество удельной теплоты  равное работе /,, произведенной в процессе 1 — 2, определяется по формуле
равное работе /,, произведенной в процессе 1 — 2, определяется по формуле

 Работа, затрачиваемая на сжатие, численно равна площади фигуры
Работа, затрачиваемая на сжатие, численно равна площади фигуры  и определяется по формуле
и определяется по формуле
 ), то этот процесс будет адиабатным. Ввиду того что адиабаты являются эквидистантными кривыми (не пересекаются между собой), то через одну точку (точка 3) можно провести лишь одну адиабату. Тогда в результате такого
), то этот процесс будет адиабатным. Ввиду того что адиабаты являются эквидистантными кривыми (не пересекаются между собой), то через одну точку (точка 3) можно провести лишь одну адиабату. Тогда в результате такого
 — количество подводимой удельной теплоты; д2 — количество отводимой удельной теплоты; ИТ — источник теплоты; ПТ — приемник теплоты
— количество подводимой удельной теплоты; д2 — количество отводимой удельной теплоты; ИТ — источник теплоты; ПТ — приемник теплоты будут равны нулю. Отсюда можно сделать следующий вывод: для того чтобы получить полезную работу, необходимо какую-то часть подведенной теплоты безвозмездно отдать в окружающую среду, т. е. потерять.
будут равны нулю. Отсюда можно сделать следующий вывод: для того чтобы получить полезную работу, необходимо какую-то часть подведенной теплоты безвозмездно отдать в окружающую среду, т. е. потерять. цикла 1—2—3— 4 определяется алгебраической суммой работ, полученных или затраченных в отдельных процессах цикла:
цикла 1—2—3— 4 определяется алгебраической суммой работ, полученных или затраченных в отдельных процессах цикла: (2.14)
(2.14)
 Отсюда
Отсюда (2.15)
(2.15)



