
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Выведение через печень с желчьюСодержание книги
Поиск на нашем сайте
Таким путем выводятся главным образом конъюгаты лекарственных веществ с глюкуроновой кислотой (например, глюкурониды опиоидного анальгетика морфина, антибиотика хлорамфеникола, эстрогенов комбинированных оральных контрацептивов). При этом следует учитывать, что, попав в просвет 12-перстной кишки, глюкурониды могут подвергаться гидролизу с высвобождением активных веществ, которые могут всасываться обратно в кровоток, что задерживает их выведение и приводит к циркуляции лекарства в организме. Выведение лекарств через легкие Принципиальное значение имеет лишь для выведения из организма летучих жидкостей и газов, применяемых в анестезиологии. Другие пути выведения Отдельные лекарственные средства могут выделяться с секретами экзокринных желез, например, слюнных желез (йодиды), потовых (бромиды), слезными железами (рифампицин), а также экскретироваться во время лактации, молочными железами. Экскреция такими путями не оказывает существенного влияния на скорость выведения лекарств из организма. Однако, возможность такого выведения лекарственных веществ следует учитывать, например, для предотвращения их нежелательного действия. Так, во время грудного вскармливания, женщинам не следует назначать контрацептивные средства, андрогенные гормоны, снотворные и анксиолитические средства, опиоидные анальгетики, многие противовоспалительные средства, в том числе, аспирин, ряд антибиотиков, противовирусных средств, принимать алкоголь. Выделяясь с молоком, они могут попадать в организм ребенка и приводить к развитию нежелательных эффектов.
Элиминирование лекарств. Клиренс как интегральный показатель элиминирования. Понятие о периоде полувыведения Под элиминированием следует понимать совокупность всех процессов метаболизма и выведения, которые приводят к снижению содержания активной формы лекарственного вещества в организме и его концентрации в плазме крови. Два основных органа, в которых осуществляется элиминация лекарств – это почки и печень. В почках элиминация осуществляется главным образом путем экскреции. В печени элиминация лекарств осуществляется путем биотрансформации исходного вещества в один или несколько метаболитов и путем экскреции неизмененного вещества с желчью.
К другим органам, элиминирующим лекарства, относятся легкие, кровь, мышцы и любые другие органы, где вещества подвергаются метаболизму или могут выводится. Мерой способности организма элиминировать лекарство является клиренс. В простейшем случае клиренс лекарства (Cl) – это отношение скорости элиминации лекарства всеми возможными путями к его концентрации в плазме крови (c): Cl = скорость элиминации / с По своей сути величина клиренса численно указывает на объем плазмы, который полностью освобождается от лекарства в единицу времени. Понятно, что общий клиренс отражает элиминирование лекарства в каждом из органов элиминации и является суммарной величиной, т.е. Cl общий(системный) = Clпочечный + Clпеченочный + Cl другими путями.
Другими показателями, характеризующими процесс элиминации являются константа скорости элиминации (Кel) и период полувыведения (Т1/2). Константа скорости элиминации (Кel) указывает какая часть вещества элиминируется из организма в единицу времени. Период полувыведения (Т1/2) – это время необходимое для снижения концентрации лекарства в плазме крови в процессе элиминации на половину от исходной. Элиминация первого порядка. Термин «первого порядка» обозначает, что скорость элиминации пропорциональна концентрации вещества, то есть, чем выше концентрация тем большее количество вещества будет элиминировано в единицу времени. По мере снижения концентрации понижается и количество выводимого вещества в единицу времени. В результате концентрация лекарства в плазме крови снижается во времени экспоненциально (см. РИС. ниже). Лекарственные вещества с кинетикой элиминации первого порядка (а это большинство лекарственных веществ при их применении в терапевтических дозах) характеризуются постоянной величиной периода полувыведения, что может быть использовано для определения времени в течение которого лекарственное вещество может быть полностью удалено из организма. Можно легко подсчитать, что для этого необходимо время равное 4‒5 периодам полувыведения. Элиминация нулевого порядка. Термин «нулевой порядок» обозначает, что скорость элиминации постоянна (в единицу времени элиминируется определенное одинаковое количество вещества) и не зависит от концентрации вещества. Как результат этого концентрация вещества в плазме будет понижаться линейно во времени (РИС. ниже). Кинетика элиминации нулевого порядка встречается относительно редко, например в тех случаях если вводимая доза лекарства превышает возможности ферментов, принимающих участие в элиминировании лекарственного средства. Такая ситуация возникает при введении в организм, например, этанола, использовании высоких терапевтических или токсических доз ацетилсалициловой кислоты, противоэпилептического средства фенитоина.
В случае кинетики нулевого порядка понятие периода полуэлиминации утрачивает свой смысл – этот параметр изменяется непрерывно, вместе с изменением концентрации лекарственного вещества в крови.
ОСНОВЫ ФАРМАКОДИНАМИКИ
Это раздел фармакологии, в котором обсуждаются общие закономерности возникновения фармакологических эффектов лекарств и их зависимость от свойств самого лекарства, условий его применения и особенностей организма пациента.
Понятие о фармакологическом эффекте. Механизм возникновения первичных фармакологических эффектов. Природа рецепторов. Понятие об агонистах, антагонистах и парциальных агонистах. Возможные механизмы развития конечных (вторичных) фармакологических эффектов. Под фармакологическими эффектами понимают количественные, а также качественные изменения структуры и биологических функций организма, возникающие под действием лекарств. Их возникновение связывают с тем, что лекарственные вещества способны к установлению специфического взаимодействия в организме с определенными биологическими субстратами‒мишенями. Это первичное взаимодействие лекарственного вещества с биологическими субстратами, которое приводит к развитию конечных (вторичных) клинически значимых эффектов, носит название первичной фармакологической реакции или эффекта. Роль биологических субстратов для лекарств могут выполнять: · молекулы неорганических веществ, как эндогенных, например воды (для эфира), меди (для купренила), железа (для дефероксамина), так и экзогенных: ртути, мышьяка (для димеркапрола) · структурные белки (например, тубулин для колхицина) · белки‒ферменты (например, холинэстераза для антихолинэстеразных средств) · транспортные белки (например, K+ Na+ АТФаза для сердечных гликозидов) · нуклеиновые кислоты (для алкилирующих противоопухолевых веществ) Однако наиболее важным является взаимодействие лекарств с особыми регуляторными молекулами, играющими исключительно важную роль в обеспечении гомеостаза – рецепторами. Рецепторы – это специфические макромолекулярные компоненты клеток, проявляющие избирательную чувствительность к определенным химическим соединениям. Взаимодействие с ними нейромедиаторов, гормонов и других биологически активных веществ вызывает активацию рецепторов, что сопровождается специфическими изменениями в клетках, и, в конечном итоге, приводит к характерным изменениям в организме в целом. Способность вещества связываться с рецептором называют аффинностью, а его способность вызывать активацию рецептора – внутренней активностью. От рецепторов следует отличать места инертного связывания – молекулярные компоненты с которыми могут взаимодействовать биологически активные вещества. Например, эстрогены взаимодействуя с эстрогеновыми рецепторами вызывают изменение транскрипции генов. В то же время, эстрогены могут связываться с секс-глобулином в плазме крови (транспортный белок), но это не приводит к какому-либо биологическому ответу, поэтому в данном случае секс-глобулин – инертное место связывания для стероидов.
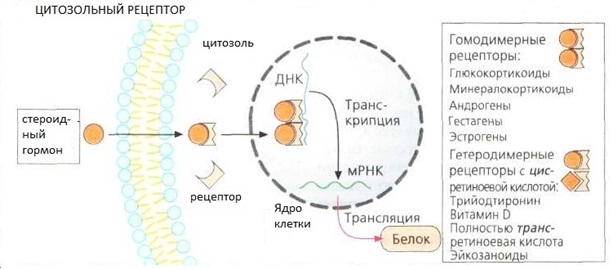
Существуют четыре основных типа таких рецепторов. 1. Цитозольные рецепторы. Это рецепторы для веществ, которые хорошо проникают через клеточные мембраны. Взаимодействие с такими рецепторами их естественных лигандов (например, стероидных гормонов), или лекарственных веществ позволяет образующимся комплексам лиганд‒рецептор проникать в ядро, где они взаимодействуют с геномом, что вызывает изменение экспрессии генов и, в конечном итоге, приводит к возникновению того или иного эффекта в целом организме.
2. Рецепторы, локализованные на мембранных ионных каналах (например, Н-холинорецептор, ГАМК‒рецептор). Их активация вызывает изменение ионной проницаемости, что в случае усиления входа в клетки катионов, приводит к деполяризации клеточных мембран, а при повышении входа анионов или выхода катионов, сопровождается гиперполяризацией мембран. (см. Рис.)
3. Рецепторы, локализованные на ферментах, связанных с мембранами (интегральные рецепторы). Примером таких рецепторов может служить рецептор для инсулина. Взаимодействие инсулина с рецепторной субъединицей снаружи клеточной мембраны приводит к активации каталитической субъединицы рецептора, обращенной внутрь клетки.
4. Рецепторы, связанные с G‒белками В отличие от интегральных рецепторов, адресная субъединица (с которой собственно связывается лиганд) и каталитическая (эффекторная), представлены различными молекулами, сопряжение между которыми осуществляют специальные гуанилатсодержащие белки (G‒белки).
Активация рецепторной субъединицы может вызывать, в зависимости от типа сопрягающего G‒белка, или повышение, или понижение активности эффекторной каталитической субъединицы рецептора, обеспечивающей образование «вторичных» мессенджеров ‒ молекул, с участием которых, сигнал, поступивший к клетке извне, трансформируется в ответную реакцию внутри клетки.
В качестве эффекторных каталитических субъединиц могут выступать: Аденилатциклаза. Это фермент, катализирующий гидролиз АТФ с образованием циклического АМФ (цАМФ). Циклический АМФ выполняет функции внутриклеточного вторичного мессенджера: в цитоплазме он связывается с зависимой от него протеинкиназой А, что вызывает распад ее молекулы на рецепторную и каталитическую субъединицы. Рецепторная субъединица поступает в ядро клетки, где влияет на транскрипцию генов, а каталитическая остается в цитоплазме, где обеспечивает фосфорилирование внутриклеточных белков-мишеней. В совокупности это приводит к изменению внутриклеточного метаболизма и формированию физиологического эффекта.
С аденилатциклазой через стимулирующие Gs белки связаны β1, β2, β3 – адренорецепторы, дофаминовые D1 и D5 рецепторы, гистаминовые Н2 рецепторы, серотониновые 5-НТ4-7 рецепторы, V2 рецепторы вазопрессина; через ингибирующие Gi белки – М2, М4 холинорецепторы, дофаминовые D2 рецепторы, α2 пресинаптические адренорецепторы, серотониновые 5‒НТ1 рецепторы, опиоидные μ рецепторы, пуриновые Р1 рецепторы. Гуанилатциклаза. Это фермент, катализирующий образование циклического ГМФ (цГМФ) из ГТФ. Циклический ГМФ активирует цГМФ-зависимые протеинкиназы, что обеспечивает фосфорилирование белков‒мишеней этих ферментов. С гуанилатциклазой связаны, как полагают, рецепторы для предсердного натрийуретического гормона. Фосфолипаза С. Это фермент, катализирующий распад мембранного фосфолипида фосфатидилинозитолдифосфата (ФИДФ) до инозитолтрифосфата (ИТФ) и диацилглицерола (ДАГ). Инозитолтрифосфат, диффундируя в цитоплазму, воздействует на внутриклеточные кальцийдепонирующие органеллы и индуцирует высвобождение из них ионов кальция и активацию вследствие этого внутриклеточных кальцийзависимых белков, например кальмодулина. Диацилглицерол вызывает активацию потеинкиназы С, которая осуществляет фосфорилирование внутриклеточных белков – мишеней этого фермента. С фосфолипазой С связаны через Gq белки α1–адренорецепторы, М1, М3 – холинорецепторы, серотониновые 5‒НТ2 рецепторы, V1 рецепторы вазопрессина, ССКа рецепторы холецистокинина.
Лекарственные вещества могут взаимодействовать с рецепторами как агонисты, антагонисты или парциальные агонисты. Агонисты – это вещества, которые, связываясь с рецепторами, их активируют, что приводит к развитию физиологического ответа, характерного для данного типа рецепторов (например, морфин по отношению к опиоидным рецепторам). Считают, что их внутренняя активность равна единице (вызывают полный ответ) Антагонисты – это вещества, которые связываются с рецепторами, но их активации не вызывают (внутренняя активность равна нулю). Таким образом они блокируют действие их агонистов и вследствие этого возникновение физиологического ответа, характерного для данного типа рецепторов (например, налоксон для опиоидных рецепторов). Парциальные агонисты – это вещества, которые связываются с рецепторами и вызывают их активацию, однако это не приводит к формированию ответа такой силы как полные агонисты (то есть их внутренняя активность меньше единицы), например, налорфин для опиоидных рецепторов. При определенных обстоятельствах, например, при их комбинированном применении с полными агонистами, они могут ограничивать действие последних. Если парциальный агонист действует на рецепторы которые уже заняты полным агонистом, то он начинает вытеснять агонист из связи с рецептором и занимать его место. Поскольку внутренняя активность парциального агониста ниже – эффект снижается (со 100%) до более низкой величины (»30-60%).
Агонисты-антагонисты – это вещества, которые одновременно могут взаимодействовать не с одним, а с несколькими типами рецепторов, при этом одни из них активируют, а другие блокируют (например, пентазоцин является агонистом κ и δ и антагонистом μ – опиоидных рецепторов). Полагают что причиной такого взаимодействия лекарств с рецепторами может быть их не очень высокая аффинность. Инверсные агонисты – это вещества, которые связываются с рецепторами и вызывают эффект обратный тому, который возникает при действии обычного агониста.
Сотношение между концентрацией лекарственного вещества и фармакологическим эффектом. Широта терапевтического действия. Терапевтический индекс. Понятие о терапевтическом коридоре. Принципы рационального дозирования лекарств.
Величина фармакологического эффекта лекарственного вещества зависит от его концентрации в области рецепторов в тканях или органах-мишенях. Эта зависимость носит экспоненциальный (нелинейный) характер и может быть представлена наглядно в виде следующего графиков:
С учетом того, что концентрация лекарственного вещества в области рецепторов определяется количеством введенного в организм лекарства, такая же приблизительно зависимость величины эффекта существует и от дозы лекарственного вещества (т.е. количества вещества введенного в организм). Анализ подобного рода кривых позволяет определить ED50 (EC50) – т.е. дозу (или концентрацию) вещества, в которой лекарство вызывает эффект, равный половине от максимального, а также дозу (концентрацию) превышение которой бесполезно, так как это не приводит к дальнейшему существенному увеличению эффекта ‒ EDmax (ECmax). Построив такие графики для терапевтических и токсических эффектов лекарства, можно определить терапевтический индекс и терапевтическую широту и таким образом оценить безопасность лекарства:
Терапевтический индекс (ТИ) – это соотношение между среднетоксической дозой TD50 (или, чаще, LD50 - установленной в опытах на животных летальной дозой, вызывающей гибель в 50% случаев) и среднетерапевтической (среднеэффективной) ED50: ТИ = TD50 (или LD50) / ED50. Более безопасное вещество, можно ожидать, будет иметь большее значение этого индекса и наоборот. К сожалению вариации наклона кривых «доза-эффект» делают оценку степени безопасности лекарств с помощью определенного таким образом терапевтического индекса не всегда корректной. Например, как следует из данных представленных на рисунке, ТИ вещества А равен 100, ТИ для вещества В равен 10. То есть, если судить по значению терапевтических индексов вещество А, можно думать, более безопасное. Однако на рисунке видно, что токсические эффекты при применении вещества А начинают проявляться раньше, чем оно вызывает полумаксимальный терапевтический эффект. Для вещества В токсические концентрации выше терапевтических. Терапевтическая широта описывает диапозон доз между минимальной терапевтической и максимальной переносимой токсической концентрациями вещества. Является более клинически уместным для оценки безопасности лекарств, так как устанавливает верхнюю и нижнюю границу допустимых колебаний концентраций лекарственного вещества в крови.
Зависимость действия лекарственных веществ от их структуры, физико-химических свойств, лекарственной формы и путей введения. Проблема биоэквивалентности лекарств. 1.Химическая структура. Определяет: · тип биосубстрата, с которым вещество может взаимодействовать. Например, для соединений общей формулы: N–(CH)n–N, где n=6, характерно ганглиоблокирующее действие. Такие вещества взаимодействуют с Н– холинорецепторами нервного типа (Нн‒х.р.). Если n = 10 или 18, то вещества оказывают мышечно-расслабляющее действие, т.е., взаимодействуют с Н– холинорецепторами мышечного типа (Нм‒х.р.) · конфигурацию молекул вещества и тем самым его способность взаимодействовать с рецептором определенного типа. Так, например, S (‒) энантиомер карведилола является активным бета-блокатором, в то же время R (+) изомер – в 100 раз более слабый · характер устанавливаемых с биологическим субстратом связей и таким образом продолжительность действия. Например, альфа-адреноблокатор феноксибензамин образует ковалентные связи с компонентами альфа-адренорецептора и действует в связи с этим более длительно по сравнению с другим альфа-адреноблокатором фентоламином, который связывается с альфа-рецепторами нековалентно. 2 .Физико-химические свойства лекарственного вещества. Определяют его кинетику, и, следовательно, его концентрацию в области взаимодействия с биологическим субстратом. При этом имеют значение: · размеры молекул и их полярность · степень ионизации вещества · соотношение его липофильных и гидрофильных свойств 3. Лекарственная форма. Определяет скорость высвобождения лекарственного вещества. В зависимости от лекарственной формы одно и то же вещество может поступать в общий кровоток с разной скоростью. Так, в ряду: водный раствор, суспензия, порошок, таблетка, ‒ скорость поступления активной субстанции в кровь убывает. Имеет значение также размеры частиц, характер эксципиентов и т.п. Если лекарственные средства, содержащие одинаковые дозы одного и того же лекарственного вещества, демонстрируют одинаковую фармакокинетику, то о таких лекарственных средствах говорят, что они биоэквивалентны. Биоэквивалентность обеспечивает взаимозаменяемость лекарственных средств. 4. Пути введения. Биодоступность и скорость поступления лекарства в общий кровоток варьирует в зависимости от путей введения, что может оказать влияние на действие лекарств. Например, в ряду: в/в, в/мыш, п/к, ‒ скорость поступления лекарственного вещества в кровоток убывает. То же наблюдается в ряду: под язык, внутрь, на кожу.
Взаимодействие лекарственных веществ. Синергизм. Антагонизм. Лекарственная несовместимость. Взаимодействие лекарственных веществ наблюдается при их одновременном назначении. При этом может иметь место: · синергизм · антагонизм · лекарственная несовместимость 1. Синергизм – это такой вид взаимодействия лекарств, при котором эффект комбинации превышает эффекты каждого из веществ в отдельности. Различают суммирование (эффект комбинации равен простой сумме эффектов каждого из взаимодействующих веществ в отдельности) и потенцирование (конечный эффект комбинации превышает сумму эффектов каждого вещества в отдельности). О потенцировании чаще всего говорят, если одно из веществ вызывает лишь незначительный эффект или не вызывает его вовсе, как например антимикробный эффект комбинации амоксициллина (бета‒лактамного антибиотика) и клавулановой кислоты (ингибитора бета‒лактамаз, не обладающего антимикробным действием). 2. Антагонизм – это такой вид комбинированного действия, когда лекарственные вещества, при применении их в комбинации, ослабляют действие друг друга. Различают прямой и косвенный антагонизм. Прямой (фармакологический) – антагонизм между веществами, которые действуют на одни и те же рецепторы (субстраты). Например, антагонизм между м-холиномиметиком пилокарпином и м‒холиноблокатором атропином. Может быть конкурентным (обратимым) и неконкурентным (необратимым). При конкурентном антагонизме проявление антагонизма изменяются в соответствии с изменением концентраций антагонистов. Другими словами, это такой антагонизм, который может быть преодолен повышением концентрации взаимодействующих веществ. При неконкурентном антагонизме такая закономерность отсутствует. Косвенный (или физиологический) антагонизм – это антагонизм между веществами, которые действуют на разные рецепторы. Например, между м-холиномиметиком пилокарпином, действующем на м-холинорецепторы круговой мышцы радужки и вызывающем сужение зрачка, и адреномиметиком адреналином, оказывающем влияние на альфа-адренорецепторы радиальной мышцы радужки и вызывающем расширение зрачка. Если антагонизм обусловлен непосредственным взаимодействием веществ между собой, то такой антагонизм называют химическим или антидотизмом. Например протамин прекращает действие антикоагулянта гепарина, непосредственно взаимодействуя с ним и инактивируя его. 3. Лекарственная несовместимость. Это нежелательной взаимодействие между лекарствами при их одновременном назначении. Различают фармацевтическую и фармакологическую несовместимость. 1. Фармацевтическая. Нежелательное взаимодействие между веществами физического, физико-химического или химического характера, проявляющаяся при приготовлении лекарственных средств до их введения в организм, например, при смешивании в одном шприце. 2. Фармакологическая несовместимость. Это нежелательное взаимодействие лекарственных веществ в организме. Проявляется ослаблением терапевтического действия или усилением токсического. По своей природе может быть фармакокинетической или фармакодинамической. 1.Фармакокинетическая. Возникает вследствие неблагоприятного изменения фармакокинетики взаимодействующих веществ: · на этапе всасывания (например лекарственные средства железа будут затруднять абсорбцию тетрациклинов) · транспорта и распределения (одновременное назначение сульфаниламидных средств и неодикумарина приводит к вытеснению последнего из его связи с белками плазмы крови, что сопровождается повышением концентрации неодикумарина в крови и может привести к чрезмерному антикоагулянтному эффекту и кровотечению) · биотрансформации (одновременное назначение индукторов или ингибиторов ферментов, принимающих участие в биотрансформации лекарств, с лекарственными веществами, которые являются субстратами этих ферментов). Например, одновременное применение макролидных антибиотиков эритромицина, кларитромицина, или противогрибковых средств кетоконазола, итраконазола с антигистаминными средствами терфенадином, астемизолом, риск проаритмогенного действия последних заметно повышается вследствие замедления их метаболизма · выведения (фуросемид усиливает выведение многих лекарственных веществ и таким образом прекращает их действие). 2.Фармакодинамическая несовместимость – нежелательное взаимодействие проявляется вследствие того, что одно вещество изменяет фармакодинамику другого. Например, средство для наркоза галотан повышает чувствительность миокарда к катехоламинам, вследствие чего их введение во время галотанового наркоза может вызвать фибрилляцию сердца.
Действие лекарств при их повторном введении. Материальная и функциональная кумуляция, привыкание, тахифилаксия. Психическая и физическая лекарственная зависимость. Медицинские и социальные аспекты наркоманий. При повторных введениях лекарственных веществ могут иметь место следующие явления: · кумуляция · привыкание · лекарственная зависимость · сенсибилизация. 1. Кумуляция. Проявляется повышением интенсивности реакции организма на повторное введение лекарства. Может быть обусловлена накоплением лекарственного вещества в организме (материальная кумуляция), что имеет место, например, при повторных введениях сердечных гликозидов без учета коэффициента их элиминации, или накоплением эффекта (функциональная кумуляция), возникающем, например, при повторных введениях ингибиторов ферментов с необратимым типом действия. 2. Привыкание (толерантность). Это снижение интенсивности реакции организма на повторное введение лекарства. Главной причиной привыкания является: · повышение скорости инактивации лекарственного вещества в организме вследствие индукции микросомальных ферментов печени (например, при повторных введениях противосудорожного средства фенобарбитала), · или, реже, понижением числа или снижением чувствительности (десенситизации) рецепторов к лекарственному веществу (с этим связывают снижение эффективности нитратов и бета‒2 адреностимуляторов при их непрерывном повторном введении в организм). Если привыкание возникает при введении лекарства через короткие интервалы времени (минуты, часы – до одних суток), а при ведении через большие интервалы эффект сохраняется в полном объеме, такое привыкание называется тахифилаксией. Это имеет место, например, при назначении симпатомиметического средства эфедрина и обусловлено истощением запасов медиатора норадреналина в симпатических окончаниях. 3. Лекарственная зависимость. Это появление труднопреодолимого стремления к повторному приему лекарства. Развивается чаще к веществам, вызывающим эйфорию или оказывающим психостимулирующее действие. Различают психическую и физическую зависимость. Физическая зависимость характеризуется наличием абстиненции (синдрома отмены), когда прекращение приема лекарства, вызвавшего лекарственную зависимость, вызывает появление симптомов, часто противоположным тем, ради возникновения которых лекарство принимается, например дисфории вместо эйфории, бессонницы вместо сна, а введение лекарства в организм устраняет эти нарушения. 4. Сенсибилизация. Это повышение чувствительности организма к лекарству при его повторных введениях, вследствие изменения иммунологического статуса организма (появления антител или сенсибилизированных лимфоцитов).
Значение индивидуальных особенностей организма для действия лекарственных веществ. Половые и возрастные различия в действии лекарств и причины их обусловливающие. Дозирование лекарств в зависимости от возраста. Применение лекарств у женщин во время беременности и лактации. Влияние генетических и патологических состояний организма на проявление фармакологического эффекта. Действие лекарств зависит не только от свойств самого лекарства, но и от особенностей организма пациента. 1.Возраст. У детей первых лет жизни и людей старческого возраста повышена чувствительность к фармакологическому действию лекарств. Это отражает особенности всасывания, распределения и элиминации веществ, а также различия в реактивности организма, характерные для данных возрастных групп. Поэтому для детей и стариков дозы лекарств как правило ниже, чем у взрослых. Высшие разовые и суточные дозы ядовитых и сильнодействующих лекарств для детей приведены в Фармакопее, для остальных лекарств их можно расчитать по специальным формулам, учитывающим разницу в массе или возрасте ребенка и взрослого, например:
Для более точного определения дозы по последней формуле было предложено учитывать еще и «дозовый фактор»(Df):
Величину Df определяют с учетом возраста ребенка:
Предложена также формула, которая определяет величину дозы исходя из площади поверхности тела ребенка:
в данной формуле ППТ – площадь поверхности тела, которая может быть определена по формуле Дюбуа:
(ППТ – площадь поверхности тела, МТ – масса тела, Р – рост). 2 .Пол. Большой разницы в фармакокинетике и фармакодинамике лекарств в мужском и женском организме нет. Более важным являются особенности женского организма, связанные с их фертильными функциями, а именно беременностью и периодом грудного вскармливания. Не следует назначать в это время лекарственные средства, которые оказывают неблагоприятное влияние на организм развивающегося ребенка и привести к нежелательным последствиям. При угрозе здоровью или жизни матери следует тщательно взвесить риск и пользу, прежде чем назначить то или иное лекарство. 3 .Генетические факторы. Особенно важное значение имеют особенности генетического статуса, которые определяют активность ферментов, принимающих участие в биотрансформации лекарств. У некоторых людей имеется генетически обусловленная низкая активность ферментов этого типа (ферментопатия). При наличии ферментопатии на многие лекарства возникают атипичные реакции не всегда безопасные для организма. Наиболее изученными и распространенными являются следующие виды ферментопатий: недостаточность глюкозо‒6‒фосфат дегидрогеназы (при этом повышена чувствительность к действию веществ, обладающих высоким окислительно-восстановительным потенциалом, таким как противомалярийные средства, левомицетин, сульфаниламиды и некоторые другие. Их введение вызывает гемолиз эритроцитов и возникновение желтухи). недостаточность глютатион редуктазы (проявляется повышенной чувствительностью к тем же веществам и также сопровождается гемолизом и желтухой) недостаточность метгемоглобин редуктазы (проявляется повышенной чувствительностью к веществам‒метгемоглобинобразователям, например, натрия нитропруссиду, другим нитритам, введение которых приводит к избыточному повышению содержания метгемоглобина, что может привести к гипоксии тканей). недостаточность УДФ-глюкуронил трансферазы (введение веществ, метаболизирующихся путем конъюгации с глюкуроновой кислотой, может нарушить глюкуронизацию эндогенных метаболитов, таких например, как билирубин, что может привести к повышению содержания в крови прямого билирубина и развитию желтухи, кожного зуда). недостаточность N-ацетилазы (ацетилирование играет важную роль в инактивации таких лекарств, как сульфаниламиды, а также противотуберкулезного средства изониазида. Замедление этого процесса может привести к избыточному накоплению этих лекарственных веществ в организме и проявлению их токсического действия). недостаточность псевдохолинэстеразы (при этом замедляется процесс инактивации сукцинилхолина, что сопровождается резким увеличением продолжительности нервно-мышечного паралича, вызываемого этим веществом. Замедляется также гидролиз и других сходных с ним эфиров, например прокаина). недостаточность каталазы (при этом распад перекиси водорода замедляется, она утрачивает способность вспениваться и ее антисептические свойства не проявляются). 4. Патологические состояния. Особое значение имеют: сенсибилизация организма и изменение его иммунологического статуса. Реакцию на введение лекарства при этом трудно прогнозировать наличие патологии печени или почек. При заболеваниях, которые сопровождаются нарушением структуры и функции этих органов отмечается замедление элиминирования многих лекарств, что может приводить к превышению допустимых концентраций лекарства в организме действие некоторых лекарств может проявляться только в условиях патологии. Например, пенициллин проникает в ЦНС только при воспалении мозговых оболочек, ацетилсалициловая кислота снижает только повышенную температуру тела.
Нежелательное действие лекарственных веществ. Побочные эффекты аллергической и неаллергической природы. Синдром отмены. Токсическое действие лекарств. Эмбриотоксичность. Тератогенность. Мутагенность. Канцерогенность. Нежелательное действие – это все те нежелательные эффекты, которые наблюдаются в организме при применении лекарств в обычных терапевтических дозах. По своей природе нежелательное действие может быть аллергическим и неаллергическим. Нежелательные эффекты неаллергической природы. Весьма разнообразны по своему характеру, имеют неодинаковую выраженность и различную продолжительность, но имеют общее свойство ‒ их появление у конкретного больного может быть спрогнозировано, так как все они являются следствием фармакологических свойств данного лекарства. Снижение дозы лекарственного средства как правило приводит к ослаблению таких эффектов. Различают: Нежелательные эффекты, возникновение которых обусловлено тем же механизмом, что и основной терапевтический эффект лекарственного средства. Например, м ‒ холиноблокатор атропин, благодаря антисекреторному действию, используется для лечения пептической язвы, но при этом, как следствие этого же фармакологического механизма, проявляется сухость слизистой оболочки полости рта, кожи. Нежелательные эффекты, возникновение которых обусловлено иными механизмами, отличными от тех, которые лежат в основе терапевтического действия лекарства. Например, антибиотик из группы макролидов эритромицин вызывает усиление перистальтики кишечника, воздействуя на так называемые мотилиновые рецепторы в гладкой мускулатуре, что никак не связано с его антимикробными свойствами. Нежелательные эффекты, представляющие собой непрямые последствия основного действия лекарственных средств. К так<
|
|||||||||||||
|
Последнее изменение этой страницы: 2017-02-21; просмотров: 297; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.149.254.229 (0.012 с.) |











 ‒ формула Диллинга
‒ формула Диллинга ‒ формула Янга
‒ формула Янга






