Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Катетерна абляція лівого передсердяСодержание книги
Поиск на нашем сайте
Метою розробки методів абляції було «лікування» ФП в певних вибірках пацієнтів. Результати тривалого спостереження таких хворих свідчать про те, що після абляції синусовий ритм більш стійкий, ніж на фоні антиаритмічної терапії, хоча пізні рецидиви розвиваються нерідко [128]. У більшість досліджень включали пацієнтів з пароксизмальною ФП і мінімальними ознаками органічного ураження серця. Показання В цілому катетерна абляція показана пацієнтам, у яких симптоми зберігаються, незважаючи на оптимальну медикаментозну терапію, що включають себе засоби для контролю ЧСС і ритму. При оцінці доцільності абляції слід брати до уваги наступні факти: (1) Стадія захворювання передсердь (тип ФП, розмір ЛП, анамнез аритмії). (2) Наявність і тяжкість основного захворювання серця. (3) Можливі альтернативи (антиаритмічні засоби, контроль ЧСС). (4) Уподобання пацієнта. Складна процедура абляції, яка може призвести до тяжких ускладнень, повинна бути адекватно обгрунтована у конкретного пацієнта з ФП. Важливе значення при виборі цього методу лікування має досвід лікаря, який проводить процедуру. В опублікованих дослідженнях абляція практично завжди проводилася високо кваліфікованим фахівцями, які працюють у спеціалізованих лікувальних установах, в той час як у звичайній клінічній практиці вона може виконуватися менш кваліфікованими лікарями в закладах різного профілю. Катетерну абляцію зазвичай проводять хворим з пароксизмальною ФП, яка резистентна принаймні до одного з антиаритмічних препаратів. Подібна практика обґрунтовується результатами численних рандомізованих досліджень, що проводилися в одному центрі, і багатоцентрових проспективних досліджень, в яких абляція приводила до поліпшення контролю ритму у порівнянні з антиаритмічними засобами (табл. 18). При мета-аналізі досліджень переважно у пацієнтів з пароксизмальною ФП також були продемонстровані переваги катетерної абляції перед антиаритмічною терапією [96,131-135]. Однак, у більшість досліджень включали пацієнтів, резистентних до антиаритмічних препаратів, а тривалість спостереження була відносною короткою. Таблиця 18. Рандомізовані дослідження, в яких порівнювали катетерну абляцію і антиаритмічну терапію або відсутність лікування у пацієнтів з ФП
a Аміодарон не застосовувався, проте пацієнти отримували бета-блокатори, антагоністи кальцію та серцеві глікозиди крім препаратів IA і IC класів. b Виключаючи аміодарон. c Через 1 рік; не допускалось впродовж 1 року спостереження d Всі пацієнти, яким проводилася абляція, отримували антиаритмічні препарати e Пацієнти контрольної групи отримували аміодарон; за необхідності їм могли бути виконані дві електричні кардіоверсії протягом перших 3 міс. Аміодарон скасовували, якщо через 3 міс зберігався синусовий ритм. f ЦД 2 типу g Спостереження протягом 9 міс h Пацієнтів, які отримували аміодарон протягом попередніх 6 міс, виключали i Вважали ознакою неефективності лікування j Представлено на конференції Американської колегії кардіологів у 2010 році A4 – Atrial Fibrillation Ablation versus Antiarrhythmic Drugs; APAF – Ablation for Paroxysmal Atrial Fibrillation study; CACAF – Catheter Ablation for the Cure of Atrial Fibrillation study; RAAFT 1- Radiofrequency Ablation Atrial Fibrillation Trial; STOP-AF – Sustained Treatment Of Paroxysmal Atrial Fibrillation. Online: www.escardio.org/guidelines). ІЛВ – ізоляція легеневих вен, ПП – праве передсердя, КТП – кавотрикуспідальний перешийок, КВП – кардіоваскулярні порушення
Результати досліджень, в яких прямо порівнювали антиаритмічні засоби або катетерну абляцію в якості методів першої лінії у пацієнтів з пароксизмальною ФП, обмежені [134], проте наявні дані вказують на більш високу ефективність абляції [131]. Враховуючи високу ймовірність контролю ритму за допомогою катетерної абляції у хворих з пароксизмальною ФП і мінімальними ознаками ураження серця і відносну безпеку цього методу (якщо процедура виконується досвідченим фахівцем), абляція може розглядатися як метод лікування першої лінії у деяких пацієнтів (рис. 12).
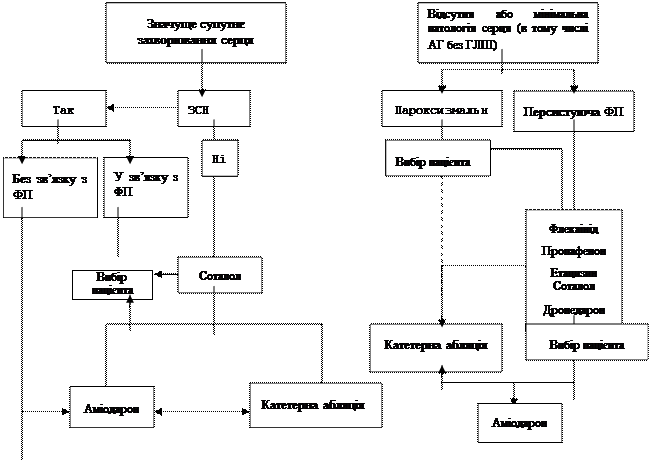
Рис. 12. Вибір абляції або антиаритмічної терапії у пацієнтів, які страждають і не страждають органічним захворюванням серця, включаючи артеріальну гіпертонію без гіпертрофії лівого шлуночка † Може знадобитися більш поширена абляція ЛП. * Звичайно проводять ізоляцію легеневих вен. ХСН – хронічна серцева недостатність. Антиаритмічні препарати перераховані в алфавітному порядку. Абляція ЛП – метод вибору (пунктирна лінія; рекомендація IIb класу) у пацієнтів з пароксизмальною ФП при збереженні виражених симптомів незважаючи на адекватний контроль ЧСС у пацієнтів без серйозного захворювання серця, які відмовляються від антиаритмічної терапії. Коментар робочої групи:
Рисунок 13. Вибір між абляцією та лікуванням протиаритмічними препаратами у пацієнтів з органічними ураженнями серця і без них. Запропонована інтеграція протиаритмічного препарату та катетерної абляції ФП у пацієнтів із значущою супутньою патологією серця та у тих, у яких відсутня або мінімальна патологія серця, в тому числі АГ без ГЛШ. †Може знадобитися більш поширена абляція ЛП; *зазвичай достатньо проведення ізоляції легеневих вен. ЗСН = застійна серцева недостатність. У кожному підрозділі протиаритмічні препарати наведені у алфавітному порядку. Будь ласка, зауважте, що застосування абляції ЛП у якості терапії першої лінії (пунктирна лінія) є рекомендацією класу IIb для пацієнтів за пароксизмальною ФП та відсутньою або мінімальною патологією серця, які залишаються у значній мірі симптомними, незважаючи на контроль ЧСС, та які відмовляються від терапії протиаритмічними препаратами. У пацієнтів з персистуючою або тривалої персистуючої ФП, які не страждають серйозним органічним захворюванням серця, стратегія лікування і коефіцієнт користь/ризик катетерної абляції остаточно не встановлені. Таким пацієнтам може знадобитися поширена або повторна абляція. Можливість цього втручання слід обговорювати тільки при неефективності антиаритмічних засобів. Аміодарон може викликати серйозні небажані ефекти, особливо при тривалому лікуванні, тому катетерна абляція може служити альтернативою аміодарону у пацієнтів молодшого віку. У пацієнтів з пароксизмальною і персистуючою ФП і серйозним органічним захворюванням серця перед абляцією рекомендується проводити антиаритмічну терапію. У таких випадках домогтися ефективної абляції важче. Підставою для втручання повинні бути виражені симптоми, пов'язані з аритмією. Результати абляції при персистуючій і довготривалій персистуючій ФП були варіабельними, але обнадійливими, проте в таких випадках часто доводиться вживати кілька спроб абляції. Ці втручання технічно складні і асоціюються з більш високим ризиком ускладнень, ніж ізоляція легеневих вен. Питання про те, чи слід призначити аміодарон або провести катетерну абляцію за неефективності менш токсичних антиаритмічних препаратів, слід вирішувати індивідуально. При цьому враховують вік пацієнта, тип і тяжкість ураження серця, розмір ЛП, супутні захворювання і переваги пацієнта. Є дані, що підтверджують користь первинної абляції у пацієнтів з ФП і супутніми захворюваннями; наприклад, у пацієнтів з СН після абляції було відзначено поліпшення фракції вибору і толерантності до фізичного навантаження [93,94]. При безсимптомному перебігу ФП користь абляції не встановлена. Обстеження перед абляцією Перед абляцією всім пацієнтам слід провести ЕКГ у 12 відведеннях та/або холтерівське моніторування, а також ехокардіографію для виключення органічного захворювання серця. Додаткові методи дослідження, такі як МРТ і КТ, дозволяють вивчити тривимірну геометрію передсердь і кількісно оцінити ступінь фіброзу передсердь. Щоб знизити ризик тромбоемболічних ускладнень під час абляції, слід виключити тромбоз ЛП (найчастіше у вушку). Між ЧС-ЕхоКГ і процедурою (рекомендований час ≤48 год) доцільно проводити адекватну антикоагуляцію. Елімінація тригера шляхом ізоляції легеневих вен Вивчення ролі осередкової активності в області гирл легеневих вен у розвитку епізодів ФП послужило основою для розробки методу електричної ізоляції цих тригерів від тканини передсердь. Для цього в гирла легеневих вен вводять циркулярний картуючий катетер, за допомогою якого проводиться сегментарна абляція з'єднувальних волокон. Характерний потенціал в легеневих венах визначається також за наявності синусового ритму, тому процедура абляції може бути виконана за відсутності критичної активності. Сегментарну абляцію волокон, що з'єднують ЛП і легеневі вени, виробляє поблизу гирл судин, що підвищує ризик розвитку їх стенозу та/або оклюзії. Причинами рецидивів ФП можуть бути як відновлення проведення збудження між передсердям і легеневими венами, так і вогнища критичної активності при більш дистальній ізоляції легеневих вен. Лінійна ізоляція легеневих вен і циркулярна абляція легеневих вен Щоб полегшити процедуру і знизити ризик стенозу легеневих вен, було запропоновано проводити абляцію в області передсердя навколо однієї або обох легеневих вен. Раніше було показано, що антрум легеневих вен може бути субстратом для збереження ФП. В даний час переконливо доведено, що легеневі вени і антрум мають ключове значення для збереження ФП, тому виділення «тригера» і «субстрату» не дозволяє адекватно пояснити роль легеневих вен. Після ізоляції легеневих вен у 54% пацієнтів не розвиваються стійкі епізоди ФП. Це свідчить про те, що у значної частини хворих з пароксизмальною ФП легеневі вени є субстратом для збереження ФП. Кругова абляція легеневої вени – це суто анатомічний підхід, що не припускає оцінки порушення зв'язку з відповідною ділянкою. Одночасне дослідження тканини легеневої вени не проводиться, тому необхідна тільки пункція перегородки. Після успішної ізоляції вичікування не потрібно, що скорочує тривалість втручання. При використанні даного методу до 45% легеневої вени не ізолюється, проведення між легеневою веною і ЛП повністю не блокується, а легенева вена зберігає потенційну аритмогенність. Крім того, після такої абляції частіше зустрічаються «організовані» аритмії. Нещодавно було показано, що неповна ізоляція дозволяє передбачити їх розвиток. Ці дані є доказом на користь повної абляції. Критерії ефективності ізоляції легеневих вен На думку експертів, методи абляції, які передбачають ізоляцію легеневих вен та/або гирла легеневих вен, є основою більшості подібних втручань. Метою процедури повинна бути повна електрична ізоляція легеневих вен [33]. Загальноприйнятим критерієм успіху втручання вважають повну ізоляцію всіх легеневих вен. Додатковим обґрунтуванням доцільності ізоляції легеневих вен служать дослідження, в яких вивчалися рецидиви ФП після абляції. Було встановлено, що вони розвиваються у випадку відновлення зв'язку між передсердям і легеневою веною. Ефективність повторної ізоляції легеневих вен в найближчому і більш віддаленому періоді досягала 90% у підібраних пацієнтів. Незважаючи на усунення тригерів ФП, більшості пацієнтів з персистуючою або тривалою персистуючою ФП може знадобитися додаткова модифікація субстрату. Концептуальною основою цього підходу є теорія множинних дрібних хвиль (див. Розділ 2.2.2). Пацієнтам проводять лінійну абляцію, щоб попередити появу вогнищ циркуляції збудження. Вивчалися різні конфігурації лінійної абляції, проте вибір відповідної лінії у конкретного пацієнта залишається важким завданням. Щоб домогтися повної блокади проведення, лінійна абляція повинна бути трансмуральною, проте забезпечити таку абляцію часто складно. Альтернативні методи абляції Щоб подолати обмеження послідовної абляції і уникнути ризику неповної ізоляції, розроблені пристрої, що дозволяють ізолювати легеневі вени за допомогою одного або кількох розрядів. Ці пристрої вивчалися переважно у пацієнтів з пароксизмальною ФП, які не страждають органічним захворюванням серця або вираженою дилатацією ЛП. Для втручання в основному використовуються радіочастотні хвилі, хоча існують і альтернативні джерела енергії, такі як Кріотерм (термоелектричні генераторні модулі), ультразвук і лазерне випромінювання. Рандомізовані дослідження поки не проводилися, що не дозволяє судити про переваги цих методів перед стандартною послідовною абляцією. Враховуючи можливість надмірного пошкодження навколишніх тканин, наприклад, формування свищів між передсердям і стравоходом, необхідно довести, що нові пристрої є простими і безпечними. Альтернативні методи модифікації субстрату Робилися спроби абляції передсердної тканини, генеруючої складні фракційні електрограми, без ізоляції легеневих вен. Хоча результати, отримані в окремих центрах, виявилися обнадійливими, в проспективних рандомізованих дослідженнях ефективність втручання не була підтверджена. Цікаво відзначити, що рецидиви аритмії після подібних процедур пов'язані з активністю легеневих вен. Деякі автори проводили радіочастотну абляцію гангліонарного сплетення на додаток до ізоляції легеневих вен. Користь цього методу не встановлена. Ускладнення Катетерна абляція супроводжується різними ускладненнями (табл. 17) [129-131]. Найбільш серйозними вважають ускладнення, які призводять до незворотних змін або смерті, вимагають втручання або госпіталізації (або збільшення її тривалості). Слід зазначити можливість більш рідкісних ускладнень з серйозними наслідками, особливо якщо замість радіочастотного випромінювання використовуються інші джерела енергії. Таблиця 17. Ускладнення катетерної абляції ФП
ALARA = якнайнижче Спостереження Антикоагуляція. Безпосередньо після абляції застосовують НМГ або НФГ внутрішньовенно, щоб створити «міст» до відновлення антикоагуляції, яку продовжують принаймні протягом 3-х місяців [136], хоча деякі центри не переривають антикоагулянтну терапію під час втручання. Доцільність подальшої терапії ПАК оцінюють з урахуванням ризику інсульту (див. Розділ 4.1). Скасовувати варфарин після абляції зазвичай не рекомендують пацієнтам з високим ризиком інсульту (див. Розділ 4.1), так як ФП – це хронічна і прогресуюча аритмія. Моніторування рецидивів ФП. Методи оцінки середньострокових і довгострокових результатів абляції ФП продовжують обговорюватися. Може бути достатнім контроль симптомів, купіювання яких є основною метою абляції ФП. Щоб визначити ефективність різних втручань і поліпшити техніку абляції, необхідно проводити систематичне стандартизоване моніторування ЕКГ [3]. На думку експертів, пацієнта слід обстежити через 3 місяці після втручання, а потім кожні 6 місяців протягом принаймні 2-х років [33]. Істинна частота рецидивів буде значно заниженою (див. Розділ 3.4). Результати мета-аналізу і рандомізованих досліджень, в яких порівнювали абляцію та антиаритмічні засоби Хоча лікарські засоби залишаються основою лікування ФП, в останні роки зростає роль катетерної абляції. За даними нещодавно проведеного мета-аналізу, ефективність катетерної абляції і антиаритмічної терапії склала 77% і 52%, відповідно [131]. Схожі результати були отримані в інших мета-аналізах [134,140,141], в одному з яких ізоляція легеневих вен у хворих з пароксизмальною або персистуючою ФП супроводжувалася значним збільшенням вірогідності відсутності нападів аритмії через 1 рік (відношення шансів 9,74; 95% ДІ 3,98-23.87; P <0,001) [140]. У декількох проспективних багатоцентрових дослідженнях була підтверджена більш висока ефективність катетерної абляції в порівнянні з антиаритмічною терапією. Багатьом пацієнтам проводили повторні втручання, що вказує на обмеження цього методу лікування. Крім відновлення зв'язку між ізольованими легеневими венами з тканиною передсердь основною причиною аритмій, що виникають після абляції, є ятрогенна передсердна тахікардія за механізмом re-entry. У випадку розвитку аритмії може знадобитися повторна абляція. Очікуються результати триваючих багатоцентрових досліджень в певних підгрупах пацієнтів, наприклад, з ФП і застійною СН (CASTLE-AF, AMICA). Поки немає даних, що підтверджують ефективність успішної абляції ФП в профілактиці смертності, проте це питання вивчається у великому проспективному міжнародному дослідженні CABANA. Можна припустити, що абляція ФП в рамках стратегії контролю ритму найбільш ефективна і корисна на ранньому етапі розвитку захворювання [23]. Клінічна ефективність раннього контролю ритму вивчається в дослідженні EAST. Очікується, що обидва дослідження будуть завершені в 2015 році.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-19; просмотров: 376; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.012 с.) |