Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
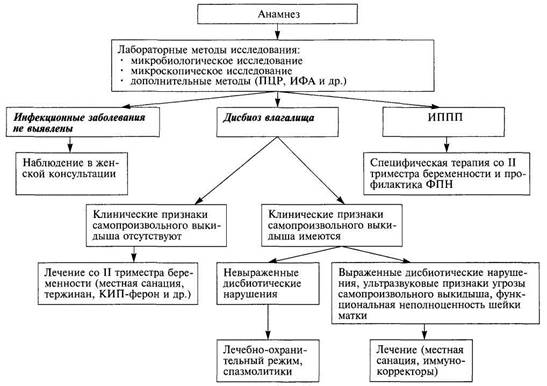
Схема 8.1. Алгоритм ведения беременных при инфекционном генезе невынашивания беременностиСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
При клинико-эндокринологическом обследовании пациенток с неполной лютеиновой фазой было показано, что данная патология возникает в результате нарушений на различных уровнях гипоталамо-гипофизарно-яичниковой и надпочечниковой систем и проявляется в виде: • снижения амплитуды и изменения пульсирующего ритма секреции гонадотропного рилизинг-гормона (люлиберина); • повышения уровня пролактина; • снижения овуляторного пика ЛГ и/или соотношения ФСГ/ЛГ в течение цикла и в период овуляции. Расстройство механизмов регуляции менструального цикла на уровне гипоталамо-гипофизарной области является основной причиной: • нарушения роста и полноценного созревания фолликулов; • неполноценной овуляции; • образования патологического желтого тела. В результате описанных нарушений формируется желтое тело, которое в каждом последующем цикле секретирует сниженное количество прогестерона. Гормональная недостаточность яичников проявляется также снижением уровня эстрогенов в течение менструального цикла и изменением соотношения между эстрогенами и прогестероном, особенно в лютеиновой фазе. Возможной причиной нарушения созревания фолликулов являются патологические состояния яичников, обусловленные хроническим воспалительным процессом гениталий, оперативными вмешательствами на яичниках, что приводит к снижению их функциональной активности, особенно у женщин старше 35— 36 лет. В конечном итоге на фоне гипоэстрогении и гипопрогестеронемии развивается неполноценная фаза секреции эндометрия, что препятствует имплантации оплодотворенной яйцеклетки и нормальному развитию беременности. Таким образом, нарушение функции желтого тела, секретирующего недостаточное количество прогестерона, является причиной самопроизвольного выкидыша на ранних сроках, а неполноценная функция трофобласта — на более поздних сроках I триместра беременности.
При неполноценной лютеиновой фазе назначают натуральные прогестероны в течение нескольких месяцев (дюфастон по 200 мг, утрожестан перорально по 200 мг или интравагинально по 300 мг в сутки) с 16-го по 25-й день менструального цикла. На ранних сроках беременности в зависимости от наличия симптомов угрозы прерывания беременности и уровня прогестерона возможно назначение дюфастона и утрожестана в аналогичных дозах до 10—12 нед беременности. Гиперандрогения — патологическое состояние, обусловленное повышенным уровнем надпочечниковых и яичниковых андрогенов, что является причиной самопроизвольного выкидыша у 20—40% женщин. В клинике различают три вида гиперандрогении: • надпочечниковая; • яичниковая; • смешанная. Независимо от вида гиперандрогении прерывание беременности наступает на ранних сроках и протекает по типу анэмбрионии или неразвивающейся беременности. У 40% пациенток в течение беременности возникает функциональная ИЦН или низкое предлежание плаценты. Во II и III триместрах прерывание беременности происходит в критические сроки. С каждым последующим выкидышем характер гормональных нарушений становится более тяжелым и в 25—30% случаев к проблеме невынашивания присоединяется вторичное бесплодие. Во время беременности у пациенток с гиперандрогенией наблюдается три критических периода, когда происходит повышение уровня андрогенов в организме матери за счет андрогенов, синтезируемых плодом. Так, в 12—13 нед начинают функционировать надпочечники плода; в 23—24 нед яички плода мужского пола начинают вырабатывать андрогены и в 27—28 нед начинает секретироваться АКТГ передней долей гипофиза плода. При гиперандрогении, выявленной до беременности, проводится подготовительная терапия дексаметазоном по 1/2 таблетки (0,25 мг) 1 раз в сутки вечером перед сном, непрерывно до наступления беременности. Доза препарата меняется в зависимости от уровня надпочечниковых андрогенов (ДГЭА/ДГЭА-сульфат), которые определяются 1 раз в месяц (на 5—7-й день цикла). Определение тестостерона на фоне проводимой терапии нецелесообразно, так как дексаметазон не оказывает на него никакого подавляющего воздействия. Длительность терапии до наступления беременности составляет 6—12 мес и, если в течение этого времени беременность не наступила, следует подумать о возникновении вторичного бесплодия. Во время беременности доза и длительность приема препарата определяются особенностями клинического течения беременности, наличием симптомов угрозы прерывания и ИЦН, а также динамикой уровня ДГЭА/ДГЭА-сульфата. Сроки прекращения приема дексаметазона колеблются от 16 до 36 нед и у каждой пациентки определяются индивидуально. Наиболее частыми осложнениями беременностей, обусловленных эндокринными причинами невынашивания, особенно на фоне гиперандрогении, являются угроза прерывания с ранних сроков, функциональная ИЦН, низкая плацентация, угроза развития гипертензии и гестоза во II и III триместрах беременности. У пациенток с заболеваниями щитовидной железы по типу гипо-, гипертиреоза, аутоиммунного тиреоидита и др. рекомендуется устранение выявленных нарушений до наступления следующей беременности, а также подбор дозы тиреоидных гомонов и клинико-лабораторный контроль в течение всей беременности. Беременность у женщин с сахарным диабетом рекомендуется после обследования у эндокринолога и коррекции основного заболевания. Во время беременности пациентка находится под наблюдением как эндокринолога, так и гинеколога и тактика ведения беременности и характер родоразрешения решаются в зависимости от состояния здоровья пациентки.
Иммунные факторы
Иммунные факторы невынашивания беременности являются наиболее частыми причинами невынашивания беременности и частота их, по данным разных авторов, составляет 40—50%. Распознавание чужеродного агента и развитие иммунного ответа в организме женщины регулируются антигенами HLA, которые делятся на два класса. Гены, кодирующие эти антигены, располагаются на 6-й хромосоме. I класс антигенов HLA представлен антигенами А, В, С, необходимыми для распознавания трансформированных клеток цитотоксическими Т-лимфоцитами. Антигены HLA II класса (DR, DP, DQ) обеспечивают взаимодействие между макрофагами и Т-лимфоцита-ми в процессе иммунного ответа. Считают, что носительство некоторых антигенов HLA сочетается с предрасположенностью к некоторым болезням. При изучении роли иммунологического фактора в клинике невынашивания беременности выявлены две группы нарушений: в гуморальном и клеточном звеньях иммунитета. Нарушения в гуморальном звене иммунитета связаны с антифосфолипидным синдромом. Второй, не менее сложный механизм невынашивания беременности обусловлен нарушениями в клеточном звене иммунитета, что проявляется ответной реакцией организма матери на отцовские антигены эмбриона. В этой группе пациенток наиболее четко определяется взаимосвязь между гормональными и иммунными факторами. Считают, что среди этих механизмов значительную роль играет прогестерон, который участвует в нормализации иммунного ответа на ранних стадиях беременности. Под влиянием прогестерона активируются лимфоциты и начинают вырабатывать белок, так называемый прогестерониндуцированный блокирующий фактор (ПИБФ), который оказывает антиабортивное действие в организме женщины и способствует сохранению беременности. Каковы же иммунологические механизмы, вызывающие прерывание беременности на ранних сроках? С этой целью следует вспомнить особенности формирования эмбриона после оплодотворения яйцеклетки сперматозоидом. Сперматозоид, образуясь из зародышевой клетки и пройдя ряд стадий развития, содержит половину общего набора хромосом (23 хромосомы). Аналогичный набор из 23 хромосом содержит яйцеклетка, образующаяся в результате овуляции. Соответственно оплодотворенная яйцеклетка содержит уже набор из 46 генетически запрограммированных хромосом. В лимфоцитах периферической крови в норме присутствуют рецепторы прогестерона. При отсутствии беременности количество лимфоцитов, содержащих рецепторы прогестерона, незначительно. Однако количество этих клеток увеличивается при наступлении беременности и возрастает пропорционально ее сроку. Вероятно, такое увеличение числа рецепторов прогестерона может быть вызвано эмбрионом, который выступает в роли аллоантигена, стимулирующего лимфоциты крови. При самопроизвольном выкидыше количество клеток, содержащих рецепторы прогестерона, резко уменьшается и практически не отличается от показателей вне беременности. Считают, что необъяснимые формы невынашивания беременности могут быть обусловлены нарушениями в клеточном и гуморальном звеньях иммунитета. Много внимания уделяется клеточно-опосредуемым иммунным механизмам как возможным этиологическим факторам самопроизвольного выкидыша; в частности, речь идет о клетках Т-хелперах (ТХ1, ТХ2) и секретируемых ими цитокинах. В организме эти клетки активируются по очереди. Реакция, обусловленная клетками ТХ2, способствует сохранению нормальной беременности, в то время как реакция, обусловленная клетками ТХ1, является антагонистической по отношению к беременности и может вызывать аборт (схема 8.2). Несмотря на то что в настоящее время механизм развития самопроизвольного выкидыша окончательно не выяснен, полагают, что важную роль в них могут играть естественные киллеры, активируемые лимфокинами, и активированные децидуальные макрофаги.
|
||
|
Последнее изменение этой страницы: 2016-09-17; просмотров: 604; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.62 (0.011 с.) |