Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Лабораторная диагностика хронического панкреатитаСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Лабораторные тесты, применяющиеся для диагностики ХП, относят к следующим группам: 1. Исследование содержания (активности) ферментов ПЖ в крови, 2. Зондовые методы изучения экзокринной функции ПЖ: а) прямые; б) непрямые. 3. Беззондовые методы выявления внешнесекреторной недостаточности а) тесты на активность панкреатических ферментов, при которых в моче или выдыхаемом воздухе определяют продукты гидролиза разных субстратов; 240 • ХРОНИЧЕСКИЙ ПАНКРЕАТИТ
в) оценка содержания панкреатических ферментов (эластазы, липазы, 4. Оценка инкреторной функции ПЖ (определение содержания С-пеп-тида в крови, проба Штауба—Трауготта и др.). 5.Оценка трофологической недостаточности. Кроме того, для лабораторной диагностики ХП используют иммунологические, генетические, цитологические, гистологические исследования, определяют в крови уровни панкреатического полипептида, «онкомарке-ров» — СА 19—9, СЕА (карциноэмбриональный антиген) и др. 5.3.1. Исследование содержания (активности) ферментов поджелудочной железы в крови и моче Первая группа диагностических тестов обычно используется для выявления феномена выхода («уклонения») ферментов в кровь, который развивается при деструкции паренхимы органа и при повышении внутрипротоко-вого давления. Ферменты поступают в интерстициальную жидкость, затем в лимфу и кровь, а позже попадают в мочу. Панкреатические ферменты проникают в кровь также из секреторных ходов и протоков ПЖ. Кроме того, происходит всасывание ферментов в проксимальных отделах тонкой кишки. Далее мы кратко представим основные механизмы феномена «уклонения» ферментов в кровь, поскольку панкреатическая ферментемия имеет и определенное физиологическое значение. На наш взгляд, знание механизмов проникновения ферментов ПЖ в кровь является необходимым для адекватной оценки показателей панкреатических ферментов в крови и упорядочения изложения в монографии материала. В целом, большое количество научных публикаций, посвященных определению амилазы, липазы, трипсина, эластазы и других панкреатических ферментов в плазме крови при панкреатите, не позволяют нам привести результаты большинства из них, поскольку данный анализ выходит за пределы задач этой главы и монографии в целом. 5.3.1.1. Механизмы проникновения панкреатических ферментов в кровь Основными продуцентами гидролитических ферментов в кровь являются слюнные, желудочные железы, ПЖ, печень и секреторный аппарат тонкой кишки [40]. В течение длительного времени дискуссионным оставался вопрос о происхождении панкреатических гидролаз в крови. Во многих работах утверждалось, что экзосекретированные панкреатические ферменты попадают в кровь из тонкой кишки (т. е. имеют резорбционное происхождение), вопреки каноническому положению, что белки из просвета тонкой кишки не всасываются. Компромисс между сторонниками и противниками «ре-зорбционной» теории был найден после определения того факта, что белки в незначительном количестве все же могут всасываться в тонкой кишке [11, 38]. Однако всасывание белков в тонкой кишке в большей степени касается всасывания белков-нутриентов и вряд ли может быть отнесено к минорным белкам химуса, в числе которых присутствуют и панкреатиче- Глава 5. Диагностика панкреатитов • 241
Однако использование рядом авторов ферментов, меченных изотопами, показало, что всасывание их составило, по данным разных исследований, 40 % [37J], 60 % [36], 50-70 % [220]. На экспериментальных моделях с отрезками тонкой кишки у крыс in vitro был отмечен переход р-амилазы из состава перфузата полости тонкой кишки в изотопический раствор натрия хлорида, в котором инкубировался препарат кишки. Этот транспорт увеличивался при повышении гидростатического давления раствора в полости кишки [68]. Аналогичные результаты позже были получены группой авторов под руководством Г. Ф. Коротько [37], причем было определено, что наибольший транспорт ферментов характерен для дистальной части тонкой кишки, а желчные кислоты существенно повышают всасывание панкреатических ферментов. Признавая реальность тонкокишечного резорбционного механизма происхождения панкреатических ферментов в крови, нельзя считать его единственным [40]. Один из наиболее важных механизмов панкреатической ферментемии — механизм разрушения ациноцитов (некроз и апоптоз). Еще одним источником происхождения панкреатических ферментов в крови может являться инкреция ферментов на уровне ПЖ, т. е. ферменты, экзосекреторно покинув клетку-продуцент через ее апикальную мембрану, транспортируются затем из ацинусов и мелких выводных протоков в интерстиций, а оттуда — в кровь и лимфу [40, 53]. Такая гипотеза имеет не только сторонников, но и оппонентов [23, 65], поскольку полости ацинусов и мелких протоков ПЖ герметизированы межклеточными замыкатель-ными пластинами [40]. Группа гистологов [26, 80] на моделях обструктивного ОП пришла к заключению о возможности транспорта ферментов из железы в интерстиций через межклеточные контакты. В первое время после окклюзии протока ферменты транспортируются из протоковой системы через мелкие прото-ковые клетки; в дальнейшем к этому пути добавляется и транспорт ферментов через ациноциты. При этом авторами уточняется немаловажная деталь: наблюдается базолатеральный экзоцитоз после апикального эндоци-тоза, т. е. фермент предварительно не покидает клетку экзосекреторным путем, а в результате блока экзоцитоза выделяется из клетки через ее базо-латеральную мембрану. Еще одним механизмом происхождения ферментов пищеварительных желез в крови является истинная инкреция панкреатических энзимов аци-ноцитами, т. е. транспорт ферментов из ациноцитов через их базолатераль-ные мембраны в интестиций, а оттуда —в лимфу и кровь [40]. В 1961 г. А. М. Уголев [76] высказал экскреторную гипотезу эволюционного происхождения внешней и внутренней секреции. В последующих работах эта гипотеза получила авторское развитие, и в 1978 г. была сформулирована концепция о едином происхождении экзо- и эндосекреции, согласно которой секреция возникла в ходе эволюции из неспецифической экскреции клеток. В числе метаболитов из клеток удаляются не только неспецифические, но и специфические синтезированные в ней вещества — ферменты и гормоны, которые выделяются преимущественно экзо- и эндокринно, что становится доминирующим признаком данной клетки и может быть совмещено с иной специализированной ее функцией. Эта концепция еще на ранних этапах ее развития была поддержана морфологами, отметившими 242 • ХРОНИЧЕСКИЙ ПАНКРЕАТИТ
Завершая обзор возможных источников происхождения в крови ферментов ПЖ, следует признать несколько вероятных механизмов, однако качественное соотношение этих путей транспорта может изменяться в зависимости от функционального состояния ПЖ и тонкой кишки, проницаемости их гистогематических барьеров, внутрипротокового давления, уровня кровоснабжения ПЖ и тонкой кишки и, видимо, других причин. Важно еще раз подчеркнуть, что ПЖ не только экзо-, но и эндосекрети-рует синтезированные ею ферменты, а также то, что эндосекреция их может изменяться, как и экзосекреция, в весьма широких пределах, как в норме, так и, особенно, при патологии, и не только органа продуцента — ПЖ [40]. 5.3.1.2. Определение амилазы и ее изоферментов в крови и моче Как известно, в плазме и сыворотке крови человека содержится а-амилаза двух изоэнзимных типов, продуцируемых соответственно ПЖ и слюнными железами (преимущественно околоушными): — панкреатическая (р-тип); — слюнная (s-тип). Кроме того, амилолитическая активность выявлена во многих тканях — в тонкой кишке, печени, почках, мышцах, легких, маточных трубах и жировой ткани [12, 36, 40]. Это, однако, не означает, что все они синтезируют и транспортируют в кровь значительное количество амилазы. Основными поставщиками амилазы в кровь являются ПЖ и слюнные железы [40]. По данным многих авторов, занимающихся этим вопросом, доля амилоли-тической активности панкреатической а-амилазы составляет 30—40 % [250], 13—47 % [438], 40—50 % [8, 40]. Каждая из этих амилаз имеет несколько фенотипов [12]. Имеются указания, что р- и s-амилазы различаются рядом физико-химических свойств, имеют разные почечные клиренсы и разные периоды полураспада в организме (s-амилаза —18 ч, р-амилаза — 124 ч) [40]. В литературе представлено мнение, что существуют генетически обусловленные соотношения р- и s-амилаз в сыворотке крови у человека [283]. Амилаза в крови находится в свободном (растворенном) и связанном с белками плазмы и форменными элементами состоянии. На первых порах полагали, что амилаза связана с альбуминами, затем было сообщено об амилолитической активности гаммаглобулиновой фракции. Предположили, что в составе альбуминовой фракции присутствует панкреатическая, а глобулиновой — печеночная амилаза. Однако эти данные не получили строгого подтверждения [40]. По данным Э. А. Веприцкой, амилолитической активностью обладают альбумины и все фракции глобулинов [10]. По мнению Г. Ф. Коротько Глава 5. Диагностика панкреатитов • 243
Итак, определение уровня амилазы в крови и моче является наиболее распространенным диагностическим тестом и одним из первых биохимических способов диагностики панкреатита. С 1908 г., когда Вольгемут разработал метод определения активности амилазы в биологических жидкостях, было предложено более 200 методических приемов проведения данного анализа. Например, при методе М. Ceska и соавт. [138] используется устойчивый крахмальный субстрат; этот тест может быть адаптирован для любых жидкостей организма. Изоферменты амилазы также измеряются во многих обычных лабораториях; они могут определяться в сыворотке, моче или других биологических жидкостях при хроматографии, электрофорезе или изоэлектрическом фокусировании. С целью удовлетворения требований срочной диагностики был усовершенствован простой колориметрический тест, позволяющий произвести быструю оценку мочевой амилазы; этот метод имеет определенные преимущества. По мнению P. J. Holdsworth и соавт. [226], мочевой тест пригоден для скрининга при клиническом подозрении на ОП, но он не может заменить измерение сывороточной амилазы, являющееся важнейшим методом диагностики этого заболевания. Дальнейшей модификацией амилаз-ного теста является определение клиренсного отношения амилаза — креа-тинин [287, 325], однако данный тест требует 24-часового сбора мочи. Результат выражается в процентах клиренсного отношения следующим образом: Клиренсное отношение = Мочев. амилаза/Сыв. амилаза х Сыв. креатинин/Мочев. креа- тинин х 100. При ОП клиренсное отношение повышено, что объясняется увеличением панкреатического изофермента, имеющего больший клиренс (по сравнению с изоферментом s-типа), и уменьшением канальцевой реабсорбции белков [243]. Ввиду вариабельности почечных изменений при ОП ценность определения отношения клиренсов амилазы и креатинина вызывает серьезные сомнения и широко не используется [5]. Существуют противоречивые сведения о стабильности ос-амилазы: наряду с утверждением о том, что активность фермента стабильна при комнатной температуре в течение недели, имеются данные о снижение этой активности уже через несколько часов [1]. Все это объясняет низкую чувствительность метода. Невысокая чувствительность определения амилазы в крови и моче связана также с кратковременностью гиперамилаземии и ги-перамилазурии при панкреатите. Так, уровень амилазы крови начинает повышаться через 2—12 ч от начала обострения заболевания, достигает максимума через 20—30 ч, нормализуются через 2—4 сут при благоприятном течении заболевания [1, 19, 73, 141]. Содержание амилазы в моче начинает повышаться через 4—6 ч от начала заболевания, а через 8—10 ч уже может нормализоваться [203]. По данным других авторов, активность амилазы в моче, возрастает через 6—10 ч после подъема активности в крови и возвращается к норме через 3 сут после подъема [73]. В. В. Храпач и соавт. [81] считают, что уровень амилазы в моче имеет две волны повышения в течение 3 сут с начала периода обострения. В период обострения ХП активность амилазы в крови и в моче может оставаться в пределах нормальных величин, так как у таких больных подъем активности фермента происходит на фоне исходно низкого уровня, связанного с фиброзом паренхимы 244 • ХРОНИЧЕСКИЙ ПАНКРЕАТИТ
Чаще в литературе встречается мнение, что определение содержания амилазы в моче более информативно, чем в крови, так как гиперамила-зурия более стойка, чем гиперамилаземия [20, 203], хотя некоторые авторы придерживаются противоположенного мнения. Доступность получения мочи позволяет многократно повторять исследование и поэтому выявлять даже небольшой подъем показателя. Кроме того, вследствие отличий в экскреции амилазы почками доля панкреатической изоамилазы в моче значительно больше, чем в крови [19, 73, 103]. Обострение ХП сопровождается специфическим повреждением проксимальной части канальца нефрона, которое приводит к снижению реабсорбции и увеличению почечного клиренса, т. е. гиперамилазурия является результатом и гиперамилаземии, и подавления канальцевой реабсорбции. Как мы уже отмечали ранее, на этом основано определение соотношения клиренсов амилазы и креатинина. Более чувствительным, чем амилазурический тест, является вычисление дебитов уроамилазы, когда исследуется моча, собранная за определенные промежутки времени до и после пищевой нагрузки. Чувствительность этих дебитов при ХП составляет 49—73 % [19]. Для повышения чувствительности исследования уровня амилазы в крови и моче А. И. Хазанов советует проводить их изучение в первые сутки пребывания больных ХП в стационаре, затем не менее двух раз после инструментальных исследований, а также в момент усиления болевого абдоминального синдрома. При этом, по его мнению, чувствительность теста повышается с 40 до 75—85 % [77]. Интерпретация результатов исследования общей амилазы крови и мочи затруднена также тем, что фермент содержится в слюнных железах, толстой кишке, скелетных мышцах, почках, легких, яичниках, маточных трубах. Амилолитическая активность определяется в молоке, слюне, слезной жидкости, поте. Амилаза не является строгим панкреатоспецифическим ферментом, вследствие чего возможно повышение ее уровня в биологических жидкостях вследствие внепанкреатических причин (табл. 5.11): при
Глава 5. Диагностика панкреатитов • 245
Недавно опубликованы результаты ретроспективного исследования, в котором был проанализирован уровень сывороточной амилазы у всех больных, госпитализированных в стационар с диагнозом «острый гастроэнтерит», причем пациенты, имевшие другие возможные причины гиперамила-земии, были исключены из исследования. Так, уровень амилазы крови оказался повышенным у 7,4 % больных острым гастроэнтеритом, превышая в среднем верхнюю границу нормы на 32 %. Авторами было определено, что уровень гиперамилаземии у больных острым гастроэнтеритом никоим образом не влиял на течение гастроэнтерита, тяжесть состояния больных и эффективность проводимой терапии [112]. Таким образом, острый гастроэнтерит может быть ассоциирован с легкой и умеренной гипе-рамилаземией у части больных и должен быть включен в дифференциальный диагноз гиперамилаземии. Для повышения специфичности гиперамилаземии предлагают считать диагностически значимым повышение уровня фермента в 3—6 раз относительно нормы [204]. Однако патогномоничного для панкреатита уровня • амилазы в крови не существует. Вследствие значительного запаса фермента в ацинарных клетках любое нарушение их целостности или малейшее затруднение оттока секрета ПЖ может привести к значительному выходу амилазы в кровь даже при легком течении панкреатита [64]. М. Jaakkola и соавт. выявили повышение в крови уровня общей и панкреатической амилазы после однократного приема большой дозы алкоголя у субъектов без клинических проявлений панкреатита [242]. Напротив, при тяжелой деструкции паренхимы органа гиперамилаземия может не выявляться [308]. Таким образом, прямой связи между тяжестью панкреатита и амилаземией в ряде случаев не наблюдается [19]. Для повышения специфичности исследования амилазы в крови следует определять не суммарное содержание фермента, а панкреатическую изо-амилазу. Как мы отмечали ранее, у здоровых людей р-амилаза составляет до 40 % общей сывороточной амилазы, остальные 60 % представлены слюнной изоамилазой. При ХП это соотношение изменяется: панкреатическая изоамилаза составляет 75—80 % общей амилазы крови. Определение активности панкреатической изоамилазы особенно важно при хроническом панкреатите у больных с нормальным содержанием общей амилазы. Повышение показателя указывает на обострение ХП, а снижение — на экзокринную недостаточность ПЖ при атрофии ацинарной ткани и фиброзе органа у больных, перенесших ряд атак [19]. Так, исследования G. Skude и S. Eriksson [377] показали, что уровень панкреатической изоамилазы в сыворотке крови у больных ХП существенно снижен по сравнению с контролем, хотя содержание общей сывороточной амилазы у таких больных остается в пределах нормы. S. E. Aw и соавт. [100] считают, что изменение именно изоферментов амилазы в моче наиболее целесообразно при диагностике ХП. В целом специфичность определения панкреатической амилазы при ХП не превышает 88,6 % при чувствительности 40—96,9 % [2, 78, 424]. 246 • ХРОНИЧЕСКИЙ ПАНКРЕАТИТ
Большое значение в диагностике панкреатитов придают определению активности трипсина в сыворотке крови, который продуцируется только ацинарными клетками ПЖ, т. е. является панкреатоспецифичным [95, 232].
По данным L. Enslev и соавт. [176], при обследовании 80 больных ХП специфичность теста составила более 95 %, а чувствительность — только 40 %. В клинической практике частота ложноотрицательных результатов довольно высока, поэтому данный тест рассматривается как неудовлетворительный [5]. Повышение уровня имунореактивного трипсина не является строго специфичным для панкреатитов, встречается при хронической почечной недостаточности, гиперкортицизме, раке ПЖ, калькулезном холецистите. Более специфичными являются низкие показатели имунореактивного трипсина для внешнесекреторной недостаточности ПЖ. Особенно демонстративной при этом является монотонная кривая динамики имунореактивного трипсина после пищевой нагрузки в экспериментальных и клинических исследованиях. Ряд авторов предлагают определять имунореактивный трипсин в крови в качестве скринингового теста для диагностики экзокринной недостаточности ПЖ у больных, длительно страдающих ХП с исходом в фиброз органа. Однако снижение показателя может регистрироваться и при раке ПЖ. Для уменьшения частоты псевдоотрицательных результатов исследования имунореактивного трипсина в крови при ХП предложено определение его в комплексе с ингибиторами после стимуляции церулеином, панкреозими-ном, пищевой нагрузкой [19]. Определение содержания ингибиторов трипсина в сыворотке крови также используют для диагностики панкреатита, однако их показатели бывают разнонаправлены, не всегда возможна четкая трактовка результатов. Повышение уровня ингибиторов трипсина в крови чаще свидетельствует о мобилизации плазменной ингибиторной системы, что обусловливает псевдонормальные показатели трипсинемии. И напротив, низкое содержание плазменных ингибиторов обычно свидетельствует об их активном потреблении, уменьшение емкости или об истощении защитных механизмов при тяжелой деструкции ПЖ, т. е. является неблагоприятным фактором. Вместе с тем, при любых сывороточных протеазно-ингибитор-ных соотношениях они, по мнению большинства авторов, не отражают эти соотношения в ткани ПЖ, а следовательно, не могут ориентировать Глава 5. Диагностика панкреатитов • 247
Трипсиноген, циркулирующий в крови, по полярности делят на катио-нический и анионический с нормальным соотношением этих форм в сыворотке 2:1. При панкреатите происходит более выраженное повышение в крови анионной формы трипсиногена с нарушением указанного выше нормального соотношения [343]. Таким образом, определение катиониче-ского и анионического трипсиногена может использоваться в качестве диагностического теста ХП. В последние годы появились данные о достаточной информативности определения содержания трипсиногена в моче [102, 196, 258]. Точность определения уровня трипсиногена-2 в моче при дифференциальном диагнозе ОП с острой абдоминальной патологией непанкреатического происхождения оценена в исследованиях J. Hedstr6m и соавт. [219] сообщивших о чувствительности данного метода 91 % и специфичности 95 %. В дальнейших исследованиях, проведенных этой научной группой [258] у пациентов с острой брюшной болью, отрицательный ответ на трипсиноген-2 в моче исключил ОП с высокой степенью вероятности (чувствительность 95 %, отрицательная прогнозирующая ценность — 99 %). К сожалению, практические врачи чаще пользуются результатами неспецифического изучения суммарной протеолитической активности сыворотки крови, так как набор для радиоиммунного исследования в крови трипсина, катионной и анионной форм трипсиногена и трипсиногена в моче имеют высокую стоимость, и их использование пока возможно только в научных исследованиях. 5.3.1.4. Сывороточная липаза и фосфолипаза Противоречивы данные и о диагностической ценности при панкреатите определения активности сывороточной липазы. Так, ряд авторов указывают, что метод определения липазы является недостаточно чувствительным и информативным. По другим сведениям, липаза является высокоинформативным показателем, чувствительность и специфичность которого приближаются к 100 % [169]. Данные о сроках, при которых сохраняется ги-перферментемия, также значительно варьируют. Гиперлипаземия не является строго специфичной для ПЖ, так как наблюдается и при других заболеваниях желудочно-кишечного тракта. G. Melzi, M. Ventrucci и соавт. считают, что повышение активности липазы в крови в два раза специфичнее для ХП, чем гиперамилаземия. Действительно, гиперлипаземия не встречается при аппендиците, внематочной беременности, паротите, раке легкого, но ее регистрируют у 60 % больных с заболеваниями гепатобили-арной системы, при кишечной непроходимости, почечной недостаточности, раке предстательной железы и других непанкреатических заболеваниях. Согласно результатам исследования R. Pezzilli и соавт. [346], по сывороточному уровню липазы невозможно определить тяжесть текущего обострения панкреатита и ближайший прогноз. Более специфичным является снижение уровня липазы в крови в отношении фиброза ПЖ как исхода ХП и муковисцидоза. Методика определения липазы детально описана в работе J. F. Whitaker [430]. При этом используются колориметрическая техника и небольшие количества сыворотки. 248 • ХРОНИЧЕСКИЙ ПАНКРЕАТИТ
Это связано с тем, что фосфолипаза А2 играет существенную роль в патогенезе ХП благодаря тропности к липидам клеточных мембран, и способности вызывать их повреждение [418]. Кроме того фосфолипаза А2, отщепляя жирные кислоты от лецитина, образует лизолецитин, который при попадании в ГПП через несколько минут вызывает отек, а через несколько часов — некроз паренхимы ПЖ [19]. Поэтому, повышение содержания в крови фосфолипазы считают идеальным маркером деструктивных процессов [259]. Результаты целого ряда исследований свидетельствуют о высокой чувствительности (до 100 %) и специфичности (до 90 %) для ХП изучения содержания в крови фосфолипазы А2 типа I, которая является пан-креатоспецифичным энзимом [115, 330]. Доказано, что повышенный уровень фосфолипазы А2 типа I определяется в крови раньше и удерживается дольше, чем увеличение активности общей амилазы, панкреатической изо-амилазы, имунореактивного трипсина, липазы, причем гиперфосфолипазе-мия коррелирует с тяжестью обострения ХП [237]. Кроме биохимического, разработаны и более чувствительные иммунофлюорометрический и радиоиммунологический методы изучения активности ферментов. Эти методы позволяют определять не только общую фракцию фосфолипазы А2, но и уровни профермента и активного энзима. При обострении ХП соотношение между ними резко изменяется в сторону активной фосфолипазы [14, 19]. Нельзя не отметить результаты исследований М. Kashiwagi и соавт. (1998), в которых у больных ХП при изучении экспрессии генов трех изо-форм фосфолипазы А2 (I, II и IV типы) получено увеличение уровней мРНК фосфолипазы А2 II и IV типов более чем в 5 раз по сравнению с контролем [255]. Иммуногистохимические исследования показали, что у здоровых людей в ацинарных клетках ПЖ присутствует фосфолипаза А2 типа I, в то время как тип II встречается только в некоторых ацинусах. При ХП содержание фосфолипазы А2 типа II в ацинусах значительно увеличивается. Кроме того, этой изоформой были насыщены метапластиче-ские потоковые клетки, в которых, кстати, определялся и IV тип фосфолипазы А2. Все ткани ПЖ при ХП с повышенной экспрессией мРНК фосфолипазы А2 II и IV типов имели высокую степень дегенерации, метаплазии протоков и фиброза. Таким образом, можно предположить, что эти изо-формы фосфолипазы А2 могут быть ответственны за морфологические изменения, возникающие при ХП. Учитывая факт важности фосфолипазы А2 в патогенезе панкреатита, в настоящее время ведется поиск ее ингибиторов, которые можно было бы применять в лечении этого заболевания. Синтез белков, ингибирующих фосфолипазу А2, запускается в очаге воспаления стероидами. Для обозначения этой группы ингибирующих веществ используется термин «липо-кортины». Их главная роль заключается в регуляции синтеза простаглан-динов в воспалительных реакциях [14]. Местные анестетики и нейролептические препараты являются ингибиторами фосфолипазы А2 и оказывают заметное воздействие на ее активность при экспериментальном ОП [221], однако, несмотря на разработку различных агентов, ингибирующих активность фосфолипазы А2 посредством различных механизмов, ни один из них пока не признан подходящим для широкого клинического применения [140, 263]. Определение содержания фосфолипазы А2 типа I в крови является чув- Глава 5. Диагностика панкреатитов • 249
5.3.1.5. Сывороточная эластаза 1 Важное значение в аутолизе ткани ПЖ придают эластазе 1, ферменту ПЖ, относящемуся к эндропептидазам. Эластаза 1 при гидролизе белков разрывает внутренние связи между аминокислотами в середине их цепей, продуцируя, таким образом, пептиды. Эластазы занимают особое место среди других протеаз, благодаря тому, что они способны гидролизировать различные белки, в частности эластин. Таким образом, эластаза может иметь патологическую значимость в развитии сосудистых повреждений, наблюдающихся при ОП [190]. Существует 3 вида эластаз: панкреатические эластазы типов 1 и 2 и эластаза нейтрофилов. Хотя эти ферменты обладают сходными химическими свойствами, иммунологически они значительно различаются, что позволяет определять их раздельно. В настоящее время используется иммунофер-ментный метод исследования человеческой эластазы 1 (ELISA). Таким способом возможно исследование эластазы 1 в любой биологической жидкости, но коммерчески доступные наборы реактивов выпускают для анализа крови (оценка феномена «уклонения» ферментов при остром воспалении ПЖ). Активность этого фермента в крови, по данным V. Gumaste, повышается при панкреатите раньше, чем уровень других ферментов, и удерживается дольше [203]. Определение активности эластазы 1 считают самым «поздним» чувствительным тестом диагностики обострений ХП, поскольку повышенный уровень эластазы 1 крови сохраняется в течение 8—10 дней после атаки. В этот период активность эластазы 1 в крови повышена у 100 % больных, уровень липазы — у 85 %, имунореактивного трипсина — у 58 %, панкреатической изоамилазы — у 43 %, общей а—амилазы — у 23 % больных [73]. Разноречивы сведения о специфичности гиперэластаземии, в частности имеется мнение, что она не соответствует степени деструкции ткани ПЖ и не имеет большого диагностического значения при функциональной недостаточности у больных с многолетним ХП. Согласно мнению ряда авторов, тяжесть ОП или атаки ХП можно оценивать по уровню эластазы нейтрофилов в плазме крови [129, 167, 197, 231, 417], однако данный метод недоступен в большинстве лечебных учреждений. 5.3.1.6. Редко определяемые ферменты поджелудочной железы Реже используют определение активности в крови других ферментов: кар-боксипептидаз А и В, дегидрогеназ, нуклеаз, глутатионтрансферазы, гиалу-ронатэндоглюкоаминидазы, глицинамидинотрасферазы, холестеролэстера-зы, катепсинов В, D и L и др., однако методы изучения содержания этих ферментов в биологических жидкостях технически сложны, имеют высокую стоимость. Диагностическая информативность этих тестов далеко не всегда оправдывает сложность и стоимость их выполнения [19]. Перспективным, возможно, является изучение содержания в крови и моче пан-
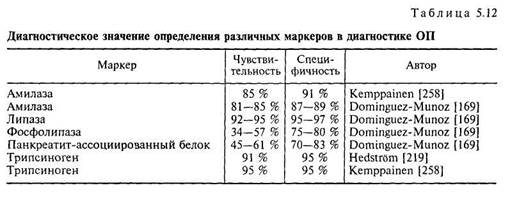
креатит-ассоциированного белка (см. главу 3). В табл. 5.12 представлены сводные данные о чувствительности и специфичности определения ряда панкреатических ферментов по результатам исследований наиболее авторитетных центров и авторов. 5.3.2. Оценка экзокринной функции поджелудочной железы Тесты, позволяющие оценить экзокринную функцию ПЖ, могут потребоваться для обоснования диагноза ХП. Они почти всегда комбинируются с ультразвуковыми, рентгенологическими и другими исследованиями, но могут применяться в диагностических целях и самостоятельно. Их можно разделить на две группы: тесты, требующие введения кишечного зонда, и неинвазивные беззондовые методы. Последние имеют явные преимущества в отношении удобства и минимального риска для пациента, кроме того, они менее дорогостоящие, чем тесты с использованием зондов. К сожалению, не существует беззондового теста, который успешно применялся бы как стандартный метод, все они имеют недостаточную чувствительность и специфичность. Почти все эти методы основываются на определении сниженной секреции панкреатических ферментов, однако ввиду низкой чувствительности они результативны лишь при очень значительном уменьшении ферментативной секреции. Проведение зондовых и беззондовых методов оценки экзокринной функции ПЖ не является обязательным для каждого гастроэнтерологического отделения; в каждом конкретном случае должен быть сделан необходимый выбор. В настоящее время, вероятно, вполне разумно стремление к осуществлению целого ряда визуальных методов исследования вместе с тестом Лунда (см. ниже) и одним неинвазивным беззондовым методом. В таких случаях визуальные исследования должны проводиться первыми с последующим выполнением функциональных тестов у больных с подозреваемым, но не подтвержденным, ХП [5]. 5.3.2.1. Зондовые методы
|
||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 685; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.137 (0.018 с.) |

 б) тесты на недорасщепленные и невсосавшиеся компоненты пищи в
б) тесты на недорасщепленные и невсосавшиеся компоненты пищи в ские ферменты [40]. В самом деле, доля панкреатических ферментов в составе химуса незначительна, поскольку панкреатический секрет содержит только 3,5 % белка, а большая часть панкреатических ферментов разрушается в двенадцатиперстной и тощей кишке [248, 271, 277].
ские ферменты [40]. В самом деле, доля панкреатических ферментов в составе химуса незначительна, поскольку панкреатический секрет содержит только 3,5 % белка, а большая часть панкреатических ферментов разрушается в двенадцатиперстной и тощей кишке [248, 271, 277]. нестрогую полярность транспорта секреторного продукта из ациноцитов, совмещение в одном ациноците экзо- и эндокринных функций путем выделения в качестве экзосекрета ферментов, а эндосекрета — гормонов. Уже тогда можно было допустить, что практически любой тип клеток может иметь в составе секрета специфические и неспецифические компоненты [40]. Время подтвердило этот принцип [39] и доказало, что многие клетки (лейкоциты, эндотелиоциты, миоциты предсердий и желудочков сердца, адипоциты и др.) синтезируют и выделяют физиологически активные вещества с теле-, пара- и аутогормональными эффектами.
нестрогую полярность транспорта секреторного продукта из ациноцитов, совмещение в одном ациноците экзо- и эндокринных функций путем выделения в качестве экзосекрета ферментов, а эндосекрета — гормонов. Уже тогда можно было допустить, что практически любой тип клеток может иметь в составе секрета специфические и неспецифические компоненты [40]. Время подтвердило этот принцип [39] и доказало, что многие клетки (лейкоциты, эндотелиоциты, миоциты предсердий и желудочков сердца, адипоциты и др.) синтезируют и выделяют физиологически активные вещества с теле-, пара- и аутогормональными эффектами. [40],связь амилаз с белками плазмы является одной из форм депонирования фермента, поддерживающего ферментный гомеостаз организма.
[40],связь амилаз с белками плазмы является одной из форм депонирования фермента, поддерживающего ферментный гомеостаз организма. ПЖ. При тяжелом, прогрессирующем течении ОП или обострении ХП активность амилазы может «истощаться» до нормальных и субнормальных величин [19, 64, 407]. В целом до 20 % пациентов с ОП могут иметь нормальные концентрации амилазы сыворотки крови [145]. В исследовании R. Pezzilli и соавт. [346] было определено, что по сывороточным уровням амилазы невозможно определить тяжесть текущего обострения панкреатита и ближайший прогноз.
ПЖ. При тяжелом, прогрессирующем течении ОП или обострении ХП активность амилазы может «истощаться» до нормальных и субнормальных величин [19, 64, 407]. В целом до 20 % пациентов с ОП могут иметь нормальные концентрации амилазы сыворотки крови [145]. В исследовании R. Pezzilli и соавт. [346] было определено, что по сывороточным уровням амилазы невозможно определить тяжесть текущего обострения панкреатита и ближайший прогноз.
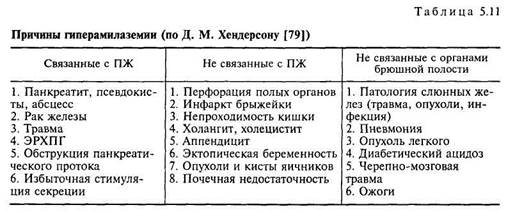
 перфорации язвы, кишечной инвагинации, перитоните, тромбозе брыжеечных сосудов, холецистите, холангите, паротите, почечной недостаточности, внематочной беременности, остром аппендиците, раке легких, диабетическом ацидозе, феохромоцитозе, после операций по поводу пороков сердца, после резекции печени, употребления препаратов опия, сульфаниламидов, тиазидных диуретиков, пероральных контрацептивов, причем других признаков панкреатита в этих случаях может не выявляться [19, 35, 73].
перфорации язвы, кишечной инвагинации, перитоните, тромбозе брыжеечных сосудов, холецистите, холангите, паротите, почечной недостаточности, внематочной беременности, остром аппендиците, раке легких, диабетическом ацидозе, феохромоцитозе, после операций по поводу пороков сердца, после резекции печени, употребления препаратов опия, сульфаниламидов, тиазидных диуретиков, пероральных контрацептивов, причем других признаков панкреатита в этих случаях может не выявляться [19, 35, 73]. Содержание иммунореактивного трипсина в сыворотке можно достаточно точно измерить, используя набор для радиоиммунного анализа (Ве-hringwerke, Marburg, GFR). Этот метод подробно описан В. Н. Stagg и Т. Р. Wood [383], но его клиническое применение, по-видимому, ограничено, так как накопленный опыт показал, что изменение сывороточного иммунореактивного трипсина недостаточно показательно для успешного использования его в качестве диагностического теста при ХП [5]. Однако существуют данные, что в ряде случаев при ОП и обострении ХП уровень имунореактивного трипсина в крови может увеличиваться в 20—70 раз [20, 218]. Отчасти низкая достоверность исследований обусловлена связыванием активного трипсина ингибиторами, основными из которых являются а)-антитрипсин и ос2-макроглобулин. В этом случае антитела, содержащиеся в соответствующих диагностических наборах, плохо «узнают» трипсин в комплексе с ингибиторами [19].
Содержание иммунореактивного трипсина в сыворотке можно достаточно точно измерить, используя набор для радиоиммунного анализа (Ве-hringwerke, Marburg, GFR). Этот метод подробно описан В. Н. Stagg и Т. Р. Wood [383], но его клиническое применение, по-видимому, ограничено, так как накопленный опыт показал, что изменение сывороточного иммунореактивного трипсина недостаточно показательно для успешного использования его в качестве диагностического теста при ХП [5]. Однако существуют данные, что в ряде случаев при ОП и обострении ХП уровень имунореактивного трипсина в крови может увеличиваться в 20—70 раз [20, 218]. Отчасти низкая достоверность исследований обусловлена связыванием активного трипсина ингибиторами, основными из которых являются а)-антитрипсин и ос2-макроглобулин. В этом случае антитела, содержащиеся в соответствующих диагностических наборах, плохо «узнают» трипсин в комплексе с ингибиторами [19]. В последние годы определенное значение в диагностике панкреатита, в определении прогноза и вероятности развития его осложнений придают исследованию концентрации в крови и моче фосфолипазы А2 [14].
В последние годы определенное значение в диагностике панкреатита, в определении прогноза и вероятности развития его осложнений придают исследованию концентрации в крови и моче фосфолипазы А2 [14]. ствительным тестом и в отношении экзокринной недостаточности ПЖ, поскольку степень снижения активности фермента в крови коррелирует с показателями секретин-панкреозиминового теста [19].
ствительным тестом и в отношении экзокринной недостаточности ПЖ, поскольку степень снижения активности фермента в крови коррелирует с показателями секретин-панкреозиминового теста [19].