
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Исходы хронического панкреатита
7.2.1. Экзокринная недостаточность поджелудочной железы В соответствии с материалом, представленным выше, синдром внешнесекреторной недостаточности ПЖ со временем развивается практически при всех этиологических формах панкреатита. Он обусловлен уменьшением массы функционирующей экзокринной паренхимы ПЖ в результате ее атрофии и фиброза либо нарушением оттока панкреатического секрета в двенадцатиперстную кишку при блоке выводных протоков ПЖ, обусловленным различными причинами [21], а также развитием дистрофических и атрофических изменений слизистой оболочки двенадцатиперстной кишки [1, 19]. В последнем случае уменьшается число I-клеток и S-клеток, секре-тирующих ХК и секретин соответственно, с последующим развитием ряда нарушений, включающих повышение давления в двенадцатиперстной кишке и в панкреатических протоках, спазм сфинктера Одди, снижение объема панкреатического секрета [31]. Поскольку в физиологических условиях ПЖ продуцирует в сутки около 2 л панкреатического сока, содержащего в 10 раз больше ферментов и зи-могенов, чем требуется для нормального переваривания пищи [63, 64] (физиологическая гиперсекреция), то ПЖ обладает огромной резервной возможностью секреции ферментов. Значит, для развития синдрома мальаб-сорбции секреторная возможность должна снизиться существенно, примерно до уровня 5—10 % от величины физиологической гиперсекреции, или, говоря другими словами, от «нормы», что и было показано в ряде экспериментальных и клинических исследований [10, 64, 66, 75, 84]. У больных ХП по мере увеличения длительности заболевания секреция ферментов все более уменьшается, причем дефицит липазы выражен в большей степени и развивается раньше, чем дефицит трипсина (см. разделы 3.2.6 и 6.2.3.2). Однако необходимо помнить, что клиническая манифестация экзокринной недостаточности ПЖ зависит от ряда вторичных факторов, включающих особенности гастроинтестинальной моторики, желудочной, били-арной и тонкокишечной секреции, абсорбции, секреции гормонов и последствий абдоминальной хирургии (состояние после резекции желудка и гастрэктомии, холецистэктомии, билиодигестивного шунтирования и др.). Таким образом, вполне обоснованным выглядит мнение о необходимости выделения двух типов панкреатической недостаточности — первичной и вторичной, причем у больных ХП вторичная панкреатическая недостаточность может развиться как на фоне сохранной экзокринной функции ПЖ, так и на фоне первичной внешнесекреторной недостаточности, значительно усугубляя ее.
Таким образом, развитие стеатореи при ХП в большей степени обусловлено нарушением панкреатического липолиза в результате снижения синтеза панкреатической липазы, нарушением секреции бикарбонатов с аци-дификацией двенадцатиперстной кишки и преципитацией желчных кислот.
7.2.2. Нарушения углеводного обмена Нарушение углеводного обмена различной степени выраженности у больных ХП обусловлено тем, что при ХП страдает не только ее экзокринная часть, но и островки Лангерганса, вырабатывающие инсулин и глюкагон. Однако необходимо учитывать и тот факт, что развитию нарушений углеводного обмена может способствовать не только абсолютный дефицит инсулина, вызванный деструкцией и склерозом инкреторного аппарата, но и конституционально обусловленная тканевая инсулинорезистентность, встречающаяся в популяции в 10—12 % случаев, а в группе лиц с ожирением — значительно чаще [27]. Интересна взаимосвязь ожирения и ХП и в том аспекте, что исходное ожирение отягощает течение панкреатита и дальнейший прогноз. Другими словами, по мере увеличения степени ожирения увеличивается риск развития осложнений ХП. Так, по данным J. Suazo-Barahona и соавт. при оценке зависимости между ожирением и развитием осложнений при первой атаке билиарного или алкогольного панкреатита у 150 больных было определено, что у пациентов с ИМТ более 25 осложнения отмечены в 38 % случаев, в то время как у лиц без ожирения (ИМТ менее 25) осложнения отмечались достоверно реже — в 21 % случаев. Развитие панкреонекроза отмечено у 17,6 % больных с ожирением, в то время как у больных ОП без ожирения панкреонекроз отмечен только в 6 % случаев [128].
Считается, что возможными механизмами эндокринной недостаточности при ХП могут быть и паракринные эффекты других гормонов, в частности половых, гормонов гипоталамуса и гипофиза, надпочечников, щитовидной и паращитовидной желез [7, 69]. Панкреатогенный диабет не следует ассоциировать с диабетом первого типа, при котором более 90 % р-клеток подвергаются деструкции в результате аутоиммунного процесса. Как правило, при ХП степень поражения инкреторного аппарата ПЖ менее выражена и сохраняется остаточная продукция инсулина. Это обусловливает относительно редкое возникновение кетоацидотических и гиперосмолярных состояний и нечастое прогрес-сирование микроангиопатии с развитием ретинопатии и нефропатии [15, 27]. Особенностью диабета при ХП является также хорошая переносимость гипергликемии до 200 мг% (11,5 ммоль/л) [15]. Клинические проявления нарушений углеводного обмена у больных ХП встречаются достаточно часто, особенно у пациентов с длительным анамнезом ХП, у больных, перенесших массивный панкреонекроз, и у пациентов после резекции ПЖ (панкреатэктомии), составляя в среднем 25 % случаев [14]. Однако нарушение толерантности к углеводам можно выявить у значительно большего числа больных уже на ранней стадии заболевания [15]. При этом важно знать, что именно нарушения углеводного обмена занимают одну из ведущих позиций в причинах снижения качества жизни больных ХП [113, 129]. 458 • ХРОНИЧЕСКИЙ ПАНКРЕАТИТ
Для устранения эндокринной недостаточности при обострении ХП используют дробные дозы простого инсулина, суточная потребность чаще всего не превышает 20—30 ЕД в зависимости от характера питания, количества вводимой глюкозы, физической активности больного и исходного уровня гликемии. При этом крайне опасно снижать уровень глюкозы в крови ниже 80 мг% (4,5 ммоль/л) из-за риска развития гипогликемии. В период ремиссии заболевания при стабилизации диабета возможна попытка перевода пациента на пероральные сахароснижаюшие препараты [31]. Существуют данные, что у больных с вторичным сахарным диабетом на фоне ХП отмечается улучшение состояния углеводного обмена при назначении заместительной терапии ферментами ПЖ, что выражается в стабилизации уровня глюкозы крови и гликозилированного гемоглобина [71, 100]. Это позволило некоторым авторам предлагать заместительную полиферментную терапию в качестве адъювантного метода лечения панкреатогенного сахарного диабета [100, 101].
Глава 7. Осложнения и исходы хронического панкреатита • 459
7.2.3.1. Панкреатит и рак поджелудочной железы— цепь последовательных событий или случайная взаимосвязь/ Как мы отмечали ранее, большинство этиологических факторов возникновения хронического панкреатита, соответствуют таковым при остром панкреатите, а переход острого панкреатита в хроническую форму подтверждается рядом клинических и экспериментальных исследований. Таким образом, острый и хронический панкреатиты, скорее всего, являются фазами одной болезни, составляя единый воспалительно-дегенеративный патологический процесс. Открытие наследственного механизма развития ХП внесло существенный вклад в понимание имеющейся взаимосвязи между ОП и ХП. В частности, идентифицированные мутации катионического трипсиногена, наследуемые по аутосомно-доминантному типу, приводят к замене аргинина на гистидин в положении R117H (R122H) аминокислотной последовательности фермента. Такая замена становится причиной неконтролируемой самоактивации трипсина и далее активации других зимогенов, что способствует развитию аутолиза ткани ПЖ. Наследственный панкреатит характеризуется повторными атаками ОП, которые диагностируются главным образом в детстве, а также в более позднем возрасте. В дальнейшем по мере прогрессирования процесса развивается хронический панкреатит, характеризующийся типичными признаками — кальцификацией, протоковыми изменениями, фиброзом, экзокринной недостаточностью ПЖ и сахарным диабетом.
В целом, наследственный панкреатит является идеальной моделью для реализации теории соотношения «некроза и фиброза», в частности того факта, как несколько эпизодов ОП могут вести к ХП. Возможно, что и при ненаследственном панкреатите одним из инициирующих моментов является внутрипротоковая активация трипсиногена. Первичная клеточная реакция характеризуется инфильтрацией мононуклеарами, стимулирующими дифференцировку и пролиферацию звездчатых клеток. Последние под воздействием трансформирующих ростовых факторов, выделяемых макрофагами в очаге воспаления, синтезируют коллаген, что в конечном итоге приводит к фиброзу и развитию ХП. С учетом приведенных выше данных, а также данных, последовательно изложенных нами в главах 2 и 3, можно заключить, что ассоциативная взаимосвязь между ОП и ХП существует, хотя патофизиологические механизмы перехода ОП в ХП могут быть различными, либо необходима их комбинация [20]. При многих заболеваниях, характеризующихся хроническим воспалением (хронический гастрит, неспецифический язвенный колит, болезнь Крона, пищевод Барретта, и т. д.), существует высокий риск развития злокачественных новообразований. Наиболее вероятной причиной является клеточная пролиферация и/или повреждение генома, вызванное воспалением [117]. Как показал рад исследований, проведенных в последние годы, такая взаимосвязь существует и в отношении рака ПЖ, развивающегося на фоне протекающего ХП. Первое сообщение, свидетельствующее о высоком риске развития рака ПЖ у больных ХП, было сделано G. Rocca и соавт. в 1987 г. [123]. После длительных дискуссий в течение нескольких лет, данная взаимосвязь была 460 • ХРОНИЧЕСКИЙ ПАНКРЕАТИТ
Во всех когортных исследованиях, проведенных до настоящего времени [39, 61, 83, 85, 88, 98, 123, 130], эта зависимость была неизменно подтверждена с незначительной вариацией полученных данных в пределах от 0,8 [88] до 8,3 % [39]. Результаты исследований типа случай—контроль, несколько менее надежных в этой области вследствие большего числа потенциально необъективных источников, тем не менее, также подтверждают эту взаимосвязь [68, 95]. К настоящему моменту однозначно определено, что риск развития рака ПЖ значительно зависит от этиологии ХП. Так, тропический панкреатит, патогенез которого до сих пор не известен, ассоциируется с развитием рака ПЖ более чем в 100 раз чаще относительно лиц без панкреатита [61]. При наследственном ХП также отмечен высокий риск развития рака ПЖ: приблизительно у 40 % пациентов развивается рак ПЖ к 70 годам [92], достигая в целом частоты 53 % [16]. Возможно, данные факты объясняются ранним возрастом клинической манифестации ХП и длительным течением заболевания. За последнее десятилетие, когда был расшифрован патогенез муковис-цидоза (аутосомно-рецессивный тип), было выявлено, что некоторые мутации трансмембранного регулятора кистозного фиброза могут приводить к развитию ХП, в то время как классическая картина муковисцидоза не развивается, что в целом значительно увеличивает продолжительность жизни больных. С другой стороны, совершенствование терапевтических подходов позволило существенно продлить жизнь больных с развернутой клинической картиной муковисцидоза до 50 лет и более [20]. Именно у этого контингента пациентов отмечен высокий риск рака ПЖ [108, 126]. При этом у больных муковисцидозом не отмечено увеличения частоты злокачественных опухолей в других органах-мишенях (легкие, билиарный тракт), что позволяет предполагать органоспецифичность онкологического процесса [20]. В заключение следует отметить, что существует определенная возможность развития ХП после перенесенного ОП; ХП в свою очередь выполняет роль «фона» для развития рака pancreas. Наиболее высокий риск развития рака ПЖ отмечается у больных наследственным и тропическим панкреатитом. Механизмы опухолевой трансформации при ХП мы кратко рассмотрим в следующем разделе. 7.2.3.2. Актуальность проблемы рака поджелудочной железы Нельзя не согласиться с мнением ряда авторов [32, 48, 60, 65], считающих рак ПЖ одним из наиболее загадочных и в то же время весьма агрессивных злокачественных заболеваний. В настоящее время рак ПЖ в реестре летальности от онкологических заболеваний в США переместился с пятого на четвертое место, причем за последние годы данный показатель не имеет даже тенденции к снижению [48, 60, 65, 107, 109, ПО], вызывая ежегодно
Пятилетняя выживаемость колеблется в пределах 1—5 %, в то время как средняя продолжительность жизни после установления диагноза составляет менее 6 мес [62, 74, 99, 127, 133]. Следует отметить, что данный показатель самый низкий в сравнении со всеми опухолями прочих локачизаций [122]. В России, к сожалению, данные по смертности от рака ПЖ не доступны из-за того, что эти показатели включены в сборную группу «опухоли других органов пищеварения и брюшины» [4]. Практически все пациенты погибают в результате профессирования рака и возникающих осложнений в течение года от момента установления диагноза, несмотря на введение новых методов диагностики, причем аналогичная картина наблюдалась и 15 лет тому назад [72, 109]. Среди больных с метастазами в отдаленные органы и ткани медиана выживаемости с момента установления диагноза не превышает 4 мес [36]. Отчасти это обусловлено поздней диагностикой (до сих пор в 90 % случаев рак ПЖ диагностируется на поздних стадиях), ранним метастазированием и низкой эффективностью стандартной терапии [45, 79, 82]. P. M. Pour в известной статье с одноименным названием назвал рак ПЖ «тихим убийцей» ввиду атипичности клинической картины, длительного латентного периода, быстрого профессирования и отсутствия реальных подходов к лечению этого заболевания [116]. Существует мнение, что высокая степень злокачественности рака ПЖ и быстрота метастазирования обусловлена, прежде всего, дисбалансом цитокинов и изменениями в ключевых генах, вовлеченных в управление клеточным циклом [43, 76, 78, 139], преимущественно K-ras [104], о которых мы сообщали ранее. Заболеваемость раком ПЖ составляет около 9,5—11 на 100 000 населения в год; заболевание возникает в среднем в 55 лет, у мужчин в 1,5—2 раза чаще, чем у женщин [24]. Рак ПЖ наиболее распространен в экономически развитых странах и, наоборот, реже встречается в африканских странах, Индии, Вьетнаме, Южной Америке. Возможно, что разница в заболеваемости не истинная и обусловлена трудностями распознавания [112]. В странах Европы наибольшая заболеваемость отмечается в Дании, Ирландии, Великобритании, наименьшая — в Испании, Португалии, Греции при пятилетней выживаемости менее 5 % [4]. 7.2.3.3. Рак поджелудочной железы: этиология и механизмы канцерогенеза Хотя эпидемиологические исследования свидетельствуют о роли ХП в качестве «фона» для развития рака ПЖ, точные патофизиологические механизмы опухолевой трансформации до сих пор неизвестны. Недавние исследования выявили несколько молекулярных процессов, реализующих патогенез рака ПЖ [45, 46, 70, 93, 97, 135, 136]. В 70 % случаев отмечаются мутации гена опухолевой супрессии р53, в 71 — 100 % случаев — мутации в 12-м кодоне онкогена K-ras (табл. 7.3), кодирующего бе-
лок, гомологичный эпидермальному и трансформирующему факторам роста [7, 52, 81, 86]. Недавно описаны мутации в кодонах 13 и 61, которые также приводят к аминокислотной замене в этом белке [52, 86, 87]. Столь высокая распространенность мутации K-ras до настоящего момента не идентифицирована при других опухолях у человека, что предполагает определенную специфичность этой мутации для рака ПЖ [35]. При анализе 12-го кодона в первой или второй базе у больных с K-ras мутацией выявлены нуклеотидные замены, в частности, GGT (глицин) -> GTT (валин); GGT (глицин) -> AGT (серии); GGT (глицин) -> GAT (аспа-рагиновая кислота) или GGT (глицин) -> CGT (аргинин), что может предшествовать развитию злокачественного процесса [35]. Следует отметить, что мутации онкогена K-ras встречаются не только в опухолевых клетках, но и в прилежащих к опухоли тканях, а также при ХП
в зонах гиперплазии эпителия протоков [4, 47, 52]. Последний факт косвенно подтверждает взаимосвязь ХП и рака ПЖ, поскольку мутация гена K-ras проявляется проопухолевым действием. В этом ключе становится понятно, почему при наследственном и хроническом панкреатите значительно повышается риск развития рака ПЖ(рис. 7.1). Однако существуют данные исследова- Глава 7. Осложнения и исходы хронического панкреатита • 463
больных (25 человек) и особенностями забора материала для исследования (авторами проводилась пункционная биопсия ПЖ). На данный момент не найдено связи между степенью распространения рака (стадии) и характером течения (очень агрессивное или медленное) [52, 82, 102, 103]. Однако появляются единичные сообщения о прогностическом значении мутации K-ras. Так, по данным японских исследователей медиана выживаемости у больных раком ПЖ при наличии мутации K-ras составила 8,2 мес, в то время как при ее отсутствии — 12,5 мес [105]. Мутации генов р53, р1б и DPC4, являющихся супрессорами опухолевого роста, приводят к несостоятельности функции этих генов и потенцированию неопластических процессов за счет нарушений в процессе деления клеток. Одним из наиболее изученных генов-супрессоров опухоли является ген р53. В норме он вызывает остановку деления поврежденной клетки с целью исправления ДНК (действует как ДНК-зависимый транскрипционный активатор на переходе от G1- к S-фазе), а в ряде случаев при невозможности исправления повреждения приводит к апоптозу и гибели этой клетки, что позволило образно назвать ген р53 «стражем генома». Таким образом, мутация гена р53 при длительном воспалительном процессе приводит к ингибированию апоптоза [18]. Нарушается природный антагонизм генов, регулирующих апоптоз — р53 и bcl2, c-fos, c-myc; последние реализуют свои ингибирующие эффекты через гиперпродукцию эпидермальных, тромбоцитарных и трансформирующих ростовых факторов. Извращается регенерация, усиленно пролиферируют генетически измененные клетки, удлиняется общая продолжительность жизни клеток и увеличивается вероятность возникновения в них изменений [7]. Все это в конечном итоге способствует предне-опластической, а затем и неопластической пролиферации (рис. 7.2). Действительно, множеством исследований доказано развитие гиперпластических процессов в эпителии ПЖ при ХП и НП, что также подтверждает взаимосвязь ХП и рака ПЖ. Кроме того, можно считать доказанным, что у пациентов с этими мутациями значительно снижен процент выживаемости по сравнению с пациентами, у которых мутации не выявляются [33, 59]. В целом, дефекты гена р-53 приводят к ослаблению контроля клеточ- 464 • ХРОНИЧЕСКИЙ ПАНКРЕАТИТ
Ген DPC4 («deleted in pancreatic cancer»), или ген «уничтожающий рак поджелудочной железы», локализован в 18-й хромосоме и является медиатором трансформирующего фактора роста р [34] и гена р-16 [58]. Наличие мутаций этого гена часто встречается не только у больных раком ПЖ, но и при колоректальном раке, раке желудка и эндометрия [57, 59, 138]. Описанные осложнения и исходы ХП в значительной степени могут определять как клиническую картину, прогноз заболевания, качество жизни больных, так и тактику лечения. Несмотря на то что большинство осложнений ХП требуют лечения в хирургической клинике, существенная часть из них может быть исключена вследствие консервативных мероприятий при совместном участии гастроэнтерологов и хирургов. Кроме того, серьезность ряда осложнений, требующих хирургического лечения, определяет необходимость как можно более ранней их диагностики. Вот почему знание особенностей клиники и диагностики ХП врачами терапевтического профиля может способствовать своевременному выявлению осложнений этого заболевания и проведению хирургического лечения, что может значительно улучшить прогноз у таких пациентов. СПИСОК ЛИТЕРАТУРЫ 1. Белоусова Е. А., Златкина А. Р., Морозова Н. А., Тишкина Н. И. Старые и новые ас 2. Буеверов А. О. Печеночная энцефалопатия: клинические варианты и терапевтиче 3. Васильев Ю. В. Печеночная энцефалопатия // Consilium medicum.— 2002.— 4. Гарин А. М., Базин И. С. Рак поджелудочной железы (значение проблемы, возмож 5. Гарин А. М., Базин И. С. Злокачественные опухоли пищеварительной системы.— М.: 6. Гребенев А. Л. Хронические панкреатиты.— В кн.: Руководство по гастроэнтероло 7. Губергриц Н. Б., Христич Т. Н. Клиническая панкреатология — Донецк: ООО «Ле 8. Данилов М. В., Буриев И. М. Лечение наружных панкреатических свищей.— В кн.: 9. Данилов М- В., Федоров В. Д. Хирургия поджелудочной железы: Рук-во для врачей,— М.: Медицина, 1995.—512 с. 10. ДиМагно Е. П. Межпищеварительная и стимулированная экзокринная панкреатиче 11. Ивашкин В. Т., Надинская М. Ю., Буеверов А. О. Печеночная энцефалопатия и мето 12. Ивашкин В. Т., Хазанов А. И., Пискунов Г. Г. и др. О классификации хронического 13. Костюченко А, Л., Филин В. И. Неотложная панкреатология: справочник для вра 14. Кузин М. И., Дашьюв М. В., Благовидов Д. Ф. Хронический панкреатит.— М.: Меди Глава 7. Осложнения и исходы хронического панкреатита • 465 15. 16. Маев И. В. Наследственный панкреатит // Рос. журн. гастроэнтерол., гепатол., ко- 17. Маев И. В., Вьючнова Е. С, Стасева И. В. Применение препарата Ь-орнитин-L-ac- 18. Маев И. В., Говорун В. М. Достижения молекулярной генетики в области гастроэнте 19. Маев И. В., Казюлин А. Н., Дичева Д. Т.и др. Хронический панкреатит: Учебное по 20. Маев И. В., Кучерявый Ю. А. Острый и хронический панкреатит, рак поджелудочной 21. Маев И. В., Кучерявый Ю. А. Синдром внешнесекреторной недостаточности под 22. Минушкин О. Н. Хронический панкреатит: некоторые аспекты патогенеза, диагно 23. Нестеренко Ю. А., Глабай В. П., Шаповальянц С. Г. Хронический панкреатит: Моно 24. Охлобыстин А. В., Ивашкин В. Т. Рак поджелудочной железы.— В кн.: Краткое руко 25. Подьшова С. Д. Болезни печени.— М., 1998,— 625 с. 26. Подьшова С. Д. Печеночная энцефалопатия. Клинические особенности, диагности 27. Раков А. Д., Захаров А. П., Жуков С. А., Чугунова Л. Г. Нарушение инкреторной 28. Хазанов А. И., Ивлев А. С, Пискунов Г. Г. и др. Осложненные формы хронического 29. Циммерман Я. С. Принципы построения рабочей классификации хронического пан 30. Цодиков Г. В., Богомолов П. О. Печеночная энцефалопатия: патофизиологические 31. Яковенко А.В. Клиника, диагностика и лечение хронического панкреатита // Клин, 32. Abbruzzese J. L. Past and present treatment of pancreatic adenocarcinoma: chemotherapy 33. AGA Technical Review on Hereditary Colorectal Cancer and Genetic Testing. This litera 34. Alexandrow M. G, Moses H. L. Transforming growth factor beta and cell cycle regulation / 35. Almoguera C, Shibata D., Forrester K. et al. Most human carcinomas of the exocrine pan 36. Alter С Palliative and supportive care of patients with pancreatic cancer // Semin. On 37. American Cancer Society. Cancer Facts and Figures 2004,—Atlanta, GA, USA: American 38. Arancha G. V., Prinz R. A., Greenlee H. B. et al. Gastric outlet and duodenal obstruction 39. Augustine P., Ramesh H. Is tropical pancreatitis premalignant? // Am. J. Gastroenterol.— 40. Banerjee M., Bhonde R. R. Islet generation from intra islet precursor cells of diabetic pan- 466 • ХРОНИЧЕСКИЙ ПАНКРЕАТИТ
41. Banks P. Pancreatic pseudocysts // Bockus Gastroenterology.—5th ed.—Philadelphia et 42. Banks P. A. Pancreatitis.— New Work — London: plenum Med Book Co., 1979.— 236 p. 43. Basso D., Plebani M. Cytokines and exocrine pancreatic cancer: is there a link? // JOP. J 44. Beattie G. M., Montgomery A. M., Lopez A. D. et al. A novel approach to increase human 45. Berberat P. O., KleeffJ., Ding J. et al. Differential gene expression between chronic pancre 46. Berger D. H., Chang H., Wood M. et al. Mutational activation of K-ras in nonneoplastic 47. Berthelemy P., Boussion V., Escourrou J. E. et al. Identification of K-ras mutation in pan 48. Blackstock A. W., Сох А. D., Tepper J. E. Treatment of pancreatic cancer: current limita 49. Bonner-Weir S. Perspective: postnatal pancreatic beta cell growth // Endocrinology.— 50. Bonner-Weir S., Baxter L. A., Schuppin G. Т., Smith F. E. A second pathway for regenera 51. Bonner-Weir S., Taneja M., Weir G. С et al. In vitro cultivation of human islets from ex 52. Bos J. L. ras oncogenes in human cancer: a review // Cancer Res.— 1989.— Vol. 49.— P. 53. Bouwens L., Pipeleers D. G. Extra-insular beta cells associated with ductules are frequent in 54. Bradley E. L. 3rd. A clinically based classification system for acute pancreatitis // Arch. 55. Bradley E. L., Clements J. L., Gonzales A. C. The natural history of pancreatic pseudocysts: 56. Breslin N., Wallace M. B. Diagnosis and fine needle aspiration of pancreatic pseudocysts: 57. Burt R. W. Genetic testing for GI cancer susceptibility // AGA Postgraduate Course.— 58. Caldas C, Hahn S. A., da Costa L. T. et al. Frequent somatic mutations and homozygous 59. Calvert P. M., Frucht H. The genetics of colorectal cancer // Ann. Intern. Med.— 2002.— 60. Cameron J. L., Pitt H. A., Yeo С J. et al. One hundred and forty-five consecutive pancre- 61. Chari S. Т., Mohan V., Pitchumoni С S. et al. Risk of pancreatic carcinoma in tropical cal 62. Connolly M. M., Dawson P. J., Michelassi F. et al. Survival in 1001 patients with carcinoma 63. DiMagno E. P., Clain J. E., Layer P. Chronic pancreatitis.— In: Go V. L. W. et al. The 64. DiMagno E. P., Go V. L. W., Summerskill W. H. J. Relationship between pancreatic en 65. Doll R., Peto R. Mortality in relation to smoking: 20 years observations on male British 66. Dutta S., Hubbard V., Appier M. Critical evaluation of the therapeutic efficacy of a pH sensi Глава 7. Осложнения и исходы хронического панкреатита • 467 67. 68. Fernandez E., La Vecchia C, Porta M. et al. Pancreatitis and the risk of pancreatic cancer // 69. Fyssas I., Syrigos K. N., Konstandoulakis M. M. et al. Sex hormone levels in the serum if 70. 71. Glasbrenner B. et al. Influence of pancreatic enzyme supplementation on diabetes mellitus 72. Greenlee R. Т., Hill-Harmon M., Murray Т., Thun M. Cancer statistics, 2001 // CA Cancer 73. Guz Y., Nasir I., Teitelman G. Regeneration of pancreatic beta-cells from intra-islet precur 74. Hunstad D. A., Norton J. A. Management of pancreatic carcinoma // Surg. Oncol.— 75. Ihse I., Arnesjoe В., Kugelberg С et al. Intestinal activities of trypsin, lipase and phospholi- 76. Ishiwata Т., Bergman U., Kornmann M. et al. Altered expression of insulin-like growth 77. Kastan M. В., Onyekwere O., Sidransky D. et al. Participation ofp-53 protein in the cellular 78. Kern S. E. Advances from genetic clues in pancreatic cancer // Current Opinion in Oncol 79. KleeffJ., Friess H., Berberat P. O. et al. Pancreatic cancer-new aspects of molecular biology 80. Kloppel G. Pseudocysts and other non-neoplastic cysts of the pancreas // Semin. Diagn. 81. Kubrusly M. S., Matheucci E. J., Leite K. R. M. et al. Detection of codon 12 mutation in 82. Kubrusly M. S., Monteiro Cunha J. E., Bacchella T. et al. Detection of K-ras point muta 83. Lankicsh P. G, Loehr-Happe A., Otto J., Creutzfeldt W. Natural course in chronic pancre 84. Lankisch P. G., Creutzfeldt W. Therapy of exocrine and endocrine pancreatic insufficien
|
|||||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 469; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.121.160 (0.112 с.) |

 Глава 7. Осложнения и исходы хронического панкреатита • 457
Глава 7. Осложнения и исходы хронического панкреатита • 457 Недостаточность экскреторной функции ПЖ приводит к синдрому мальабсорбции и трофологической недостаточности. Упорные поносы с обильным жидким стулом вызывают дегидратацию больного, при выраженной экзокриннои недостаточности ПЖ закономерно развиваются нарушения, усугубляющие течение основного заболевания. Наиболее подробно диагностика и лечение экзокриннои недостаточности представлены в главах 5 и 6 монографии.
Недостаточность экскреторной функции ПЖ приводит к синдрому мальабсорбции и трофологической недостаточности. Упорные поносы с обильным жидким стулом вызывают дегидратацию больного, при выраженной экзокриннои недостаточности ПЖ закономерно развиваются нарушения, усугубляющие течение основного заболевания. Наиболее подробно диагностика и лечение экзокриннои недостаточности представлены в главах 5 и 6 монографии. Синдром эндокринных нарушений проявляется в двух вариантах — ги-перинсулинизма и панкреатогенного сахарного диабета [7, 13, 23, 42, 83] и подробно представлен нами в разделе 5.1.1.3.
Синдром эндокринных нарушений проявляется в двух вариантах — ги-перинсулинизма и панкреатогенного сахарного диабета [7, 13, 23, 42, 83] и подробно представлен нами в разделе 5.1.1.3. У больных с тяжелым сахарным диабетом может быть перспективной трансплантация донорских островков или островковых клеток [40]. Однако главная проблема, возникающая при трансплантация донорских островковых клеток, состоит в том, что (3-клетки имеют ограниченный, если таковой вообще имеется, пролиферативный потенциал, а экспериментальные исследования, посвященные попытке размножения р-клеток в культуре, остались неудачными. В литературе широко представлено мнение, основанное на феномене островкового неогенеза, суть которого составляет существование в ПЖ клеток-предшественников [40, 49, 51, 53, 73, 115, 119, 124]. Как известно, островковый неогенез может быть вызван экспериментально на различных моделях [67, 125], а также был описан при беременности [49J. Кроме того, выделен белок, стимулирующий островковый неогенез и названный протеином, ассоциированным с ост-ровковым неогенезом (islet neogenesis associated protein, INGAP). Эти открытия привели к последующему клонированию данного белка [118, 124], однако до сих не известно, какая из клеток паренхимы ПЖ является потенциальной клеткой-предшественницей островковых клеток, и этот вопрос является темой оживленных дискуссий. Ряд исследователей [49, 124] считают потенциальным источником клеток-предшественников протоко-вый эпителий, опираясь на известный факт о тесной эмбриональной взаимосвязи клеток островкового и протокового эпителия [96] и результаты единичных экспериментальных исследований [51, 53, 115, 119]. Другие считают сам островок зоной потенциальной локализации клеток-предшественников [40, 73]. Имеющиеся в настоящее время данные позволяют рассчитывать на появление в ближайшем будущем применимых к широкой практике методик специфической стимуляции клеток ПЖ с целью трансформации их в функционально активные р-клетки [40]. Данный подход может быть перспективно применен и к трансплантированным островковым клеткам [44], устраняя необходимость трансплантации большого числа островков.
У больных с тяжелым сахарным диабетом может быть перспективной трансплантация донорских островков или островковых клеток [40]. Однако главная проблема, возникающая при трансплантация донорских островковых клеток, состоит в том, что (3-клетки имеют ограниченный, если таковой вообще имеется, пролиферативный потенциал, а экспериментальные исследования, посвященные попытке размножения р-клеток в культуре, остались неудачными. В литературе широко представлено мнение, основанное на феномене островкового неогенеза, суть которого составляет существование в ПЖ клеток-предшественников [40, 49, 51, 53, 73, 115, 119, 124]. Как известно, островковый неогенез может быть вызван экспериментально на различных моделях [67, 125], а также был описан при беременности [49J. Кроме того, выделен белок, стимулирующий островковый неогенез и названный протеином, ассоциированным с ост-ровковым неогенезом (islet neogenesis associated protein, INGAP). Эти открытия привели к последующему клонированию данного белка [118, 124], однако до сих не известно, какая из клеток паренхимы ПЖ является потенциальной клеткой-предшественницей островковых клеток, и этот вопрос является темой оживленных дискуссий. Ряд исследователей [49, 124] считают потенциальным источником клеток-предшественников протоко-вый эпителий, опираясь на известный факт о тесной эмбриональной взаимосвязи клеток островкового и протокового эпителия [96] и результаты единичных экспериментальных исследований [51, 53, 115, 119]. Другие считают сам островок зоной потенциальной локализации клеток-предшественников [40, 73]. Имеющиеся в настоящее время данные позволяют рассчитывать на появление в ближайшем будущем применимых к широкой практике методик специфической стимуляции клеток ПЖ с целью трансформации их в функционально активные р-клетки [40]. Данный подход может быть перспективно применен и к трансплантированным островковым клеткам [44], устраняя необходимость трансплантации большого числа островков. 7.2.3. Рак поджелудочной железы
7.2.3. Рак поджелудочной железы оценена в мультицентровом исследовании А. В. Lowenfels и соавт. [91]. Результаты оказались весьма впечатляющими — приблизительно у 4 % пациентов с ХП развивается рак ПЖ в течение 20 лет от начала болезни, что в 15—16 раз превышает частоту развития рака ПЖ в общей популяции. Двумя годами позже американские ученые подтвердили эти результаты в ретроспективном изучении данных, взятых из отчетов Американского отдела дел ветеранов (American Department of Veterans) с 1970 по 1994 г. [95].
оценена в мультицентровом исследовании А. В. Lowenfels и соавт. [91]. Результаты оказались весьма впечатляющими — приблизительно у 4 % пациентов с ХП развивается рак ПЖ в течение 20 лет от начала болезни, что в 15—16 раз превышает частоту развития рака ПЖ в общей популяции. Двумя годами позже американские ученые подтвердили эти результаты в ретроспективном изучении данных, взятых из отчетов Американского отдела дел ветеранов (American Department of Veterans) с 1970 по 1994 г. [95]. Глава 7. Осложнения и исходы хронического панкреатита • 461
Глава 7. Осложнения и исходы хронического панкреатита • 461 только в США более 24 000 летальных случаев [72]. Аналогичная картина наблюдается и в ряде европейских стран [5]. В 2000 г. во всем мире зарегистрировано 216 400 случаев впервые выявленного рака ПЖ и 213 500 летальных исходов от этого заболевания [111]. Прогностический анализ, проведенный в США, показал, что в 2004 г. будет выявлено не менее 31 860 случаев рака ПЖ и зарегистрировано не менее 31 270 летальных исходов этого заболевания [37].
только в США более 24 000 летальных случаев [72]. Аналогичная картина наблюдается и в ряде европейских стран [5]. В 2000 г. во всем мире зарегистрировано 216 400 случаев впервые выявленного рака ПЖ и 213 500 летальных исходов от этого заболевания [111]. Прогностический анализ, проведенный в США, показал, что в 2004 г. будет выявлено не менее 31 860 случаев рака ПЖ и зарегистрировано не менее 31 270 летальных исходов этого заболевания [37]. 462 • ХРОНИЧЕСКИЙ ПАНКРЕАТИТ
462 • ХРОНИЧЕСКИЙ ПАНКРЕАТИТ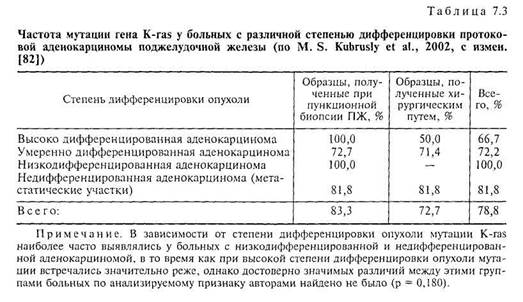


 ний М. S. Kubrusly и соавт. (2002), свидетельствующие об отсутствии мутации К-ras у больных ХП и нейроэндокринными опухолями ПЖ [82]. Что касается последней нозологии, факт отсутствия мутации K-ras вполне возможен, в то время как отсутствие мутации K-ras при ХП не совсем понятно. Возможно, это связано с небольшим количеством обследованных
ний М. S. Kubrusly и соавт. (2002), свидетельствующие об отсутствии мутации К-ras у больных ХП и нейроэндокринными опухолями ПЖ [82]. Что касается последней нозологии, факт отсутствия мутации K-ras вполне возможен, в то время как отсутствие мутации K-ras при ХП не совсем понятно. Возможно, это связано с небольшим количеством обследованных ной пролиферации, снижению дифференцировки клеток и укорочению сроков жизни больных этой формой рака [77, 106, 120].
ной пролиферации, снижению дифференцировки клеток и укорочению сроков жизни больных этой формой рака [77, 106, 120]. Gerdes В., Ramaswamy A., Kersting M. et al. pl6 (INK4a) alterations in chronic pancreati
Gerdes В., Ramaswamy A., Kersting M. et al. pl6 (INK4a) alterations in chronic pancreati


