
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Поширення у природі та способи добування алканівСодержание книги
Поиск на нашем сайте
Алкани широко розповсюджені в природі. Здебільшого вони знаходяться у певних видах нафти, у природних та супутніх газах. Тверді насичені вуглеводні є головною складовою частиною бітумів, асфальтів, озокериту (гірський віск). Основними способами промислового добування алканів із природних джерел є виділення їх у вигляді сумішей (фракцій) або індивідуальних сполук за допомогою, як правило, розгонки або ректифікації. Найважливішим синтетичним методом одержання алканів є синтез Вюрца (1855р.) — взаємодія галогеналкілів з металічним натрієм:
Алкани також можна добути із солей карбонових кислот, гідруванням ненасичених вуглеводнів, відновленням галогенопохідних. Фізичні та хімічні властивості алканів Закономірності зміни фізичних властивостей в гомологічному ряду і залежно від структури ізомерів. Інертність у хімічному відношенні — за звичайних температур не окиснюються, не взаємодіють із концентрованою сульфатною кислотою та деякими іншими реагентами. Якісна реакція — алкани не знебарвлюють бромну воду та розчин калій перманганату. За певними умовами алкани вступають у реакції заміщення, окиснюються, за високих температур без доступу повітря відбувається крекінг і піроліз. Реакції заміщення Відбуваються за радикальним механізмом 1. Галогенування
За таким же механізмом відбуваються реакції нітрування, сульфування та сульфохлорування. 2. Нітрування — реакція Коновалова, 1889 р.:
3. Сульфування — при взаємодії з димлячою сульфатною кислотою:
4. Сульфохлорування — дія на алкани сумішшю сірчистого газу та хлору:
Сульфохлориди можна розглядати як хлорангідриди сульфокислоти, тому вони легко гідролізуються до сульфокислот
Натрієві солі цих кислот називаються сульфонатами. Практичне значення мають сульфонати з числом атомів Карбону Окиснення алканів За звичайних умов алкани стійкі до дії окисників, а в умовах нагрівання окиснюються з розривом карбонового ланцюга і утворенням різноманітних кисневмісних продуктів. Розроблено метод окиснення вищих насичених вуглеводнів під дією кисню повітря з метою добування вищих жирних кислот для миловаріння. Реакція відбувається з розривом карбонового ланцюга (реакція Намьоткіна):
Повне окиснення — горіння. Підпалені на повітрі, вуглеводні горять, перетворюючись на Крекінг, піроліз Нагрівання вуглеводнів до високих температур (300°С ‑700°С, 1000°С) без доступу повітря призводить до їх розкладу, що супроводжується розривом карбонових ланцюгів і утворенням значно простіших насичених та ненасичених вуглеводнів. У цьому випадку відбувається гомолітичний розрив зв’язків С-Н і С-С. Може відбуватись також дегідрування, ізомеризація, циклізація та ароматизація вуглеводнів. Крекінг має велике практичне значення. Реакція крекінгу важких фракцій нафти широко використовується для одержання алканів збагачених більш легкими фракціями - бензинів та газоподібних продуктів.
|
|||||||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 874; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.129.210.35 (0.007 с.) |


 .
.


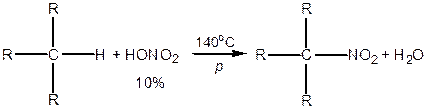


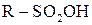 (
( ).
).
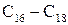 вони входять до складу синтетичних миючих засобів.
вони входять до складу синтетичних миючих засобів.
 і
і  із виділенням великої кількості тепла. Реакція широко застосовується в енергетичних, а не в хімічних цілях. Таке згоряння палива відбувається у двигунах всіх типів.
із виділенням великої кількості тепла. Реакція широко застосовується в енергетичних, а не в хімічних цілях. Таке згоряння палива відбувається у двигунах всіх типів.


