
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Електрохімічні процеси у розчинах електролітівСодержание книги
Поиск на нашем сайте
У розчинах електролітів перебігає низка самочинних процесів: дисоціація, сольватація, міжіонна взаємодія і т.д. При цьому дуже важко визначити реальну концентрацію електроліту: кількість іонів у розчині визначається внеском кожного з факторів. Тому замість звичайної концентрації введено поняття "активної концентрації", або активності. Активність – це фізична величина, підстановка якої замість концентрації у будь-які рівняння та закони, що описують властивості розчинів, робить їх придатними для розчинів електролітів. Величина активності відрізняється від значень концентрації на коефіцієнт активності: a = с × g, (7.1) де g – коефіцієнт активності, який безпосередньо враховує взаємодію між іонами. Значення коефіцієнтів активності електролітів залежать від загальної концентрації всіх іонів, присутніх у розчині, та їх валентності. У зв’язку з цим було введене поняття “ іонної силирозчину ”:
Рівняння, за яким визначають коефіцієнти активності електролітів має вигляд:
де nk і na – заряди катіону і аніону; І – іонна сила електроліту; А – стала, що залежить від природи розчинника, зокрема для води за Т = 298 К А = 0,51. Електроди Електродом називають сукупність двох контактуючих фаз, одна з яких є провідником ІІ-го роду (електролітом), а друга – провідником І-го роду, наприклад металом. Метали – це кристалічні речовини, у вузлах кришталевих ґраток яких розташовані катіони металу, а відповідна кількість узагальнених електронів вільно рухається по об’єму металу. За рахунок некомпенсованого обміну катіонами між металом та електролітом на металі виникає заряд. Активні метали звичайно заряджаються негативно, малоактивні – позитивно. За наявності заряду до поверхні металу наближаються іони протилежного знаку, утворюючи на поверхні розділу метал/електроліт подвійний електричний шар іонів. Між електродом і електролітом виникає різниця потенціалів – e, яка вимірюється у вольтах. Величина потенціалу залежить від природи металу і концентрації іонів в електроліті і розраховується за допомогою рівняння Нернста. Усі електроди можна поділити на декілька типів. Електрод І роду за будовою являє собою метал, занурений в електроліт, що містить катіони цього металу. Електрод І роду можна представити у вигляді схеми: МеlМе n +. На поверхні металу перебігає електродна реакція: Ме n+ + n ē ⇄ Me0 Рівняння, за яким визначають потенціали електродів І-го, має такий вигляд:
де eо – стандартний потенціал електроду, В; n – число електронів, що беруть участь в електродній реакції; F – число Фарадея; a – активність катіонів металу в розчині. Електрод ІІ роду за будовою являє собою метал, вкритий малорозчинною сполукою цього метала і занурений в електроліт, що містить аніони цієї сполуки. Величина потенціалу електродів ІІ-го роду залежить від активності аніонів, які беруть участь в електродній реакції.
де a – активність аніонів у розчині. Хлорсрібний електрод Ag,AgCllКСl – найбільш поширений з електродів ІІ-го роду. На його поверхні перебігає електрохімічна реакція: AgCl(т) + ē ⇄ Ag(т) + Cl–. Окисно-відновний електрод за будовою являє собою пластину інертного металу, занурену в електроліт, що містить окисник і відновник. Потенціал електроду визначається типом ОВР, що перебігає на електроді і розраховується за рівнянням:
де aok – активність речовини-окисника; aв – активність речовини-відновника. Електрохімічні системи Електрохімія – наука, що вивчає взаємне перетворення хімічної і електричної енергії під час перебігу хімічних реакцій в електрохімічних системах. Будь-яка електрохімічна система складається з 3-х основних частин: електроліту; електродів і зовнішнього ланцюгу – металічних провідників, що з’єднують електроди. Так, елемент Даніеля-Якобі складається з двох металів – міді і цинку, занурених у розчини власних солей. Електроліти розділені мембраною, що не дозволяє електролітам перемішуватися. Схематично елемент записують так: (–) ZnlZnSO4llCuSO4lCu (+), a 1 a 2 де a 1 і a 2 – активності розчинів ZnSO4 і CuSO4 відповідно. Цинк, як більш активний метал, придбає більш негативний заряд ніж мідь. Якщо метали з’єднати дротом, то електрони будуть переходити від цинку до міді. Цинк почне розчинятися і переходити у розчин у вигляді іонів, а на мідному електроді будуть розряджатися іони Купруму, що знаходилися в розчині CuSO4. У системі при цьому виникає процес, що складається з двох електродних реакцій: Zn0 – 2ē = Zn+2; Cu+2 + 2ē = Cu0. Різницю електродних потенціалів в елементі називають електрорушійною силою, Е = e +– e –. Рівняння Нернста, за яким визначають ЕРС, має такий вигляд:
де Е 0 – стандартна ЕРС елементу, що працює за Т = 298 К і активності іонів електроліту рівних 1 моль/л.
|
||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 437; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.114.198 (0.007 с.) |

 . (7.2)
. (7.2)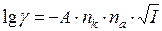 , (7.3)
, (7.3)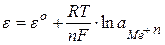 , (7.4)
, (7.4) , (7.5)
, (7.5) , (7.6)
, (7.6) . (7.7)
. (7.7)


