
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Швидкість та механізм хімічних реакцій. Вплив різних факторів на швидкість реакції. Здм
Швидкість хімічної реакції визначається зміною концентрації однієї з реагуючих речовин за одиницю часу за незмінному об’єму системи. Якщо в момент часу
виражає середню швидкість реакції
Чим менше проміжок часу Швидкість кожної реакції залежить від природи реагуючих речовин, від їх концентрації та від умов, в яких реакція перебігає (температура, тиск, присутність каталізаторів). Дуже важливе положення було встановлено в 1867 р. двома вченими Гульдбергом і Вааге та одержало назву закон діючих мас (ЗДМ): швидкість хімічної реакції за сталої температури пропорційна добутку концентрацій реагуючих речовин, зведених у степені їхніх стехіометричних коефіцієнтів. Так, для гомогенної реакції типу:
швидкість становить:
де k — константа швидкості,
У гетерогенних реакціях концентрації речовин, що перебувають у твердому стані, практично не змінюються протягом реакції і тому не включаються в рівняння закону діючих мас. Наприклад, для реакції:
де Залежність швидкості реакції (або константи швидкості реакції) від температури визначається правилом Вант-Гоффа: із підвищенням температури на кожні 10 С швидкість більшості реакцій зростає в 2‑4 рази. Ця залежність виражається співвідношенням:
де
g ‑ температурний коефіцієнт швидкості реакції, який показує, у скільки збільшується швидкість реакції із підвищенням температури реагуючих речовин на 10 градусів. Правило Вант-Гоффа приблизне й застосовується лише для орієнтовної оцінки впливу температури на швидкість реакцій. Точніше залежність константи швидкості від температури виражається рівнянням Арреніуса:
де B ‑ коефіцієнт пропорційності; Еакт ‑ енергія активації, кДж; R ‑ газова постійна (8,31 кДж/(моль×К));
Т = (t+273°) ‑ абсолютна температура, К. Чим нижче енергія активації Еакт і вище температура, тим більше константа швидкості.
Хімічна рівновага
Хімічні реакції можна поділити на оборотні і необоротні. Реакції, які відбуваються в одному напрямку і завершуються повним перетворенням вихідних реагуючих речовин у кінцеві речовини, називаються необоротними. Прикладом такої реакції може бути розклад калій хлорату (бертолетової солі) під час нагрівання:
Реакція припиниться тоді, коли весь калій хлорат перетвориться на калій хлорид і кисень. Необоротних реакцій не так багато. Більшість реакцій оборотні. Оборотними називаються такі реакції, які одночасно відбуваються у двох взаємно протилежних напрямках. Ці реакції не доходять до кінця внаслідок того, що продукти реакції взаємодіють між собою, утворюючи знову вихідні речовини. Оборотні реакції завершуються встановленням хімічної рівноваги. Хімічна рівновага — це такий стан системи, коли швидкість прямої реакції дорівнює швидкості зворотної реакції. У стані рівноваги пряма і зворотна реакції не припиняються. Тому така рівновага називається рухомою, або динамічною, рівновагою. А оскільки дія обох реакцій взаємно знищується, то в реагуючій суміші видимих змін не відбувається: концентрації всіх реагуючих речовин — як вихідних, так і тих, що утворюються, — залишаються чітко сталими. Концентрації реагуючих речовин, які встановлюються в умовах хімічної рівноваги, називаються рівноважними. За певних умов реакції перебігають в одному напрямку до повного зникнення вихідних речовин. Такі реакції є практично необоротними. До них відносяться реакції, що супроводжуються виділенням: продуктів, які виходять зі сфери реакції у вигляді осаду, газу; малодисоційованих сполук; великої кількості енергії. У випадку оборотної хімічної реакції:
швидкість прямої та зворотної реакцій за законом діючих мас виражається відповідно рівняннями:
Оскільки з часом концентрація Із встановленням хімічної рівноваги швидкості прямої і зворотної реакції стають однаковими
звідки: Тому що Рівняння (4.6), що зв’язує швидкість реакції із концентрацією реагуючих речовин, називається кінетичним рівнянням реакції (іншими словами — є вираженням закону діючих мас):
Величина К — найважливіша характеристика оборотної реакції. Константа рівноваги визначається природою реагуючих речовин і не залежить від їх концентрації, але змінюється під впливом температури і тиску (для газуватих речовин). Константа рівноваги К показує, у скільки разів константа швидкості прямої реакції більше константи швидкості зворотної реакції. У цьому її фізичний смисл. Хімічна рівновага зберігається тільки за сталих умов. Зі зміною концентрацій реагуючих речовин, температури і тиску (для газових реакцій) рівновага порушується, рівноважні концентрації всіх речовин змінюються і встановлюється новий стан рівноваги. Напрямок зміщення рівноваги визначається принципом рухомої рівноваги Ле Шательє: якщо на систему, що перебуває в стані рівноваги, чиниться будь-який зовнішній вплив (змінюється концентрація, температура, тиск), то він сприяє перебігу тієї із двох протилежних реакцій, яка послаблює цей вплив
Елементи теорії каталізу Вплив різних сторонніх речовин на швидкість хімічних реакцій був відмічений вченими ще на початку дев’ятнадцятого сторіччя (К.С.Кірхгофф). У 1835 р. Берцеліус запропонував для таких речовин назву “каталізатори”, яка зберіглася до теперішніх часів. Каталізатор ¾ це така речовина, яка змінює швидкість хімічного процесу, а склад і кількість її до кінця реакції залишаються без зміни. Дія каталізатора зводиться до зменшення енергії активації Еакт. Явище зміни швидкості хімічної реакції у присутності каталізатора називається каталізом. Розрізняють каталіз гомогенний і гетерогенний, у залежності від того, чи знаходиться каталізатор і реагуючі речовини в одній або різних фазах. У гетерогенному каталізі є межа розподілу фаз. Якщо каталізатор перебуває в колоїдному стані, маємо справу з мікрогетерогенним каталізом. До цього роду каталізу відносяться біокаталітичні процеси, що відбуваються в живих організмах із величезною швидкістю й обумовлені наявністю в клітинах спеціальних каталізаторів-ферментів або ензимів. Поряд із речовинами, що прискорюють реакцію, застосовують також речовини, які її сповільнюють. Такі речовини називають інгібіторами. Вони використовуються в техніці в ролі сповільнювачів процесів окиснення, корозії, як антидетонатори тощо. Речовини, які навіть у малих кількостях знижують активність каталізаторів чи зовсім зупиняють його дію, називають каталітичними отрутами. Як і сам каталізатор, ці так звані каталітичні отрути діють специфічно: отруюють один каталізатор і не зашкоджують іншим. Причиною отруєння мабуть являється адсорбція поверхнею каталізатора каталітичних отрут, внаслідок чого останні оточують каталізатор і заважають підходу до нього молекул реагуючих речовин.
Якщо деякі речовини визивають отруєння каталізаторів, то інші, навпаки, під час додавання до каталізатору у невеликій кількості, сильно збільшують його активність, хоча самі не являються каталізаторами для цієї реакції. Такі речовини називаються промоторами. Література: [2] с.184-197; [6] с.180-194
|
|||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 566; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.227.161.226 (0.018 с.) |
 концентрація реагуючої речовини відповідала
концентрація реагуючої речовини відповідала  моль/л, а в наступний момент часу
моль/л, а в наступний момент часу  виявилася відповідною
виявилася відповідною  моль/л, то співвідношення
моль/л, то співвідношення
 за проміжок часу:
за проміжок часу: (с).
(с). і відповідний йому спад концентрації
і відповідний йому спад концентрації  , тим ближче відношення
, тим ближче відношення  до дійсної швидкості реакції у відповідний момент часу
до дійсної швидкості реакції у відповідний момент часу  .
.
 ,
, і
і  — концентрації реагуючих речовин у певний момент часу.
— концентрації реагуючих речовин у певний момент часу.
 чи
чи 
 — парціальний тиск кисню.
— парціальний тиск кисню.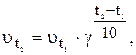
 ‑ швидкість реакції після підвищення температури до
‑ швидкість реакції після підвищення температури до  ;
; ‑ початкова швидкість реакції за температури
‑ початкова швидкість реакції за температури  ;
; ,
,



 і
і 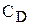 збільшується, швидкість прямої реакції
збільшується, швидкість прямої реакції  зменшується, а зворотної
зменшується, а зворотної  — збільшується.
— збільшується. . Концентрації речовин А, B, С і D у момент рівноваги називаються рівноважними концентраціями. Їх позначають символами [A], [B], [C] і [D]. У зв’язку з цим умови рівноваги
. Концентрації речовин А, B, С і D у момент рівноваги називаються рівноважними концентраціями. Їх позначають символами [A], [B], [C] і [D]. У зв’язку з цим умови рівноваги 

 і
і  для даної температури постійні, то і їх відношення
для даної температури постійні, то і їх відношення  — постійне для тієї ж температури. Величина К називається константою хімічної рівноваги.
— постійне для тієї ж температури. Величина К називається константою хімічної рівноваги.



