Реакції за карбоксильною групою
Електронна будова карбоксильної групи та карбоксилат-іону.
За рахунок поляризації зв’язків в карбоксильній групі карбонові кислоти виявляють кислотний характер та реагують з активними металами, основними оксидами, основами та лугами з утворенням солей.
За карбоксильною групою характерні реакції заміщення групи 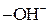 на інші атоми або групи атомів із утворенням функціональних похідних кислот: галогенангідридів, амідів, ангідридів та естерів. Функціональні похідні виявляють ацилуючі властивості та піддаються гідролізу. на інші атоми або групи атомів із утворенням функціональних похідних кислот: галогенангідридів, амідів, ангідридів та естерів. Функціональні похідні виявляють ацилуючі властивості та піддаються гідролізу.
Галогенангідриди кислот одержують взаємодією карбонових кислот із галоїдними сполуками фосфору:
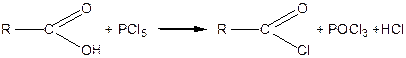
| | Кислота
| Хлорангідрид кислоти
| Галогенангідридам характерна висока реакційна здатність. Їх використовують для реакцій ацилування — введення радикалу кислоти із утворенням кислоти або похідних кислот:
Загальним методом добування ангідридів є взаємодія солей кислот з їх галогенангідридами:
Ангідриди можуть бути одержані пропусканням пари кислоти над каталізатором або нагріванням із водовіднімаючими засобами (Р2О5).
Ангідриди також є добрими ацилуючими агентами:
Аміди кислот 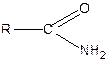 у промисловості одержують нагріванням амонійних солей до 200°С: у промисловості одержують нагріванням амонійних солей до 200°С:
Крім того, аміди можна добувати взаємодією аміаку з ацилуючими засобами (галогенангідридами та ангідридами кислот), а також неповним гідролізом нітрилів.
Нагрівання амідів із сильними водовіднімаючими засобами (Р2О5) відбувається з утворенням нітрилів кислот:
Естери утворюються взаємодією кислот та спиртів:
Естери піддаються реакціям гідролізу і переетерифікації. Естери — слабкі ацилуючі засоби.
Естери нижчих одноатомних спиртів та нижчих кислот — леткі рідини з приємним запахом (есенції) використовуються в парфумерній та харчовій промисловості.
Реакції за участю вуглеводневого радикалу
М’яким окисненням одержують b - і w -оксикислоти. В умовах дії галогенів відбувається заміщення Гідрогену на галоген в a -положенні в радикалі — це результат впливу карбоксильної групи.
Для ароматичних кислот характерні реакції електрофільного заміщення в ароматичному ядрі в мета-положенні.
Окремі представники одноосновних карбонових кислот, їх значення і використання
Мурашина кислота (метанова), оцтова кислота (етанова).
Вищі карбонові кислоти. Мила — натрієві та калієві солі вищих карбонових кислот. Синтетичні миючі засоби.
Література: [1] с. 177 - 199; [3] с. 375 – 388, 399 - 412
НЕНАСИЧЕНІ КАРБОНОВІ КИСЛОТИ
Лекція №9 (1 година)
План
1.Будова, ізомерія, номенклатура ненасичених карбонових кислот.
2. Способи добування ненасичених карбонових кислот.
3. Фізичні та хімічні властивості.
4. Окремі представники ненасичених карбонових кислот.
|