
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Хроматографія як метод розподілу і концентрування
Хроматографія - аналітичний метод, який найбільш часто використовується. Хроматографію успішно застосовують з метою дослідження у самих різних областях біології та медицини, ідентифікації антибіотиків та віднесення їх до тієї чи іншої групи антибактеріальних препаратів, для визначення найбільш важливих класів пестицидів. Такі переваги, як універсальність, експресність та чутливість роблять хроматографію важливішим аналітичним методом. Хроматографія - це фізико-хімічний метод розподілу речовин, який базується на розподілі компонентів між двома фазами - нерухомою та рухомою. Нерухомою (стаціонарною фазою) звичайно служить тверда речовина (її часто називають сорбентом) чи плівка рідини, яка нанесена на тверду речовину. Рухома фаза - це рідина чи газ, який протікає через нерухому фазу. Компоненти суміші, що аналізують, разом із рухомою фазою рухаються вздовж стаціонарної фази. Останню звичайно поміщують у скляну (чи металеву) трубку, яку називають колонкою. У залежності від сили взаємодії з поверхнею сорбенту (за рахунок адсорбції чи за яким-небудь іншим механізмом) компоненти переміщуються вздовж колонки з різною швидкістю. Деякі компоненти залишаються у верхньому шарі сорбенту, інші, з меншою степінню взаємодії з сорбентом, оказуються у нижній частині колонки, деякі покидають колонку разом із рухомою фазою. Таким чином компоненти розділяються. Хроматографічні сорбційні методи розрізняють за слідуючими ознаками: за середовищем, в якому відбувається розподіл (газова, газо-рідинна, рідинна хроматографія); за механізмами розподілу (молекулярна, іонообмінна, осадочна та розподільна хроматографія); за технікою проведення розподілу (колоночна, капілярна, паперова та тонкошарова хроматографія). За метою хроматографування виділяють аналітичну хроматографію (якісний та кількісний аналіз); препаративну хроматографію (для одержання речовин у чистому вигляді, для концентрування та виділення мікродомішок); промислову хроматографію для автоматичного управління процесом (при цьому основний продукт із колонки поступає в датчик). Методами хроматографії аналізують суміші неорганічних речовин, концентрують домішки елементів. У хімічній технології хроматографію застосовують для очищення та розподілу різноманітних речовин, які є близькими за властивостями: лантаноїдів, актиноїдів, амінокислот та інших.
Тонкошарова хроматографія Тонкошарова хроматографія проста за технікою виконання, експресна, не потребує складного обладнання. Розподіл цим методом може бути виконаний із застосуванням різних хроматографічних систем, тому виділяють адсорбційну, розподільну, іонообмінну. У методі ТСХ - різні сорбенти (алюміній(III) оксид, силікагель, целюлоза та інші), нанесені на пластинку тонким шаром. У методі застосовують хроматографічні системи рідина - твердий сорбент та рідина - рідина - твердий сорбент, крім того як рухому фазу використовують різні розчинники чи їх суміші, органічні чи неорганічні кислоти. Компоненти, які розділяють на пластинці утворюють окремі зони (плями), розташування яких на хроматограмі характеризується величинами Rf - відносною швидкістю переміщення компонентів у тонкому шарі. Експериментально величину Rf визначають як відношення відстані x, яку пройшла речовина, до відстані L, яку пройшов розчинник від старту до лінії фронту.
У ТСХ найчастіше використовують висхідний спосіб одержання хроматограм. Для цього застосовують скляні, металеві чи пластмасові пластинки, які вкриті тонким шаром сорбенту (нерухома фаза) звичайно товщиною 100-300 мкм. Досліджувану речовину наносять мікропіпеткою на стартову лінію та поміщають пластинку в камеру, яка містить розчинники (рухома фаза) для розділення компонентів. Хроматографування триває до тих пір, доки розчинник не пройде від лінії старту проблизно 10 см. Після чого хроматограму виймають з камери та підсушують на повітрі. Якщо утворюються безкольорові зони, то їх проявляють. Якісний аналіз. Якщо на хроматограмі утворюються забарвлені зони, то проводять візуальні спостереження. Незабарвлені хроматограми проявляють відповідними реагентами, як правило, груповими. За характерним забарвленням кольорових зон роблять висновок про склад проби, що аналізують. Для визначення компонентів використовують також метод, який базується на вимірюванні величин Rf для стандартної та визначаємої речовин в певному розчиннику. Ідентифікація компонентів цим способом може бути здійснена, якщо проводити хроматографування та визначення Rf для стандартного та досліджуваного розчинів в одній камері, на одній пластинці. Після проявлення хроматограм визначають Rf досліджуваного та стандартного розчинів. Порівнюють їх та роблять висновок про наявність у досліджуваному розчині тих чи інших компонентів.
Кількісний аналіз проводять безпосередньо на хроматограмі (на шарі сорбенту) за розміром плями (напівкількісне визначення). Література: [9] с.61-69 ОБ’ЄМНИЙ (ТИТРИМЕТРИЧНИЙ) АНАЛІЗ Лекція № 17,18 (4 години)
План 1. Об’ємний аналіз. Сутність, основні поняття, техніка та обладнання. 2. Класифікація методів об’ємного аналізу. 3. Метод нейтралізації. 4. Визначення карбонатної твердості води. 6. Редоксиметрія (окисно-відновне титрування). 7. Перманганатометрія. 8. Йодометрія. 9. Комплексонометрія. 10. Визначення загальної твердості води.
Об’ємний аналіз. Сутність, основні поняття, техніка та обладнання
Об’ємний аналіз поєднує різноманітні методи кількісних визначень, які базуються на вимірюванні маси речовини шляхом вимірювання об’ємів розчинів взаємодіючих речовин. Сутність титриметричного аналізу: до розчину, який приготовлено з наважки аналізуємої речовини (чи до певної частини об’єму цього розчину), поступово приливають розчин точно відомої концентрації до тих пір, доки речовини не провзаємодіють повністю. Тоді на підставі точного вимірювання об’єму реактиву розраховують вміст складової частини у досліджуваному об’єкті. Процес приливання одного розчину до другого з метою визначення концентрації одного з них називають титруванням. Момент закінчення реакції, коли взаємодіючі речовини повністю прореагують між собою, називають точкою еквівалентності, тому що в цей момент кількості прореагувавших речовин строго еквівалентні. Для виконання визначень об’ємним методом необхідно мати: ·Робочий розчин (титрований чи стандартний), тобто розчин речовини, який має точно відому концентрацію. ·Посуд для точного вимірювання об’ємів розчинів речовин, що взаємодіють (бюретка, піпетка). Криві титрування Крива, яка виражає зміну значення рН розчину, що титрують, в залежності від об’єму прилитого робочого розчину, називають кривою титрування. На вісі абсцис відкладують об’єм прилитого робочого розчину в мл, а на вісі ординат - значення рН. Горизонтальну лінію, яка відповідає рН=7, називають лінією нейтральності, а вертикальну, що проходить через точку, яка відповідає об’єму робочого розчину, що пішов на титрування, лінією еквівалентності. Побудувати криву титрування - це означає нанести на графік наступні точки: · Вихідну точку титрування - точка, яка відповідає значенню рН титруємого розчину до початку титрування. · Точку еквівалентності - точка, яка показує, при якому значенні рН титрування повинно бути закінчено. · Нанести проміжні точки кривої. Різка зміна рН, яка визивається додаванням останньої краплі розчину, називається стрибком титрування. Методи встановлення точки еквівалентності · Візуально: за зміною кольору розчину. · Фізико-хімічними (інструментальними) методами.
Для того, щоб візуально встановити точку еквівалентності використовують індикатори. Індикатор - речовина, яка змінює своє забарвлення у певному інтервалі значень рН середовища, в яке він введений. Більшість індикаторів - це слабкі органічні кислоти та основи (HInd чи IndOH). Якщо індикатор являється кислотою, то у розчині він дисоціює на іони HIndÛH++OH-, причому ця реакція зворотня. Головна особливість індикаторів - їх аніони (катіони) і недисоційовані молекули мають різне забарвлення. Згідно з іонною теорією індикаторів зміна забарвлення визивається зміщенням рівноваги дисоціації. Згідно з хромофорною теорією індикаторів зміна їх забарвлення пов’язана із зворотнім перегрупуванням атомів в молекулі органічної сполуки. Таке зворотнє перегрупування називається таутомерією. Зміщення рівноваги відбувається постіпово, тому забарвлення індикатору змінюється не відразу. Забарвлення стає різким коли забарвлених частиць більше дев’яноста відсотків. Таблиця 10 Зміна забарвлення індикатора в залежності від ступеня дисоціації
Інтервал переходу індикаторів Інтервал значень рН, в яких індикатор змінює своє забарвлення називають інтервалом перехода індикатора. Розрахувати цей інтервал можна за формулою: рН =рКінд
Класифікація методів об’ємного аналізу
В залежності від типу хімічної реакції, яка використовується для визначення, методи титриметричного аналізу класифікують таким чином: · Метод нейтралізації. · Окисно-відновний метод (оксидиметрія, редоксіметрія). · Метод осадження і комплексоутворення.
Метод нейтралізації
Сутність і можливості До методу нейтралізації відносяться усі об’ємні визначення, які базуються на реакції нейтралізації:
Можна проводити визначення солей, які мають сильно лужну реакцію внаслідок гідролізу. Наприклад,
Робочі розчини Основні робочі розчини: Величина рН в точці еквівалентності залежить від природи реагуючих речовин.
· Якщо кислота і основа, які вступають у взаємодію, являються сильними електролітами, то рН в точці еквівалентності дорівнює семи. Наприклад,
· Якщо кислота слабка, а основа сильний електроліт, то рН в точці еквівалентності буде більше семи. Наприклад,
· Якщо кислота являється сильним електролітом, а основа - слабким, то рН в точці еквівалентності буде менше семи. Наприклад,
Індикатори в методі нейтралізації Величина рН, до якої титрують розчин з певним індикатором, називають показником титрування цього індикатору. Найважливіші індикатори мають слідуючі області переходу та показники титрування. Таблиця 11 Найважливіші індикатори, їх області переходу та показники титрування
Визначення карбонатної твердості води
Наявність у воді різних солей кальцію і магнію придає воді жорсткість. Солі, які можуть бути присутні - це кальцій гідрогенкарбонат, кальцій хлорид, кальцій сульфат, магній гідрогенкарбонат, магній хлорид, магній сульфат. Види жорсткості води · Загальна жорсткість (визначається сумою концентрацій кальцій-катіонів та магній-катіонів). · Постійна жорсткість (обумовлена наявністю у воді таких солей: кальцій хлорид, кальцій сульфат, магній хлорид, магній сульфат). · Тимчасова (карбонатна) жорсткість (обумовлена наявністю у воді таких солей: кальцій гідрогенкарбонат, магній гідрогенкарбонат). · Кальцієва жорсткість (обумовлена наявністю у воді солей кальцію). · Магнієва жорсткість (обумовлена наявністю у воді солей магнію). Жорсткість води визначається молярною концентрацією еквівалента іонів кальцію та магнію у мілімолях на 1 дм3. Категорії жорсткості · М’яка (ж<4 ммоль/дм3). · Середньої жорсткості (4<ж<8 ммоль/дм3). · Жорстка (ж>8 ммоль/дм3). В Україні згідно з ГОСТ 297 1-82 припустима жорсткість води для господарсько-питного водопостачання має становити не більш, ніж 7 ммоль/дм3. Способи усунення жорсткості води 1. Методи осадження. а) тривале кип’ятіння:
б) додавання соди або Са(OH)2:
2. Метод іонного обміну. Іоніти - речовини, які мають здатність до обміну іонів. В залежності від того, який вид іонів приймає участь в обміні їх підрозділяють на катіоніти та аніоніти. Катіоніти здатні обмінювати катіони, а також гідроген-іони. Аніоніти здатні обмінювати аніони, а також гідроксид-іони. Обробка води на іонітах називається обезсолюванням води. Для обезсолювання воду послідовно пропускають через катіонітовий та аніонітовий фільтри. Після використання іоніти можуть бути регенеровані. Карбонатну жорсткість можна визначати за допомогою метода нейтралізації. Вода має слаболужну реакцію і кальцій гідрогенкарбонат та магній гідрогенкарбонат реагують з хлоридною кислотою, тому як робочий розчин під час визначення карбонатної жорсткості води беруть розчин хлоридної кислоти у присутності метилового оранжевого. При цьому перебігають реакції:
Бюретку заповнюють розчином хлоридної кислоти. У колби для титрування відміряють мірною колбою по 100 мл води, додають 3-4 краплі метилового оранжевого і титрують одержаний розчин до золотисто-рожевого забарвлення. За даними титрування розраховують карбонатну жорсткість води. Наприклад, на титрування 100 мл води пішло 6 мл хлоридної кислоти з молярною концентрацією еквівалента 0,1 моль/л. Дано: Результати титрування: Сн(HCl)=0,1 моль/л V1(HCl)=5,85 мл V(H2O)=100 мл V2(HCl)=6,05 мл Індикатор: метиловий оранжевий V3(HCl)=6,10 мл Жкарб=? Vсереднє(HCl)=6,00 мл Карбонатну жорсткість можна розрахувати за рівнянням:
де V(HCl) ¾ середнє значення об’єму хлоридної кислоти, яке пішло на титрування, мл; N(HCl) ¾ молярна концентрація еквівалента розчину хлоридної кислоти, моль/л; V(H2O) ¾ об’єм води, мл. Підставляємо одержані дані титрування:
Редоксиметрія (окисно-відновне титрування)
Загальна характеристика методів окиснення-відновлення Ці методи поєднюють різні об’ємно-аналітичні визначення, які пов’язані з застосуванням реакцій окиснення та відновлення. За допомогою титрованих розчинів окисників визначають кількісний вміст відновників (наприклад, ферум(ІІ)-катіони, манган(ІІ)-катіони). За допомогою титрованих розчинів відновників визначають окисники (наприклад, ферум(ІІІ)-катіони, купрум(ІІ)-катіони, хлор, бром і т.д.). Як індикатори в методах окиснення-відновлення застосовують різні органічні сполуки, які самі являються окисниками чи відновниками. Крім того, для деяких реакцій оксидиметрії підібрані специфічні реактиви, які змінюють забарвлення в еквівалентній точці даного титрування. Наприклад, в йодометрії таким специфічним і чутливим реактивом є крохмаль, який стає синім у присутності йода. В усіх випадках окисно-відновних реакцій окисники та відновники реагують між собою у кількостях, які відповідають їх еквівалентам. Тому, для находження грам-еквівалента окисника необхідно грамм-молекулу окисника поділити на число електронів, одержаних під час реакції однією молекулою, а для визначення грамм-еквівалента відновника слід грамм-молекулу його поділити на число електронів, які були віддані під час реакції однією молекулою відновника: Е= де Е - грам-еквівалент окисника чи відновника; n - число електронів, які були приєднані однією молекулою окисника, чи число електронів, які були віддані однією молекулою відновника; М - грам-молекула окисника чи відновника. Реакції окиснення-відновлення перебігають складніше, чим реакції, які застосовують в методі нейтралізації. Вкажемо основні особливості окисно-відновних реакцій: а) у багатьох реакціях взаємодіють не тільки окисники та відновники, але й речовини, які не змінюють своєї валентності, наприклад, кислоти, луги; б) реакції перебігають у декілька стадій, причому кожна з цих стадій перебігає з різною швидкістю; в) у процесі реакції часто утворюються речовини, які змінюють хід самої реакції; г) швидкість реакції нижче швидкості обмінних реакцій; д) багато реакцій є зворотніми. Реакції окиснення-відновлення, на основі яких здійснюється кількісний аналіз, повинні відповідати наступним вимогам: · Окисно-відновна реакція повинна перебігати в необхідному напрямку і бути практично незворотньою. Напрямок окисно-відновної реакції залежить від величини окисно-відновних потенціалів реагуючих речовин. · Окисно-відновні реакції повинні перебігати з достатньою швидкістю. Швидкість реакції можна збільшити збільшенням температури, концентрації реагуючих речовин, зміною рН розчину і застосуванням каталізаторів. Переваги окисно-відновних методів · Велика точність, простота, гарна відтворюваність. · Експрессність. · Можливість визначати не тільки окисники та відновники, але й сполуки, які не підлягають окисненню і відновленню. · Велика різноманітність. · Титрування можна здійснювати індикаторним, безіндикаторним та інструментальним методами. · Визначення можна проводить методами прямого, зворотнього та непрямого титрування. · Деякі окисники та відновники є хімічно чистими, тобто можна приготувати стандартний розчин за точною наважкою · Можна титрувати в усіх середовищах. Класифікація окисно-відновних методів титрування У залежності від характеру титранта окисно-відновні методи титрування класифікують таким чином: 1. Перманганатометрія. 2. Іодометрія. 3. Аскорбінометрія. 4. Титанометрія і т. д. 5. Перманганатометрія
Сутність метода перманганатометрії Перманганатометрія ¾ метод об’ємного аналізу, робочим розчином якого являється розчин калій перманганату. У процесі титрування досліджуваного розчину малиново-фіолетове забарвлення розчину калій перманганату знебарвлюється. Однак, після досягнення точки еквівалентності перша надлишкова крапля розчину калій перманганату забарвлює рідину, що титрують, у блідо-малиновий колір. Індикатором у даному випадку являється сам калій перманганат. Тому під час перманганатометричних визначень сторонні індикатори не додають. Калій перманаганат проявляє окисні властивості у кислому та лужному (чи нейтральному) середовищі. Під час титрування кислих розчинів манган(VII)-катіон, який входить до складу калій перманганату, відновлюється до безбарвних манган(ІІ)-катіонів:
Під час титрування у нейтральному або лужному середовищі манган(VII)-катіон відновлюється тільки до манган(IV)-катіонів, наприклад до манган діоксиду:
Речовини, які можна визначати методом перманганатометрії · Відновники: метали (Fe, Bi, Ag, Cd, Zn та ін.), неметали (Sb, As, P та ін.), йони (Fe2+, Cr2+, Mn2+, Cl-, Br-, I-, S2- та ін.). · Окисники: Fe3+, Cr(VI), NO3-, ClO3-, BrO3-, IO3-, PbO2, MnO2 та ін. Переваги методу 1. Титрування проводиться без індикатору. 2. Можна титрувати у кислому та лужному середовищах. 3. Високий потенціал Е0(MnO4-/Mn2+)=1,52 В. 4. Калій перманганат ¾ дешевий та доступний реагент. Недоліки методу 1. Розчин калій перманганату є встановленим. 2. Неможна проводити титрування у присутності хлорид-іонів. 3. Деякі реакції перебігають повільно за кімнатною температурою, тому необхідно застосовувати нагрівання. 4. Необхідно сторого дотримуватись умов, які рекомендує методика аналізу.
Йодометрія
Сутність методу йодометрії Атоми йоду, як і інших галогенів, мають властивість віднімати електрони у речовин-відновників. Тому елементарний йод звичайно веде себе в реакціях як окисник: I2+2e=2I-. Аніони I-, навпаки, легко віддають свої електрони речовинам-окисникам і відіграють у реакціях роль відновників: 2I--2е=I2. Ці властивості йоду та його йодид-іонів лежать в основі йодометрії. Відомо, що вільний йод забарвлює крохмаль у синій колір. Якщо до розчину якого-небудь відновника додати крохмаль та титрувати йодом, то після досягнення точки еквівалентності надлишкова краплина йоду викличе синє забарвлення, що не зникає. Можна робити і навпаки, тобто до розчину йода у присутності крохмалю поступово приливати відновник. У цьому випадку точку еквівалентності визначають за знебарвленням синього кольору. Йод малорозчинний у воді, тому, як стандартний розчин, використовують його розчин у калій йодиді: I2+I-Û[І3]-. Еквівалент йоду розраховують за формулою: Е(I2)= Е(І2/2І-)=0,53 В. Це означає, що йод окиснює менше число відновників, ніж калій перманганат. Методи йодометричного титрування 1. Метод прямого титрування Речовини, що легко окиснюються йодом, титрують розчином йоду в калій йодиді К[І3]. Таким чином визначають сульфіди, тіосульфати, сульфати та ін. 2. Метод зворотнього титрування Речовини, які важче окиснюються йодом, обробляють розчином К[І3] і потім через деякий час відтитровують надлишок К[І3] стандартним розчином Na2S2O3. 3. Метод непрямого титрування Речовини, які відносяться до окисників, обробляють розчином калій йодиду, а потім йод, що виділився, відтитровують розчином Na2S2O3. Цим методом визначають перманганати, хромати, біхромати, йодати та ін. Визначення відновників Під час визначення відновників як робочий розчин застосовують розчин йоду. Прикладом такої реакції може бути взаємодія між натрій тіосульфатом та йодом: 2Na2S2O3+I2®2NaI+Na2S4O6 I2+2e®2I- 1 відновлення, окисник 2S2O32- -2e®S4O 62- 1 окиснення, відновник I2+2S2O32-®2I-+S4O62- Е(Na2S2O3×5Н2О)=М=248,2 г/моль; Е(I2)=М/2=126,8 г/моль. Концентрацію натрій тіосульфату розраховують за формулою:
де N(І2) ¾ молярна концентрація еквіваленту розчину йоду, моль/л; V(І2) ¾ об’єм розчину йоду, який пішов на титрування, мл; V(Na2S2O3) ¾ об’єм розчину, який взяли для титрування, мл. Визначення окисників Під час визначення окисників не можна титрувати розчином калій йодиду внаслідок неможливості фіксування точки еквівалентності. Під час титруваннґ будь-якого окисника, наприклад K2Cr2O7, кінець реакції K2Cr2O7+6KI+14HCl=3I2+8KCl+ +2CrCl3+7H2O характеризовався би припиненням утворення вільного йоду. Але цей момент помітити не можна. Тому в цьому випадку застосовують непрямий метод ¾ метод заміщення. До суміші розчину калій йодиду та кислоти додають точно відомий об’єм розчину досліджуваного окисника, наприклад K2Cr2O7. Для завершення реакції розчин залишають на 5 хвилин, після чого йод, який виділився, відтитровують натрій тіосульфатом. Еквівалентну точку фіксують за допомогою розчину крохмалю, який з йодом утворює синє забарвлення. Концентрацію калій дихромату розраховують за формулою:
де N(Na2S2O3) ¾ молярна концентрація еквіваленту розчину натрій тіосульфату, моль/л; V(Na2S2O3) ¾ об’єм розчину, який пішов на титрування, мл; V(K2Cr2O7) ¾ об’єм розчину, який взяли для титрування, мл. Переваги методу 1. Висока точність. 2. Розчини йода забарвлені, тому можна здійснювати титрування без індикаторів. 3. Моживість застосування неводних розчинів йоду. 4. Можливість визначення сполук, які безпосередньо з йодом та йодидами не реагують. Недоліки методу 1. Можливість втрати йоду внаслідок його леткості (слід проводити реакцію у колбах з притертим корком). 2. Можливість окиснення йодид-іонів, що сприяє зменшенню рН розчину та дія сонячного світла, тому титрування слід проводити за помірної кислотності розчину та розчини йода необхідно зберігати у темних склянках чи у зачинених шафах. 3. Неможна проводити титрування у лужному середовищі (гідроксид-іони визивають реакцію диспропорціонування йоду). 4. Відносно повільна швидкість реакції. 5. Можливість адсорбції йоду. 6. Необхідність точно дотримуватись методик визначення.
Комплексонометрія
Комплексонометричне титрування базується на реакціях утворення комплексів іонів металів з амінополікарбоновими кислотами (комплексонами). Із великої кількості амінополікарбонових кислот найбільш часто використовують етилендіамінтетраетанову кислоту (Н4Y) НООС¾Н2С СН2¾СООН ½ ½ NH+¾CH2¾CH2¾NH+ ½ ½ -ООС¾Н2С СН2¾СОО-. Внаслідок низької розчинності у воді сама кислота не підходить для приготування розчину титранта. Для цього звичайно використовують дигідрат її двунатрієвої солі Na2H2Y×2H2O (ЕДТА). Цю сіль можна одержати додаванням до суспензії кислоти натрій гідроксиду до рН»5. У більшості випадків для приготування розчину ЕДТА використовують комерційний препарат, а потім розчин стандартизують. Можна також використовувати фіксанал ЕДТА. Реакції взаємодії різних катіонів з ЕДТА у розчині можна представити рівняннями: Са2++ H2Y2-=СаY2-+2Н+, Ві3++ H2Y2-=ВіY-+2Н+, Th4++ H2Y2-=ThY+2Н+. Видно, що незалежно від заряду катіона утворюються комплекси з співвідношенням компонентів 1:1. Значить, молекулярна маса еквівалента ЕДТА і досліджуваного іона метала дорівнюють їх молекулярним масам. Ступінь перебігу реакції залежить від рН та константи стійкості комплексонату. Катіони, що утворюють стійкі комплексонати, наприклад Fe(III), можуть бути відтитровані у кислих розчинах. Йони Са(ІІ), Mg(II) та інші, що утворюють менш стійкі комплексонати, титрують за умови рН=9 і вище.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 561; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.58.121.131 (0.127 с.) |
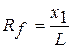 .
.
 1.
1.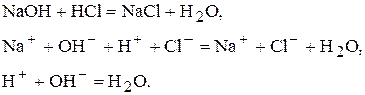
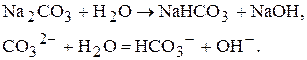
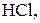
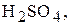
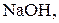
 Титри цих розчинів необхідно встановлювати. Під час встановлення титрів кислот використовують буру
Титри цих розчинів необхідно встановлювати. Під час встановлення титрів кислот використовують буру  чи соду
чи соду 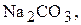 під час встановлення титрів лугів - щавлеву кислоту
під час встановлення титрів лугів - щавлеву кислоту 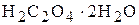 чи янтарну кислоту
чи янтарну кислоту 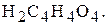
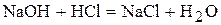 рН=7.
рН=7.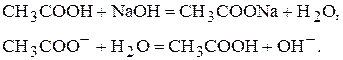 рН>7
рН>7 рН<7
рН<7
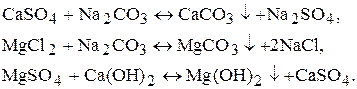
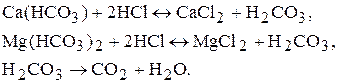
 ,
, (мг-екв)/л.
(мг-екв)/л.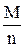 ,
,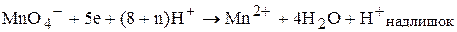 .
.

 .
.




