
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Методичні матеріали до дисципліни
12. Мурликіна Н.В., Аксьонова О.Ф. Крівіч В.В. Хімія та методи дослідження сировини та матеріалів. Методичні вказівки для самостійної підготовки та виконання лабораторних робіт студентами товарознавчого факультету, 2002 р. 13. Добровольська О.В. Смірнова І.С. Лабораторний практикум з аналітичної хімії: Навч. посібник. Частина 1. Якісний аналіз. / Харківський державний університет харчування та торгівлі. - Харків, 2004. с. 96, табл. 10. 13. Смірнова І.С. Аксьонова О.Ф. Методичні вказівки до самостійної роботи та контрольні завдання з курсу «Хімія та методи дослідження сировини та матеріалів» Розділ «Загальні основи аналітичної хімії» для студентів І курсу товарознавчого факультету, 2004 р. Розділ 2. ФІЗИЧНА ХІМІЯ СИРОВИНИ ТА ТОВАРІВ
Лекція №1 Основні закони термодинаміки. Термохімія План лекції 1. Основні поняття термодинаміки. Предмет і зміст фізичної хімії. 2. Перший закон термодинаміки. 3. Другий закон термодинаміки. Поняття про ентропію. 4. Теплові ефекти термохімічних реакцій. Закон Гесса. 5. Теплоємність речовин. Калориметрія. Визначення калорійності харчових продуктів. Рекомендована література: [1] С.175-217, [2] С.7-14, 15-18, [3] С.5-22, [4] С.111-117. Основні поняття термодинаміки Термодинаміка являє собою науку, яка вивчає переходи енергії із однієї форми в іншу або від однієї системи до іншої, а також енергетичні ефекти, що супроводжують фізико-хімічні процеси, можливість і напрямок перебігу цих процесів. Хімічна термодинаміка у свою чергу вивчає взаємне перетворення різних видів енергії у формі теплоти або роботи під час перебігу хімічних реакцій. Термодинамічною системою називають частину простору, фактично або умовно виділену із навколишнього середовища. Якщо між системою і середовищем здійснюється перебіг процесів теплообміну або перенос маси, то така система називається відкритою. Якщо ж взаємодія між середовищем і системою відсутня, то така система називається ізольованою. Фізичні величини, що характеризують стан системи, називають параметрами. У термодинаміці застосовують три основних параметри: об’єм – V, тиск – Р, температура – Т. Будь-яка зміна параметрів системи називається термодинамічним процесом. Процес, що відбувається за сталої температури називають ізотермічним, за сталого об'єму – ізохорним, за сталого тиску – ізобарним. У термодинаміці користуються також функціями від цих параметрів, такими як внутрішня енергія системи, ентальпія, ентропія тощо. Внутрішня енергія системи U – являє собою суму кінетичної енергії руху усіх часточок системи (електронів, атомів, тощо) та потенціальної енергії їх взаємодії (ядерну, хімічну тощо), за винятком енергії самої системи в цілому. Внутрішня енергія є функцією стану, тобто її зміна визначається тільки вихідним та кінцевим станами системи: D U = U 2 – U 1. Ще однією функцією стану є ентальпія Н, яка дорівнюєсумі U + РV. У термодинаміці користуються поняттями “теплота” і “робота”. Теплота Q і робота А – це форми передачі енергії від однієї системи до іншої. Теплотою називають форму передачі енергії, що здійснюється внаслідок хаотичного руху молекул. Під час виконання роботи енергія передається шляхом упорядкованого руху молекул під дією зовнішньої сили.
Перший закон термодинаміки Перший закон термодинаміки є окремим випадком закону збереження енергії. Можна надати кілька його рівноцінних формулювань: · Енергія не зникає без сліду і не виникає з нічого, а тільки переходить із одного виду в інший або від однієї системи до іншої у строго еквівалентній кількості. · В ізольованій системі загальний запас внутрішньої енергії є величина стала. · Вічний двигун І роду, тобто періодично діюча машина, що виконує роботу, не витрачаючи при цьому енергії, неможливий. Перший закон термодинаміки можна виразити аналітично у вигляді рівняння: Q = D U + А. (1.1) Тобто теплота – Q, що надається системі, витрачається на збільшення її внутрішньої енергії – D U та роботу – А, що виконується цією системою. Другий закон термодинаміки Другий закон термодинаміки дає можливість зробити висновок про можливість та напрямок перебігу фізико-хімічних процесів. Існує декілька формулювань ІІ закону термодинаміки: · Теплота не може самочинно переходити від холодного тіла до більш гарячого (постулат Клаузіуса). · Різні види енергії прагнуть перетворитися на теплоту, яка в свою чергу розсіюється, тобто рівномірно розподіляється у просторі (постулат Томсона).
· Будь-яка форма енергії може повністю перетворитися на теплоту, але теплота перетворюється в інші форми енергії лише частково (постулат Планка). · Вічний двигун ІІ роду, тобто машина, що повністю перетворює всю одержану теплоту на роботу, неможливий (постулат Освальда). Ентропія. Усі самочинні фізико-хімічні процеси поділяються на оборотні і необоротні. Якщо після перебігу процесу система і навколишнє середовище повертаються в первісний стан, то такий процес називається оборотним. Відношення теплоти процесу до температури, за якою він відбувається, називається приведеною теплотою. Це функція, що характеризує стан системи, яка пізніше дістала назву ентропія – S = S 2 – S 1 = D S ³. 0 (1.2) Рівняння (1.2) є аналітичним виразом ІІ закону термодинаміки. Тобто ентропія ізольованої системи під час перебігу в ній оборотних процесах не змінюється (S 2= S 1), а під час перебігу необоротних процесів – збільшується (S 2> S 1), доки система не перейде у рівноважний стан, де ентропія сягає максимуму. Отже, в ізольованих системах можливість перебігу процесів визначається за зміною ентропії: процес відбувається самочинно, якщо ентропія системі при цьому збільшується – D S >0. Відомо, що молекули, атоми, іони перебувають у безперервному хаотичному русі, безперервно змінюючи свій стан – змішуються, розсіюються. Будь-яка термодинамічна система прагне перейти у більш невпорядкований стан. Кількісною мірою невпорядкованості системи є ентропія. Чим більша ентропія, тим вищим є ступінь невпорядкованості даної системи. Згідно з постулатом Планка ентропія ідеального кристала простої речовини за температури 0 К наближається до нуля. У разі переходу речовини з твердого стану у рідкий, і тим більше у газоподібний стан або плазму значення її ентропії стрімко зростає.
Термохімія Термохімія – розділ хімічної термодинаміки, в якому вивчають теплові ефекти хімічних реакцій. Тепловим ефектом хімічної реакції називають кількість теплоти, що виділяється або поглинається під час перебігу хімічної реакції за умов сталого тиску або об’єму. Тепловий ефект реакції, що перебігає в системі за сталого об'єму і температури, дорівнює зміні внутрішньої енергії цієї системи: QV = U 2 – U 1 = D U. (1.3) У природі і техніці більшість хімічних реакцій перебігають за сталого тиску, який дорівнює зовнішньому атмосферному тиску. Тепловий ефект реакції, у цьому випадку дорівнює зміні ентальпії системи під час перебігу цієї реакції: QР = Н 2 – Н 1 = D Н. (1.4) Визначивши тепловий ефект реакції, що відбувається за сталого тиску – D Н, можна розрахувати його значення за ізохорних умов – D U: D U = D H – D nRT,(1.5) де D n – різниця між числом молів газоподібних продуктів реакції і реагентів. Хімічні реакції, що перебігають з виділенням теплоти називаються екзотермічними, а реакції, що супроводжуються поглинанням теплоти з навколишнього середовища – ендотермічними. Ендотермічні реакції мають додатний знак теплового ефекту (D H >0 або D U >0), а екзотермічні – від’ємний знак (D H < 0 або D U < 0). Під час написання термохімічних рівнянь реакцій обов'язково вказується тепловий ефект реакції та агрегатний стан усіх реагентів.
Основний закон термохімії був встановлений Г.І.Гессом: " Тепловий ефект хімічної реакції не залежить від шляху перебігу реакції, а визначається лише станом регентів і продуктів реакції ". Існує два висновки з закону Гесса. 1).Тепловий ефект реакції дорівнює різниці між сумами теплот утворення продуктів реакції і теплот утворення реагентів з урахуванням відповідних стехіометричних коефіцієнтів.
Теплота утворення – це тепловий ефект реакції утворення 1 моля сполуки з простих речовин за стандартних умов. Стандартним умовам відповідає температура – 298 К і загальний тиск – 1 атм. Теплоти утворення сполук наводяться у довідниках фізико-хімічних величин. 2).Тепловий ефект реакції дорівнює різниці між сумами теплот згоряння реагентів і теплот згоряння продуктів реакції з урахуванням відповідних стехіометричних коефіцієнтів.
Теплота згоряння – це тепловий ефект реакції взаємодії 1 моля сполуки з киснем за умов, що при згорянні речовин, які містять Карбон, Гідроген, Сульфур і Нітроген, утворюються відповідно СО2, Н2О, SO2, N2. Теплоємність речовин Закон Кірхгофа дозволяє визначати теплові ефекти хімічних реакцій за будь-якої температури, якщо, ви знаєте тепловий ефект цієї реакції за однією певною температурою. Рівняння Кірхгофа в інтегральній формі має такий вигляд:
де D С – зміна теплоємності системи, яка має місце внаслідок перебігу цієї реакції. Молярна теплоємність речовини Ср визначається за кількістю теплоти, яку необхідно надати 1 молю речовини, щоб нагріти її на один градус. Як правило, температуру Т 1 беруть рівною 298 К, оскільки у цьому випадку
Калориметрія Калориметрія являє собою сукупність методів визначення калорійності харчових продуктів. Калорійність харчових продуктів, як правило, виражають у кілокалоріях: 1 ккал = 4,184 кДж. Дослідним шляхом калорійність харчових продуктів визначають у спеціальних приладах – калориметрах, в яких спалюють зразки харчових продуктів певної маси. Чим більше зразок містить жирів, білків та вуглеводів, тим більше теплоти виділяється під час його згоряння і тим більша його калорійність. В організмі людини окиснення поживних речовин проходить поступово через ряд проміжних стадій, однак відповідно закону Гесса, загальна кількість теплоти, що виділяється при цьому буде такою ж, як і під час спалювання цих речовин у калориметрі. У табл. 1.1 наведені середні теплоти згоряння вуглеводів, жирів та білків.
Таблиця 1.1 – Теплота згоряння основних видів поживних речовин
На лекції наводяться приклади розрахунків теплових ефектів хімічних реакцій і калорійності зразків харчових продуктів, з відомим вмістом поживних речовин. Лекція №2
|
|||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 370; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.223.32.230 (0.023 с.) |
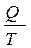 . Для будь-яких самочинних процесів:
. Для будь-яких самочинних процесів: (1.6)
(1.6) (1.7)
(1.7) , (1.8)
, (1.8) легко розрахувати за законом Гесса. У вузькому інтервалі температур нехтують залежністю теплоємності від температури, і тоді:
легко розрахувати за законом Гесса. У вузькому інтервалі температур нехтують залежністю теплоємності від температури, і тоді: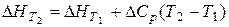 (1.9)
(1.9)


