Кількісні характеристики процесу гідролізу
Кількісно процес гідролізу характеризується ступенем гідролізу (α) та константою гідролізу (Кгідр).
Ступінь гідролізу, тобто мольна доля електроліту, яка піддається гідролізу (у %), залежить від природи солі, температури та концентрації розчину. Розведення розчину та нагрівання збільшують ступінь гідролізу.
Константою гідролізу називають перетворену константу рівноваги реакції гідролізу. Наприклад, для реакції гідролізу етаноат-іона:
CH3COO-+ H2O ®CH3COOH+OH-.
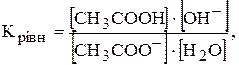   . .
Для малодисоційованих розчинів [Н2О]  const, тому Крівн×[Н2О]=const=Кгідр. Шляхом перетворень можна виразити Кгідр через величини константи дисоціації слабкої кислоти, яка утворюється в результаті гідролізу (Ккисл) та іонного добутку води. const, тому Крівн×[Н2О]=const=Кгідр. Шляхом перетворень можна виразити Кгідр через величини константи дисоціації слабкої кислоти, яка утворюється в результаті гідролізу (Ккисл) та іонного добутку води.
Замінивши через іонний добуток води (Кw) концентрацію гідроксид-іонів
[ОН-]=  , отримують вираз Кгідр. для випадку гідролізу за аніоном: , отримують вираз Кгідр. для випадку гідролізу за аніоном:
 ; ;  . .
Аналогічно за катіоном:  . .
РН розчину солей, що піддаються гідролізу
Сіль утворена із сильної кислоти та слабкої основи
NH4OH+HCl=NH4Cl+H2O
NH4++H2O=NH4OH+H+. Середовище кисле.
Чим слабкіше основа, тим більше рівновага зміщується праворуч, тобто концентрація гідроген-іонів у розчині визначається здатністю до дисоціації слабкої основи, тобто значенням її константи дисоціації:
Косн.=  . Кw=[Н+]×[ОН- . Кw=[Н+]×[ОН-  ] ]
Кгідр= 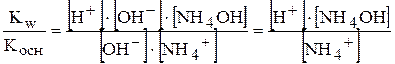 . .
З рівняння гідролізу видно, що з кожної молекули NH4OH утворюється один гідроген-катіон. Це означає, що рівноважна концентрація гідроген-іонів дорівнює рівноважній концентрації розчину амоніаку. Рівноважну концентрацію амоній-катіонів можна прийняти рівною початковій концентрації солі (Ссолі), тому сіль майже повністю дисоціює.
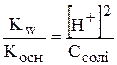 , ,  , ,
lg  , ,
-lg 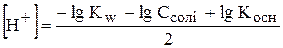 , ,
рН=  . .
Сіль утворена із слабкої кислоти та сильної основи
CH3COOH+NaOH=CH3COONa+H2O,
CH3COO-+H2O=CH3COOH+OH-.
Константа дисоціації етанової кислоти записується таким чином:
Ккисл= 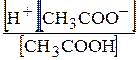 . .
Підставимо вираз константи дисоціації кислоти у рівняння константи гідролізу:
Кгідр=  , ,
 . .
Виразимо концентрацію гідроксид-іонів з іонного добутку води:
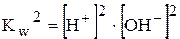 , ,  . .
Підставимо у рівняння 1 рівняння 2:
  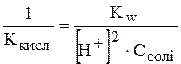 . .
Виразимо концентрацію гідроген-іонів:
 . .
Прологарифмуємо одержане рівняння:


Сіль утворена зі слабкої кислоти та слабкої основи основи
CH3COOH+NН4OH=CH3COONН4+H2O.
 . .
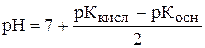 . .
Література: [2], с. 200-206; [6], с.283-288; [9], с.228-235
РІВНОВАГА У РОЗЧИНАХ МАЛОРОЗЧИННИХ СПОЛУК
Лекція №9 (2 години)
План
1. Теоретичні умови осадження малорозчинних сполук.
2. Умови утворення осадів.
3. Фактори, що впливають на розчинність осадів.
4. Використання осадження для розділення та визначення різних сполук.
|