
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Способи визначення вмісту речовини у розчині
Молярна концентрація (молярність) (С) - відношення кількості речовини до об’єму розчину. Одиниці вимірювання - моль/л.
де V - об’єм розчину, л. Так як кількість речовини дорівнює відношенню маси речовини до її молекулярної маси, то вираз для розрахунку молярної концентрації можна записати у вигляді:
де
V - об’єм розчину, л. Молярна концентрація еквівалента (нормальна концентрація, нормальність) (Сн, N) - відношення кількості моль еквівалентів розчиненої речовини до об’єму розчину. Одиниці вимірювання - моль/л.
де V - об’єм розчину, л. Оскільки кількість моль еквівалентів дорівнює відношенню маси речовини до її еквівалента, то вираз для розрахунку молярної концентрації еквівалента можна записати у вигляді:
де
V - об’єм розчину, л. Масова частка (W) - відношення маси розчиненої речовини до маси усього розчину. Вимірюється в долях одиниці чи у відсотках.
де
Мольна частка (N) - відношення кількості молів певного компонента до загальної кількості молів (безрозмірна величина).
де
Моляльна концентрація (моляльність) (m) - відношення кількості розчиненої речовини до маси розчинника. Одиниці вимірювання - моль/кг. m = де
Гідрати, кристалогідрати Кількість тепла, яка поглинається (чи виділяється) під час розчинення одного моля речовини, називається теплотою розчинення цієї речовини. У теперішній час встановлено, що під час розчинення багатьох речовин їх молекули (чи іони) зв’язуються з молекулами розчинника, утворюючи сполуки, які називають сольватами; цей процес називають сольватацією. Якщо розчинником є вода, ці сполуки називають гідратами, а процес їх утворення - гідратацією. Речовини, у кристали яких входять молекули води, називають кристалогідратами, а вода, яка в них міститься - кристалізаційною. Склад кристалогідратів прийнято відображати формулами, які показують яку кількість кристалізаційної води містить кристалогідрат. Наприклад, CuSO4×5H2O - кристалогідрат купрум(II) сульфату містить на 1 моль CuSO4 5 моль Н2О.
Розчинність - здатність речовин розчинятись в тому чи іншому розчиннику. Мірою розчинності речовини при даних умовах є вміст її у насиченому розчині. Чисельно розчинність може бути виражена такими способами, що і склад. Коефіцієнт розчинності - число одиниць маси безводної речовини, яке насичує за даних умов 100 одиниць маси розчинника. Якщо в 100 г Н2О розчиняється більше 10 г речовини, її називають гарно розчинною; якщо розчиняється менше 1 г речовини - малорозчинною; якщо розчиняється менше 0,01 г - нерозчинною. Розчинність речовин, які знаходяться у твердому стані, залежить від температури і практично не залежить від тиску. Під час розчинення рідин у рідинах розчинність залежить від температури і мало залежить від тиску. Закон розподілу: речовина, яка здатна розчинятись в двох розчинниках, що не змішуються, розподіляється між ними так, що відношення її концентрацій у цих розчинниках за сталою температурою є постійним, незалежно від загальної кількості розчиненої речовини.
де К - коефіцієнт розподілу. Екстракція - спосіб вилучення розчиненої речовини з розчину за допомогою іншого розчинника. Розчинність газів у воді залежить від температури та тиску. Закон Генрі: концентрація газу у розчині прямопропорційна парціальному тиску цього газу над розчином.
де С - масова концентрація газу в насиченому розчині, Р - парціальний тиск, К - коефіцієнт Генрі.
|
|||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 525; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.187.233 (0.006 с.) |

 - кількість речовини, моль;
- кількість речовини, моль;
 - маса речовини, г;
- маса речовини, г; - молекулярна маса, г/моль;
- молекулярна маса, г/моль;
 - кількість моль еквівалентів речовини, моль;
- кількість моль еквівалентів речовини, моль;
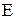 - еквівалент речовини, моль;
- еквівалент речовини, моль;
 - маса розчиненої речовини, г;
- маса розчиненої речовини, г; - маса розчину, г.
- маса розчину, г.
 - кількість певного компонента, моль;
- кількість певного компонента, моль; - сума кількостей моль усіх коспонентів, моль.
- сума кількостей моль усіх коспонентів, моль.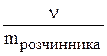 ,
, - маса розчинника, кг.
- маса розчинника, кг.




