
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Будова, ізомерія, номенклатура одноядерних аренівСодержание книги
Поиск на нашем сайте
Будова бензолу в світі сучасних уявлень про природу хімічних зв’язків. Сучасна структурна формула бензолу. Молекула бензолу має форму правильного плоского шестикутника. Усі атоми Карбону в бензольному циклі знаходяться в стані sp2-гібридизації. Кожний з них утворює три звичайних σ-зв’язки (за рахунок трьох гібридних орбіталей), які розташовані у просторі під кутом 120о. Негібридизовані р-орбіталі кожного атома Карбону орієнтовані перпендикулярно до площини бензольного кільця і перекриваються між собою над і під кільцем. В результаті виникає спільна електронна хмара і утворюється єдиний хімічний π-зв’язок для всіх атомів Карбону. Таким чином, шість π-електронів не локалізовані в пари, а утворюють єдину π-систему.
Таким чином, молекула бензолу - стійкий симетричний шестичленний цикл з однаковими СН-групами, які знаходяться в одній площині і зв’язані ароматичною системою зв’язків. Гомологи бензолу. Ізомери двозаміщених аренів: орто -, мета -, пара - ізомери).
Природні джерела та способи добування аренів Природні джерела ароматичних сполук: кам’яновугільна смола, коксовий газ. Арени також одержують ароматизацією нафти (каталітичне дегідрування циклоалканів, дегідроциклізація алканів). Синтез гомологів бензолу можна здійснювати за реакціями Вюрца-Фіттіга, Фріделя-Крафтса, тримеризації ацетилену, лужного сплавлення солей ароматичних кислот. Синтез Вюрца-Фіттіга (1864 р.):
Реакція Фріделя-Крафтса:
Сплавлення солей ароматичних кислот з лугами
Фізичні властивості ароматичних вуглеводнів Арени – малополярні сполуки і їхні фізичні властивості аналогічні властивостям аліфатичних вуглеводнів, які залежать від розміру та ізомерії замісників. Бензол та його найближчі гомологи – безбарвні рідини з характерним запахом, вищі гомологи - тверді речовини. Вони нерозчинні у воді, але добре розчиняються в органічних розчинниках. Легко загоряються і горять світним, сильно кіптявим полум’ям. Рідкі арени самі є гарними розчинниками органічних сполук. Пари та рідини токсичні, деякі речовини - канцерогенні. Література: [1] с. 75 - 83; [3] с. 185 – 192
ВЛАСТИВОСТІ АРЕНВ. БАГАТОЯДЕРНІ АРОМАТИЧНІ СПОЛУКИ Лекція №4 (1 година) План 1. Хімічні властивості аренів. 2. Окремі представники, похідні, їх значення і використання. 3. Арени з конденсованими циклами, їх будова, хімічні властивості. 4. Багатоядерні сполуки з неконденсованими циклами, їх будова, хімічні властивості. Хімічні властивості аренів Реакції електрофільного заміщення Правила заміщення в бензольному кільці. Якщо в бензольному ядрі є замісник, тоді інший замісник займає положення, яке залежить від характеру першого. Всі замісники за характером їх орієнтуючої дії поділяють на дві групи. Замісники першого роду – галогени, вуглеводневі радикали, гідроксильна і заміщена гідроксильна група, аміно- і заміщена аміногрупа – є орто -, та пара -орієнтантами. Замісники другого роду – карбоксильна група, альдегідна, сульфо-, нітро- групи та інші – мета- орієнтанти. Орієнтуюча дія замісників пояснюється їх різним впливом на реакційну здатність бензольного ядра. Замісники першого роду (крім галогенів) збільшують електронну густину бензольного ядра і таким чином активізують й поляризують його, в результаті чого на атомах Карбону в орто - і пара -положеннях виникає частково від’ємний заряд. Реакції заміщення прискорюються. Замісники другого роду зменшують електронну густину ядра і менше за все на атомах Карбону в мета -положеннях, внаслідок чого це положення стає найбільш реакційно здатним. Необхідно відмітити, що ці правила не мають абсолютного значення. У більшості реакцій поряд з переважною кількістю основного продукту реакції (згідно з правилами) утворюються й інші ізомери, в значно меншій кількості. Вплив замісників на бензольне кільце.
Реакції приєднання: гідрування, фотохімічне хлорування.
|
||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 1397; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.73.167 (0.008 с.) |










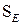 (алкілування, галогенування, нітрування, сульфування та ацилування) та їх механізм.
(алкілування, галогенування, нітрування, сульфування та ацилування) та їх механізм.






