
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Коагуляционный (плазменный, биохимический) гемостазСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Плазматическая фаза (биохимический гемостаз) осуществ- ляется при непосредственном участии системы свертывания кро- ви. Одновременно с тромбоцитарными активируются плазмен- ные факторы свертывания крови. Процесс свертывания крови представляет собой цепь последовательных реакций, в результате которых образуется красный тромб, основу которого составляет фибрин. В свертывании крови участвуют 12 плазменных факторов (прокоагулянтов), а также прекалликреин (фактор Флетчера) и высокомолекулярный кининоген (фактор Фитцджеральда). Обра- зование большинства прокоагулянтов происходит в печени, за исключением III фактора свертывающей системы – в тканях, IV (Са2+), XIII – в тромбоцитах, VIII – в эндотелии сосудов (табл. 19). Наиболее важные факторы II, VII,IX и X образуются в пече- ни при участии фермента γ-карбоксилазы, зависимой от витамина К. Витамин К зависимыми также являюся два антикоагулянтных протеина – протеин S и протеин С.
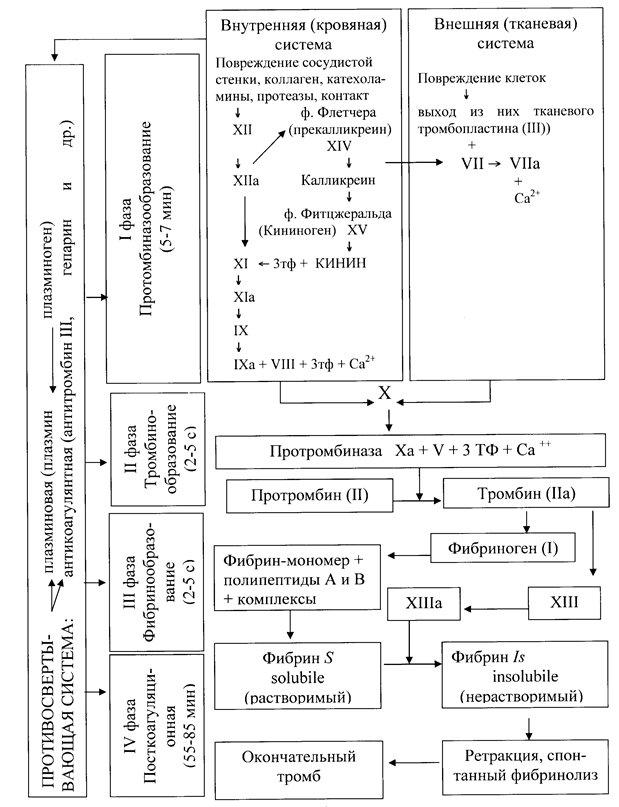
В процессе свертывания крови выделяют 4 фазы (рис. 68): I фаза – протромбиназообразование (контактно-калликреин- кинин-каскадная активация); II фаза – тромбинообразование; III фаза – фибринообразование; IV фаза – посткоагуляционная (ретракция и фибринолиз).
Продолжительность первых трех фаз свертывания крови со- ставляет 5-7 минут, вместе с IV фазой процесс свертывания крови длится 60-120 минут. Первая фаза направлена на образование активного протром- биназного комплекса, которое происходит по двум путям: внеш- нему (тканевому) и внутреннему (плазменному).
Внутренний (плазменный) путь активации свертывания крови
Этот путь активации свертывания крови получил такое на- звание потому, что все его компоненты находятся в циркули- рующей крови (рис. 68). In vivo этот путь реализуется совместно с внешним. Внутренний путь активации свертывания крови включает факторы XII, ХI, IX, VIII, кофакторы – высокомолеку- лярный кининоген и прекалликреин. Внутренний путь свертывания крови начинается с адсорб- ции факторов свертывания XII, XI, IX, высокомолекулярного ки- ниногена, прекалликреина на отрицательно заряженных поверх- ностях, таких как коллаген, базальная мембрана поврежденного сосуда. Связывание фактора XII с отрицательно заряженной по- верхностью вызывает конформационные изменения его молеку- лы и активирует его. Активации фактора XII способствуют также высокомолекулярный кининоген и калликреин, образующийся из прекалликреина.
Таблица 17. Плазменные факторы свертывания крови
Рис. 68. Схема свертывания крови
прекалликреин (фактор Флетчера); калликреин (активная форма прекалликреина); кининоген (фактор Фитцджеральда); кинины.
Калликреин участвует в активации фактора XII, кининовой системы, фибринолитической системы и системы комплемента. Активный фактор ХIIа превращает фактор IX в IХа, кото- рый, в свою очередь, активирует фактор VIII путем отщепления от последнего фактора фон Виллебранда. В последующем факто- ры VIIIa, IХа, ионы Са++ и фосфолипиды мембраны тромбоцитов формируют комплекс – «геназу», активирующий фактор X. Кинины являются полипептидами с низкой молекулярной массой. Они являются медиаторами воспалительных реакций, увеличивают сосудистую проницаемость, вызывают вазодилата- цию, артериальную гипотензию и сокращение гладкой мускула- туры.
Внешний (тканевый) путь активации свертывания крови
In vivo этот путь активации свертывания крови является ос- новным. Главными компонентами этого пути являются тканевой тромбопластин (тканевой фактор), активный фактор VIIа и ионы Са++. Тканевой тромбопластин представляет собой богатые фос- фолипидами мембранные липопротеины клеток тканей и посту- пает в кровь только при их повреждении, в том числе при повре- ждении эндотелия. Под влиянием тканевого тромбопластина происходит превращение неактивного фактора VII в активный фактор VIIа. Образованный комплекс (тканевой тромбопластин + VIIa + ионы Са++) напрямую и через IX активирует фактор X. В результате активации X фактора совместно с фактором Va и Са2+ образуется обладающий ферментативной активностью протромбиназный комплекс (фактор Ха + фактор Vа + ионы Са++ + 3ТФ). Фаза тромбинообразования
Во вторую фазу свертывания крови под действием про- тромбиназы происходит образование высокоспецифического протеолитического фермента тромбина (IIa), относящегося к се- риновым протеазам.
В третью фазу свертывания крови под влиянием тромбина происходит отщепление от фибриногена (I) фибринопептидных комплексов А и В с образованием фибрин-мономера (рис. 69), который полимеризуется, превращается в фибрин S (solubile) – растворимый (рис. 70).
Рис. 70. Схематическая модель молекулы фибриногена Под влиянием тромбина также происходит превращение не- активного фактора XIII (фибринстабилизирующего) в активный ХIIIа. Под действием фибринстабилизирующего фактора XIII плазмы в присутствии ионов Са++ связи в фибрин-полимере ста- новятся более прочными и образуется фибрин Is (insolubile – не- растворимый) в растворе 5М мочевины, 1% монохлоруксусной кислоты и очень медленно подвергающийся протеолизу в пр и- сутствии плазмина, что переводит растворимый фибрин- полимер в стабильный фибриновый сгусток (рис. 71).
Фибрин составляет основную массу красного тромба. В ячейках фибриновой сети находятся тромбоциты, лейкоциты, эритроциты, сыворотка (рис. 72, 73).
Рис. 72. Сканограмма тромба, полученная при помощи электронного микроскопа. Видны нити фибрина, агрегаты тромбоцитов, эритроциты и клетки эндотелия
На заключительном этапе тромбообразования (IV фаза свертывания крови – фаза ретракции и фибринолиза) под дейст- вием ретрактозима – 8 тромбоцитарный фактор (тромбостенин), наступает сокращение фибриновых волокон (сжатие, ретракция и уплотнение сгустка), а под влиянием плазмина – частичный ли- зис фибриновых нитей. Последняя фаза наиболее длительная. Она составляет 1,5-2 часа.
Свертывание крови находится под контролем противосвер- тывающей системы. Противосвертывающая система крови включает антикоа- гулянтную и фибринолитическую (плазминовую) системы.
Антикоагулянтная система
Действие антикоагулянтной системы направлено на угнете- ние свертывания крови. Она представлена ингибиторами сверты- вания крови (антитромбин-III, гепарин, антитрипсин, протеины C и S, α2-макроглобулин, ингибитор тканевого пути (тромбопла- стина). Антикоагулянты подразделяются на 2 группы: первичные антикоагулянты – вещества, синтезируемые постоянно, незави- симо от свертывания и фибринолиза крови (гепарин, серпины, антитромбин-III, гепариновый кофактор II) и вторичные – веще- ства, образующиеся из факторов свертывания крови и других белков в результате гемокоагуляции и фибринолиза – ПДФ (про- дукты деградации фибрина и фибриногена).
Рис. 74. Структура молекулы гепарина
Серпины, антитромбин-III, гепариновый кофактор II являются ингибиторами сериновых протеаз и блокируют актив- ные центры факторов свертывания крови (рис. 75). Протеин С и его кофактор протеин S – ингибируют ак- тивные факторы свертывания Va и VIIIа и повышают фибрино- литическую активность крови. Ингибитор тканевого пути (тромбопластина), соединяясь с Xа фактором, тормозит дальнейшие этапы коагуляционного каскада. В том числе и путем ингибирования VIIа фактора. Тромбомодулин является мембранным протеином эндоте- лиоцитов, который после связи с тромбином лишает последнего прокоагулянтной активности и повышает его способность акти- вировать протеин С. В свою очередь активный протеин С оказы- вает протеолитическое действие на факторы Va и VIIIa, усили- ваемое протеином S. ПДФ (продукты деградации фибрина и фибриногена) обла- дают антитромбиновым эффектом, препятствуют полимеризации фибрин-мономеров и угнетают адгезивно-агрегационную актив- ность тромбоцитов.
Рис. 75. Протеолитические белки и их функции
В качестве лекарственных средств используют антикоагу- лянты прямого и непрямого действия:
Антидотом гепарина является протамина сульфат.
К-витамин зависимых факторов свертывания крови (фенилин и производные кумарина – дикумарин, неодикумарин, синкумар). Плазминовая (фибринолитическая) система
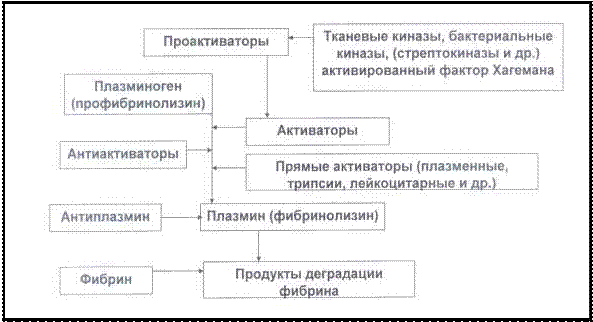
Плазминовая система включает: плазминоген (профермент), плазмин (фермент), а также продукты деградации фибрина ифибриногена (ПДФ): X, Y, D, E, которые образуются в процессе расщепления фибриногена и фибрина плазмином (рис. 76). Плазминоген – неактивный предшественник плазмина, гли- копротеин, синтезируемый в печени. Плазминоген циркулирует в
Рис. 76. Плазминовая (фибринолитическая) система крови
Действие плазминовой системы направлено на устранение (лизирование) тромба. Плазмин лизирует фибрин, разрушает фибриноген, факторы V, VII, IX, X, фактор Виллебранда и тром- боцитарные гликопротеины. Фибринолиз является способом уст- ранения окклюзии кровеносного сосуда, а также имеет большое значение в заживлении ран. Функция плазминовой системы регулируется (рис. 77): 1 – активаторами плазминогена (РА); 2 – ингибиторами активаторов плазминогена; 3 – ингибиторами плазмина.
Рис. 77. Ингибиторы плазмина, его активаторы и проактиваторы
1. Активаторы плазминогена (РА) осуществляют образо- вание плазмина из плазминогена. К ним относятся:
Тканевой активатор плазминогена – естественный метабо- лит организма, вырабатываемый эндотелием сосудистой стенки, моноцитами, мегакариоцитами, злокачественными клетками, со- держится во многих органах и тканях. Тканевый активатор плаз- миногена и плазминоген связываются с фибриновыми нитями тромба, и это сразу же приводит к превращению плазминогена в плазмин. Под влиянием плазмина происходит расщепление фиб- рина. В настоящее время препарат получают, используя реком- бинантные технологии (альтеплаза, ретеплаза, дутеплаза). Широ- ко используется в качестве тромболитического препарата для ле- чения венозных тромбозов и тромбоэмболий.
Урокиназа – протеаза, образуемая из ее неактивного пред- шественника – проурокиназы выделенная из мочи, образуется фибробластами, моноцитами, макрофагами и эпителиальными клетками. Активирует фибрин-связанный плазмин, разрушает внеклеточный матрикс тканей, что создает условия для миграции клеток.
В активации плазминогена могут участвовать нефизиологи- ческие факторы – стрептокиназа (стрептаза, кабикиназа) – не- ферментный белок, продуцируется β-гемолитическим стрепто- кокком; анистрептлаза (АПСАК – анизоилированный плазмино- ген-стрептокиназный комплекс, неактивная форма стрептокина- зы), стафилокиназа (секретируется некоторыми штаммами золо- тистого стафилококка). Применяются для лечения острого тромбоза легочной арте- рии, периферических артерий и глубоких вен нижних конечно- стей в качестве тромболитических средств. При коронарной окк- люзии они эффективны в 60-75% случаев.
2. Ингибиторы активаторов плазминогена (РАI): – ней- трализуют РА путем образования неактивного комплекса. Ингибиторами активаторов плазминогена являются ингиби- торы активатора плазминогена 1-го, 2-го и 3-го типов (PAI-1, PAI-2, PAI-3),
ливается в тромбоцитах преимущественно (~95%) в неактивном состоянии.
 РАI-2 – выделен из плаценты, лейкоцитов, макрофагов, его содержание значительно увеличивается в III триместре бере- менности. РАI-2 – выделен из плаценты, лейкоцитов, макрофагов, его содержание значительно увеличивается в III триместре бере- менности.
РАI-3 – обнаружен в моче, получен из фибробластов.
3. Ингибиторы плазмина:
ние, которое возрастает при дефиците α2-АР и α2-MG.
В качестве антидота при фибринолитической терапии может быть использована ε-аминокапроновая кислота (ε -АКК), обла- дающая антифибринолитическим действием.
Особенности гемостаза в детском возрасте
Большинство показателей гемостаза детей в возрасте от 1 года до 14 лет существенно не отличаются от соответствующих показателей у взрослых. У детей в возрасте до 1 года величины отдельных показателей (время свертывания крови, содержание тромбоцитов и ряд параметров, характеризующих гемостатиче- ские свойства кровяного сгустка) могут незначительно отличать- ся от таковых у более старших детей, что отражает функциональ- ные особенности периода новорожденности. У доношенного здо- рового ребенка имеет место низкий уровень контактного фактора XII (Хагемана), факторов Флетчера (прекалликреина) и Фитцже- ральда (высокомолекулярного кининогена). Отмечен более низкий уровень К-витаминзависимых факто- ров (протромбина, проконвертина, Стюарт-Прауэра) у доношен- ных новорожденных в первый день жизни. Наиболее интенсивно содержание этих факторов повышается в течение 2-6 месяцев, достигая к году содержания старших детей. Уровень К- витаминзависимых антикоагулянтов (протеина S и протеина С) после рождения в 2 раза меньше, чем у детей старшего возраста и взрослых. Уровень антитромбина III у доношенных новорожденных в два раза ниже, чем в 6-ти месячном возрасте и у взрослых. Хронометрические показатели коагуляционного гемостаза у недоношенных новорожденных изменяются аналогично таковым у доношенных детей, но гипокоагуляция у них более выражена.
ГЕМОСТАЗИОПАТИИ
Гемостазиопатии – болезни системы гемостаза – патологи- ческие состояния вследствие наследственного или приобретенно- го нарушения одного, двух или сразу всех компонентов системы гемостаза – сосудистой стенки, тромбоцитов и системы сверты- вания крови.
В зависимости от клинических проявлений нарушения сис-темы гемостаза можно разделить на три большие группы: 1. Тромбофилические гемостазиопатии, клинически прояв- ляющиеся тромбозами и тромбоэмболиями. 2. Геморрагические гемостазиопатии – нарушения гемоста- за, проявляющиеся посттравматическими или спонтанными кро- вотечениями вследствие наследственного, врожденного или при- обретенного дефекта сосудистого, тромбоцитарного либо коагу- ляционного компонентов системы гемостаза. 3. Тромбогеморрагические гемостазиопатии, проявляющие- ся сочетанием тромбозов и геморрагий множественного характе- ра.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 755; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.226.187.60 (0.013 с.) |


 Фаза фибринообразования
Фаза фибринообразования Рис. 69. Структура фибриногена
Рис. 69. Структура фибриногена
 Рис. 71. Схема процесса фибринообразования
Рис. 71. Схема процесса фибринообразования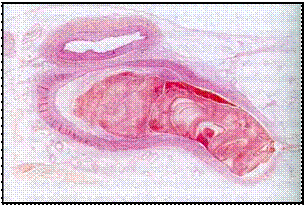

 Рис. 73. Красный тромб на разрезе в сосудистом русле
Рис. 73. Красный тромб на разрезе в сосудистом русле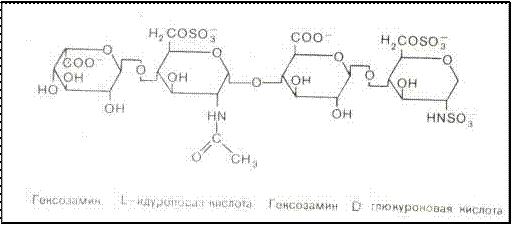 Гепарин – сульфатированный мукополисахарид, синтезиру- ется в тучных клетках, в большом количестве содержится в пече- ни и легких (рис. 74). Является антикоагулянтом прямого дейст- вия, непосредственно ингибируя факторы свертывания крови (XII, XI, X, IX, VII и II). Также гепарин блокирует биосинтез тромбина; уменьшает агрегацию тромбоцитов, активирует не- ферментный фибринолиз. Действие гепарина проявляется в ком- плексе в антитромбином III (кофактором гепарина) как in vivo, так и in vitro. Также он угнетает активность гиалуронидазы, улучшает кровоток.
Гепарин – сульфатированный мукополисахарид, синтезиру- ется в тучных клетках, в большом количестве содержится в пече- ни и легких (рис. 74). Является антикоагулянтом прямого дейст- вия, непосредственно ингибируя факторы свертывания крови (XII, XI, X, IX, VII и II). Также гепарин блокирует биосинтез тромбина; уменьшает агрегацию тромбоцитов, активирует не- ферментный фибринолиз. Действие гепарина проявляется в ком- плексе в антитромбином III (кофактором гепарина) как in vivo, так и in vitro. Также он угнетает активность гиалуронидазы, улучшает кровоток.
 крови и в норме, при отсутствии тромбов, но концентрация его повышается при наличии воспалительных процессов в организме. Плазминоген обладает способностью абсорбироваться фибрином и инкорпорироваться в фибриновый тромб. Плазминоген под влиянием специфических активаторов превращается в плазмин, осуществляющий медленное разрушение фибринового тромба.
крови и в норме, при отсутствии тромбов, но концентрация его повышается при наличии воспалительных процессов в организме. Плазминоген обладает способностью абсорбироваться фибрином и инкорпорироваться в фибриновый тромб. Плазминоген под влиянием специфических активаторов превращается в плазмин, осуществляющий медленное разрушение фибринового тромба.



