Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Этиология и патогенез лейкозовСодержание книги
Поиск на нашем сайте
Этиология лейкозов многофакторна и до конца не выясне- на. Для объяснения возникновения данной патологии предложе- ны радиационная, химическая, вирусная и генетическая теории. Каждая из них подтверждается отдельными фактами, но ни одна не может считаться универсальной в отношении всех известных видов лейкозов. В подтверждение радиационной теории свиде- тельствуют факты повышения заболеваемости острым и хрони- ческим миелолейкозом у жителей Хиросимы и Нагасаки, у лиц принимавших участие в ликвидации последствий аварии на Чер- нобыльской атомной станции, у рентгенологов и радиологов, у детей, облученных in utero. В эксперименте на животных показана возможность инду- цировать лейкозы метилхлорантреном, диметилбензантраценом и др., что свидетельствует в пользу химической теории лейкогене- за. Повышена частота заболеваний острыми лейкозами у людей, имеющих длительный контакт с бензолом и летучими органиче- скими растворителями, полициклическими углеводородами, мышьяковистыми соединениями, азокрасками, алкилирующими цитостатическими препаратами (циклофосфан, миелосан, хлор- бутин). Среди химических веществ, способных вызывать разви- тие лейкоза, важная роль принадлежит бензолу, широко исполь- зуемому в промышленности. Хроническое действие бензола име- ет место при длительном курении. Известно, что у мужчин, вы- куривающих 20 пачек сигарет в год, риск заболеть острым мие- лоидным лейкозом в 3-4 раза выше, чем у некурящих. Кроме то- го, бензол может выступать в роли кокоанцерогена, провоцируя действие других канцерогенов, содержащихся в табачном дыме (уретан, нитрозамины и др.). Химиотерапевтические вещества, использующиеся для лечения злокачественных новообразований, также повышают риск развития лейкозов (хларамбуцил, нитро- зомочевина и др.). Эти же вещества способны вызывать хромо- сомные мутации. В развитии лейкозов человека возможно уча- стие эндогенных химических канцерогенов, в том числе произ- водных ароматических аминокислот, особенно тирозина и трип- тофана. В основе вирусной теории лежат факты, свидетельствую- щие о возможности вирусов вызывать лейкозы у животных – птиц, мышей, крыс, хомячков, кошек, крупного рогатого скота. У человека доказано вирусное происхождение лимфомы Беркитта (вирус Эпштейна-Барр), Т-клеточного лимфолейкоза (ретровиру- сы HTLV-I).У 25 % больных лимфогранулематозом (болезнь Ходжкина) выделен вирус Эпштейна-Барр. Установлено, что в геноме этих вирусов существуют специфические гены, непосред- ственно отвечающие за транформацию нормальной гемопоэтиче- ской клетки в лейкозную. Эти гены получили название онкоге- нов. Гены клеток, гомологичные вирусным и активирующиеся при контакте с ним, получили название протоонкогенов. На дан- ный момент у человека установлена локализация более 60 прото- онкогенов, после взаимодействия с вирусом в них происходят то- чечные мутации и вызывают развитие лейкозов. В процессах пролиферации большую роль играет продукция онкобелков – факторов роста, кодируемых онкогенами. Генетическая теория имеет ряд убедительных аргументов. Значительно увеличивают риск развития опухолей наличие гене- тических дефектов. У больных с лейкозами часто выявляются хромосомные и геномные мутации. Среди хромосомных мутаций имеют наибольшее значение транслокации и делеции. У больных хроническим миелолейкозом выявляется филадельфийская хро- мосома, которая образуется в результате транслокации t (9;22) части длинного плеча (q) хромосомы 22 в хромосому 9 и обрат- ной транслокации части хромосомы 9 (онкогена abl) на хромосо- му 22 с формированием химерного (гибридного) онкогена bcr/abl (химерные гены – это гены, образующиеся на границе хромосом- ных транслокаций). Продукт этого гена (тирозинкиназа) ведет к фосфорилированию огромного количества протеинов, участвую- щих в передаче сигнала с рецепторов клеточной мембраны к ге- нетическому материалу ядра. Активация большого количества различных сигнальных путей ведет к независимой от ростовых факторов пролиферации, уменьшению адгезии клеток к стро- мальному окружению и недостаточности апоптоза. Известны случаи семейных лейкозов. При развитии лейкоза у одного из близнецов у второго близнеца отмечается высокая вероятность развития лейкозов (25%). К возникновению лейкозов предрасполагают болезни, связанные с геномными мутациями (болезнь Дауна, синдром Клайнфельтера, Тернера и др.). При бо- лезни Дауна (трисомия 21) острый миелоидный лейкоз наблюда- ется в 20 раз чаще, чем у здоровых лиц. По-видимому, все перечисленные факторы действуют ком- плексно, приводя к злокачественному перерождению гемопоэти- ческих клеток. Патогенез. В настоящее время общепризнанной является клональная теория патогенеза гемобластозов, согласно которой лейкозные клетки являются потомством одной мутировавшей ге- мопоэтической клетки-предшественницы. Ее доказательством яв- ляется обнаружение в кариотипе подавляющего большинства опухолевых клеток одних и тех же хромосомных аберраций. Все теории развития лейкоза основаны на представлении о ведущей роли онкогена, или гена, кодирующего фактор роста в канцерогенезе. Согласно первой концепции вирусы вносят в клетки ген «роста», вследствие чего последний начинает давать «ошибочную» программу клетке в виде безудержной пролифера- ции. Согласно другим представлениям все клетки содержат онко- ген в заторможенном состоянии (протоонкоген), который активи- руется вследствие мутаций либо эпигеномных нарушений регу- ляции активности гена-репрессора под воздействием канцерогена и коканцерогена, что приводит к безудержной клеточной проли- ферации. Изменения генетической регуляции клетки лежат в основе биохимических особенностей опухолевой ткани. В результате репрессии одних генов прекращается синтез сопряженных с ними ферментов, структурных белков и др., дерепрессия других ведет к тому, что в клетке появляются новые типы белков, изоферментов. Как правило, репрессируется выработка ферментов и белков, по- зволяющих клетке выполнять специализированную функцию, и активируются ферменты, которые обеспечивают клеточное деле- ние. Согласно современным представлениям лейкозы в развитии проходят два этапа: первый – образование доброкачественной моноклоновой опухоли и второй – формирование злокачествен- ной опухоли с признаками поликлоновой трансформации. На первом этапе развития лейкозов появляется мутировав- шая клетка, обладающая способностью интенсивно пролифери- ровать и давать потомство – клон. На этом этапе отсутствуют признаки полиморфизма, частично сохранена способность к дифференцировке, метастазирование в органы и ткани отсутству- ет. На втором этапе опухоль становится поликлоновой, приоб- ретает черты злокачественной, утрачивая способность к диффе- ренцировке. В формировании опухолевого клона и метастазировании опухоли большую роль играет подавление апоптоза, что обуслов- лено мутацией гена p53, контролирующего его активность. Клет- ки опухолевого клона созревают медленно, лишены способности к программированной гибели, дольше находятся в стадии проли- ферации и имеют преимущества в росте перед нормальными стволовыми элементами.
ция); В патогенезе опухолевого роста различают 3 этапа: §трансформация здоровой клетки в опухолевую (инициа-
§ промоция; §прогрессия.
Трансформация, или инициация, представляет образование клона мутировавших клеток под действием канцерогенов. Трансформация заключается в приобретении здоровой исходной клеткой способности беспредельно размножаться и ее передаче дочерним клеткам по наследству. Инициация – процесс много- стадийный. Трансформированные клетки могут оставаться в тка- ни длительное время в неактивной форме. Вторым этапом в механизме канцерогенеза является промо- ция (активизация). Она происходит под влиянием веществ- промоторов или коканцерогенов (кротоновое масло и др.). До- полнительное воздействие коканцерогенами (промоторами) при- водит к размножению находящихся в латентном состоянии опу- холевых клеток (моноклоновая стадия). Далее происходит рассе- ление лейкозных клеток в костном мозге с угнетением нормаль- ного гемопоэза. Большинство канцерогенов являются полными, т.е. вызывают трансформации и промоцию. Прогрессия – третий этап механизма канцерогенеза. Вслед- ствие возникновения новых мутаций в лейкозных клетках, в том числе после проведенного лечения (химиотерапия), происходит формирование множества клонов лейкозных клеток (поликлоно- вая стадия) и отбор наиболее автономных из них, что ведет к ма- лигнизации заболевания. На этой стадии опухоли лейкозные клетки становятся устойчивыми к терапии и метастазируют в другие органы и ткани. Лейкозы характеризуются анаплазией, гиперплазией, дис- плазией и метаплазией кроветворной ткани. Анаплазия – неспособность к дифференцировке (дедиффе- ренцировка), созреванию форменных элементов крови с наруше- нием их функций. Гиперплазия – избыточная продукция клеток, находящихся на различных стадиях созревания. Метаплазия – перерождение нормальных очагов кроветво- рения в костном мозге. Дисплазия – вытеснение из красного костного мозга здоро- вых ростков гемопоэза: эритроцитарного, лейкоцитарного и ме- гакароцитарного, что приводит к развитию клинических синдро- мов лейкоза.
Лейкозная клетка является потомком мутированной клетки II-IV класса развития, которая способна к размножению, но не способна к дифференцировке и выполнению специфических функций. Клетка увеличена в размере (в 2-3 раза больше нормы) либо уменьшена до размера лимфоцита с увеличением ядерно- цитоплазматического соотношения, характерна деформация ядерных контуров, вакуолизация ядра, увеличение количества нуклеол до 8 и более, базофилия цитоплазмы, ее вакуолизация.
Классификация лейкозов
По патогенетическому принципу (степени нарушения дифференцировки лейкозных (опухолевых) клеток) лейкозы разделяют на острые и хронические. К острым лейкозам относят лейкозы с полной остановкой дифференцировки и созревания гемопоэтических клеток на уров- не II-IV классов. Морфологическим субстратом опухоли и клет- ками, циркулирующими в крови, при острых лейкозах являются бластные клетки соответствующего ряда гемопоэза (миелобла- сты, лимфобласты, монобласты и др.). Гематологическая картина острого лейкоза характеризуется наличием в крови большого количества бластов и лейкемическим провалом – «hiatus leucaemicus» (присутствие в крови бластов и в небольшом количестве зрелых клеток и отсутствии созревающих форм). Иногда субстратом опухоли могут быть промиелоциты и промоноциты. При остром недифференцированном лейкозе суб- стратом опухоли являются клетки II и III классов, которые мор- фологическими методами не дифференцируются. При превыше- нии количества клеток лейкозного клона более 30% состава кост- ного мозга, как правило, они появляются в периферической кро- ви. При хронических лейкозах отмечается частичная задержка способности к дифференцировке и созреванию кроветворных клеток. При хронических лейкозах патоморфологическим суб- стратом опухоли являются бластные клетки (IV класс), созре- вающие клетки (V класс), достигшие определенного уровня диф- ференцировки, и зрелые клетки (VI класс). Острые и хронические лейкозы развиваются на разной кло- нальной основе. Острые лейкозы не переходят в хронические. При хроническом лейкозе возможна утрата способности диффе- ренцироваться некоторыми клонами.
Острые лейкозы
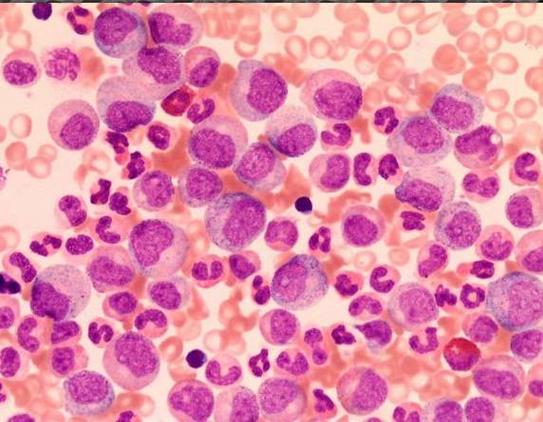
Вариантами острого лейкоза являются миелобластный, лимфобластный, монобластный, промиелоцитарный, плазмобла- стный, мегакариобластный, эритромиелоз, недифференцирован- ный и др. При острых миелобластных лейкозах число лейкоцитов крови может достигать (100-150) х 109 /л и выше; часто оно держится на уровне (20-30) х 109/л и ниже. В мазке крови наряду с незначительным количеством зрелых сегментированных нейтрофилов нередко все поле зрения усеяно миелобластами (рис. 49). Для острого миелобластного лейкоза характерно в перифе- рической крови полное отсутствие промежуточных форм (про- миелоцитов, миелоцитов, метамиелоцитов) – «лейкемический провал».
Рис. 49. Большое содержание бластных клеток в периферической крови
У детей чаще всего (80 % случаев) встречается острый лим- фобластный лейкоз. Другие формы острых лейкозов наблюдают- ся значительно реже. Хроническим миелолейкозом дети болеют редко (5% лейкозов).
При остром лимфобластном лейкозе в крови преобладают лимфобласты (рис.50).
В 1975 г. гематологами Франции, США и Великобритании была предложена классификация (FAB-классификация) острых лейкозов на миелобластные и лимфобластные. Морфологическая FAB-классификация острых миелобласт- ных и лимфобластных лейкозов представлена в таблицах 13 и 14.
Рис. 50. Картина крови при остром лимфобластном лейкозе. В периферической крови присутствует большое количество бластных клеток
Таблица 13. Морфологическая FAB-классификация острых миелобластных лейкозов
Таблица 14. Морфологическая FAB-классификация острых лимфобластных лейкозов
В настоящее время требованиям клиницистов больше удов- летворяет иммунологическая классификация острых лимфобла- стных лейкозов (EGIL, 1995), согласно которой выделяют острый лимфобластный лейкоз В-клеточной линии и Т-клеточной линии.
Хронические лейкозы
Среди хронических лейкозов выделяют миелолейкоз, лим- фолейкоз, моноцитарный и миеломную болезнь (плазмоцитома) и др. При хроническом миелолейкозе наряду с резким повышени- ем общего количества лейкоцитов (до 600х109/л крови) наблюда- ется появление в периферической крови огромного количества гранулоцитов на ранних стадиях развития: миелобластов, про- миелоцитов, миелоцитов, метамиелоцитов (рис.51).
Рис. 51. Картина крови при хроническом миелолейкозе
1 – нейтрофильный промиелоцит; 2 – миелоциты; 3 – метамиелоцит; 4 – палочкоядерный лейкоцит; 5 – сегментоядерный лейкоцит Процентное содержание зрелых и созревающих нейтрофи- лов в лейкоцитарной формуле становится преобладающим. При хронических миелолейкозах в крови имеет место также повы- шенное количество эозинофильных и базофильных миелоцитов (эозинофильно-базофильная ассоциация). В редких случаях миелолейкоза лейкемическая картина кро- ви может наблюдаться при нормальном и даже пониженном об- щем количестве лейкоцитов в крови. В других случаях картина крови может быть нормальной, а диагноз лейкоза ставится лишь при исследовании пунктата костного мозга (алейкемический миелолейкоз). «Обострение» хронического лейкоза характеризуется значи- тельным увеличением в периферической крови большого количе- ства (более 30%) бластных клеток («бластный криз»).
Рис. 52. Бластный криз при хроническом миелолейкозе
При хроническом лимфолейкозе преобладают зрелые лим- фоциты, присутствуют единичные лимфобласты, тени Боткина- Гумпрехта, представляющие собой разрушенные при приготов- лении мазка лимфоциты (рис. 53).
Рис. 53. Картина крови при хроническом лимфолейкозе
* – тени Боткина-Гумпрехта
Классификация хронических лейкозов (Новицкий В.В., Гольдберг Е.Д., Уразова О.И., 2009): 1. Хронические миелопролиферативные лейкозы: хронический миелолейкоз хронический моноцитарный (миеломоноцитарный) лейкоз хронический нейтрофильный лейкоз хронический эозинофильный лейкоз / гиперэозино- фильный синдром эссенциальная тромбоцитопения эритремия (истинная полицитемия) идиопатический миелофиброз (сублейкемический мие- лоз) 2. Хронические лимфопролиферативные лейкозы: хронические В-клеточные лейкозы: - хронический лимфолейкоз - В-клеточный пролимфоцитарный лейкоз
множественная миелома (миеломная болезнь) макроглобулинемия Вальденстрема болезнь тяжелых цепей - волосатоклеточный лейкоз хронические Т/NK-клеточные лейкозы: - Т-клеточный пролимфоцитарный лейкоз - Т-клеточный лейкоз из больших гранулярных лим- фоцитов - агрессивный NK-клеточный лейкоз
 По изменению количества лейкоцитов и их качественной характеристике в периферической крови различают лейкемиче-скую (лейкоцитоз более 50 109/л, бласты составляют основную массу клеток крови), сублейкемическую (количество лейкоцитов выше нормы, но до 50 109/л, со значительным количеством бла- стных клеток), лейкопеническую (количество лейкоцитов ниже нормы, в крови небольшое количество бластных клеток) и алей-кемическую (содержание лейкоцитов близко к норме с отсутст- вием в периферической крови патологических форм лейкоцитов) формы лейкоза. Лейкопенические формы составляют 40-50% всех случаев острого лейкоза. По изменению количества лейкоцитов и их качественной характеристике в периферической крови различают лейкемиче-скую (лейкоцитоз более 50 109/л, бласты составляют основную массу клеток крови), сублейкемическую (количество лейкоцитов выше нормы, но до 50 109/л, со значительным количеством бла- стных клеток), лейкопеническую (количество лейкоцитов ниже нормы, в крови небольшое количество бластных клеток) и алей-кемическую (содержание лейкоцитов близко к норме с отсутст- вием в периферической крови патологических форм лейкоцитов) формы лейкоза. Лейкопенические формы составляют 40-50% всех случаев острого лейкоза.
Рис. 54. Частота встречаемости различных видов лейкозов в зависимости от возраста
|
|||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 1289; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.113 (0.011 с.) |