Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Принципы коррекции нарушений гемостаза.Содержание книги
Похожие статьи вашей тематики
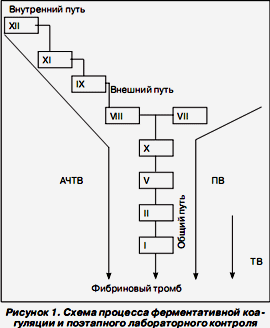
Поиск на нашем сайте Система гемостаза — это биологическая саморегулирующаяся система поддержания жидкого состояния крови и остановки кровотечений. Современная стратегия интенсивной терапии нарушений в системе гемостаза предполагает комплексное воздействие на основные элементы системы регуляции агрегатного состояния крови — эндотелий сосудистой стенки, тромбоциты и плазменные факторы свертывания крови. Установлена последовательность реакций гемостаза при остановке кровотечения: 1) вазоконстрикция (в течение нескольких секунд); 2) образование первичной тромбоцитарной пробки (до 2 минут); 3) образование фибринового сгустка (5–15 минут); 4) процесс репарации (заживления раны) с вовлечением фибринолиза (от нескольких дней до Классическая концепция системы гемостаза рассматривает следующие ее компоненты: сосудисто-тромбоцитарное звено (первичный гемостаз), систему ферментативной коагуляции (вторичный гемостаз), антикоагулянтную систему и фибринолитическую систему. Установлено, что процессы активации сосудисто-тромбоцитарного и ферментативного гемостаза взаимосвязаны. Выделение этих звеньев достаточно условно и целесообразно лишь с позиций удобства изучения, как в плане лабораторной диагностики, так и в плане фармакологического воздействия. В последнее десятилетие концепция системы регуляции агрегатного состояния крови подверглась значительному пересмотру. Установлено, что в запуске процесса свертывания крови основную роль играет взаимодействие тканевого фактора (TF), эндотелия сосудов и лейкоцитов. Изучена тромборегуляторная функция эндотелия. Все вещества, секретируемые эндотелием и участвующие в гемостазе и тромбозе, можно, в известной степени условно, разделить на две группы — тромбогенные и атромбогенные. Тромбогенные факторы: 1) индукторы адгезии и агрегации тромбоцитов — (фактор фон Виллебранда (vWF), фактор активации тромбоцитов (PAF), аденозин-дифосфорная кислота (АДФ), тромбоксан А2, (TXA2); 2) ингибиторы активаторов плазминогена (PAI-1, PAI-2). Атромбогенные факторы: 1) дезагреганты (простациклин, оксид азота и др.); 2) антикоагулянты — ингибиторы образования тромбина (ингибитор пути тканевого фактора ((tissue factor pathway inhibitor — TFPI), тромбомодулин, протеогликаны и др.); 3) активаторы фибринолиза (тканевой активатор плазминогена — t-PA). В физиологических условиях образование атромбогенных веществ в эндотелии преобладает над образованием тромбогенных, что обеспечивает сохранение жидкого состояния крови при повреждениях сосудистой стенки, в том числе незначительных, случайных, которые могут иметь место в норме. Секреция атромбогенных веществ определяет тромборезистентность кровеносных сосудов. Эндотелиальные тромборегуляторы — vWF, PAF, АДФ, ТХА2, PGI2, NО — влияют на тромбообразование на раннем этапе, еще до образования тромбина, и поэтому их относят к группе ранних тромборегуляторов. Атромбогенные вещества сосудистой стенки, ингибирующие тромбиногенез, инактивирующие прокоагулянты, активирующие фибринолиз, можно отнести к группе поздних тромборегуляторов. Принципиально важно для физиологических состояний то, что и ранние, и поздние тромборегуляторы, препятствуя адгезии и агрегации тромбоцитов, не препятствуют гемостазу при повреждении сосудов, но ограничивают процесс тромбообразования. В этом и заключается значение тромборезистентности. На процесс тромбообразования огромное влияние оказывают эндотелиальные вазодилататоры и вазоконстрикторы. К вазодилататорам относят оксид азота, эндотелиальный гиперполяризующий фактор EDHF, простациклин, пуриновые основания (АТФ, АДФ и другие, источниками которых являются тромбоциты, эндотелиоциты, нейроны), эндогенные каннабиоиды, натрийуретические пептиды NP, адреномедуллин, моноокись углерода (образуется преимущественно в эндотелии сосудов мозга), продукты активации калликреин-кининовой системы (брадикинин и каллидин). Перечисленные выше вазодилататоры способствуют снижению системного артериального давления при шоках различного генеза и могут принимать участие в местных сосудистых реакциях, поддерживая вазодилатацию при воспалении. К вазоконстрикторам относят: эндотелины, 20-гидроксиэйкозотриеновую кислоту, ангиотензин II, который является наиболее сильным вазоконстриктором с выраженным уменьшением тромборезистентности сосудов (путем стимуляции выработки ингибитора активатора плазминогена, PAI–I), что способствует предрасположенности к тромботическим осложнениям), ТХА2. Кроме того, эндотелиальные клетки постоянно испытывают воздействие гемодинамических факторов (пристеночное напряжение сдвига, трансмуральное давление, напряжение и изгибы в связи с пульсацией). Имеются убедительные доказательства влияния гемодинамических факторов на тромбогенные свойства и тромборезистентность сосудов. Таким образом, тромбы могут образовываться в артериях, венах, полостях сердца. У больных, находящихся в критическом состоянии, возможно развитие диссеминированного внутрисосудистого свертывания крови в мелких сосудах (синдрома ДВС). При нарушениях первичного гемостаза (эндотелиальная дисфункция, повышенная агрегационная способность тромбоцитов) и метаболических нарушениях (гиперлипидемия, сахарный диабет, гомоцистеинемия, васкулиты) тромбы чаще образуются в артериях. При недостатке ингибиторов факторов свертывания: антитромбина III (АТ III), протеина С (PC) и протеина S — в венах. Различие гидродинамических характеристик в сосудах разной принадлежности, калибра и локализации определяет в значительной степени уровень их тромбогенности и тромборезистентности. Увеличение продукции и выделения тромбогенных веществ — неспецифическая реакция на повреждение и активацию прежде всего эндотелия. При некоторых патологических процессах эта реакция сопровождается депрессией атромбогенных механизмов. Исследовано участие эндотелия в процессах воспаления и его роль в активации системы гемостаза. К основным проявлениям воспаления относят повышение кровенаполнения капилляров, изменение их проницаемости, а также усиленную миграцию лейкоцитов через эндотелий в направлении воспалительного очага. Взаимодействие лейкоцитов с эндотелием происходит посредством специальных адгезивных молекул, которые представлены как на эндотелиоцитах, так и на лейкоцитах. Молекулы адгезии, регулирующие миграцию лейкоцитов, по структурным признакам относятся к разным, но родственным семействам, в том числе к суперсемейству иммуноглобулинов (эндотелиальные молекулы клеточной адгезии), семейству селектинов или семейству интегринов. Молекулы межклеточной адгезии — это связанные с плазматической мембраной белки, которые обеспечивают механическое взаимодействие клеток друг с другом. Экспрессия лейкоцитарных молекул адгезии зависит от популяции клеток и стадии их дифференцировки. На эндотелии представлены Р- и Е-селектины, которые связываются с сиалированными гликопротеинами мембраны лейкоцитов. L-селектин, расположенный исключительно на лейкоцитах, связывается с гликопротеинами мембраны эндотелия. Другая группа эндотелиальных молекул адгезии — межклеточная молекула адгезии-1 (ICAM-1, intercellular adhesion molecule-1) и сосудистая клеточная молекула адгезии (VCAM-1, vascular cellular adhesion molecule-1) из суперсемейства иммуноглобулинов — связывается с интегринами мембраны лейкоцитов. Основными рецепторами ICAM-1 на лейкоцитах являются β2-интегрины. Основным регулятором процесса адгезии лейкоцитов является сам эндотелий. В нормальных условиях на эндотелии представлена в небольшом количестве конститутивная молекула адгезии ICAM-2, посредством которой происходит формирование маргинального пула лейкоцитов в венозных сосудах желудочно-кишечного тракта, легких и других органах. Стимуляция эндотелия или его повреждение приводят к дополнительной экспрессии молекул адгезии — селектинов, ICAM-1 и VCAM-1. Адгезия лейкоцитов проходит в две стадии: 1) стадия роллинга (прокатывания лейкоцитов вдоль эндотелия) и 2) стадия плотной адгезии (остановки лейкоцитов). Эти стадии связаны с различными адгезивными молекулами, поскольку последовательность и время экспрессии молекул адгезии различны. Под действием Р- и Е-селектинов осуществляется частичная задержка лейкоцитов с неполной остановкой на поверхности эндотелия — роллинг. Причем Р-селектин обеспечивает начальную стадию — прокатывание вдоль поверхности эндотелия, так называемый быстрый роллинг лейкоцитов, скорость которого начинает замедляться при экспрессии Е-селектина. Экспрессия ICAM-1 и VCAM-1 способствует полной остановке лейкоцитов для обеспечения их последующего диапедеза в ткани. Необходимо отметить, что для контакта интегринов лейкоцитов с эндотелиальными молекулами адгезии требуется активация лейкоцитов цитокинами, которая начинается на самых ранних стадиях синдрома системного воспалительного ответа (ССВО). В развитии органной недостаточности на фоне ССВО ведущая роль принадлежит эндотелиальной дисфункции и активации прокоагулянтного звена системы гемостаза. В широком смысле эндотелиальная дисфункция может быть определена как неадекватное (увеличенное или сниженное) образование в эндотелии различных биологически активных веществ. Причинами эндотелиальной дисфункции могут быть различные факторы: ишемия/гипоксия тканей; возрастные изменения; свободнорадикальное повреждение (оксидантный стресс); дислипопротеинемия (гиперхолестеринемия, ЛПОНП); гипергомоцистеинемия; гипергликемия; гипертензия (как симптоматическая, так и гипертоническая болезнь); эндогенные интоксикации с выбросом цитокинов (инфекционные процессы, сепсис); экзогенные интоксикации. Вышеизложенные сведения об эндотелиальной дисфункции, синдроме системного воспалительного ответа и активации коагуляции не оставляют сомнений по поводу тесной взаимосвязи этих процессов, которые изначально инициируются как защитные. Преодолев барьер биологической целесообразности, они приводят к возникновению микро- и макроциркуляторных тромбозов с последующим развитием полиорганной недостаточности. Обилие причин, при которых может возникнуть эндотелиальная дисфункция, свидетельствует об универсальности патогенетических механизмов и актуальности изучения этой проблемы различными специалистами. В настоящее время выделяют следующие этапы процесса гемостаза: I. Первичный, или сосудисто-тромбоцитарный, гемостаз, в котором участвуют сосуды и тромбоциты. Продолжительность фазы — 3–5 минут. Конечный продукт — тромбоцитарній сгусток. Субэндотелий, который состоит из базальной мембраны, коллагена, эластиновых волокон, протеогликанов, фибронектина и фактора фон Виллебранда, обладает свойствами, активирующими оба звена системы гемостаза. После повреждения эндотелия и обнажения субэндотелиальных структур ведущая роль в реализации первичного гемостаза принадлежит адгезивно-агрегационной функции тромбоцитов. Тромбоциты первыми появляются в месте дефекта. Они прилипают (адгезируют) к поврежденным эндотелиальным клеткам, коллагену базальной мембраны; набухают и образуют отростки. Параллельно адгезии протекает процесс агрегации тромбоцитов, набухание и склеивание их между собой с образованием отростков и наложением агрегатов на участок повреждения сосуда, вследствие чего гемостатическая пробка или тромб быстро растет. В результате реакции дегрануляции из тромбоцитов высвобождаются дополнительные индукторы агрегации, что делает этот процесс необратимым. Тромбоцитарная пробка является эффективным механизмом гемостаза в сосудах, диаметр которых не превышает 100 мкм. В сосудах большего диаметра дефект стенки нуждается в образовании фибринового тромба — конечного продукта деятельности вторичного гемостаза (звена ферментативной коагуляции). К скрининговым методам оценки состояния сосудисто-тромбоцитарного гемостаза относятся: 1) подсчет количества тромбоцитов в периферической крови; 2) определение времени (длительности) кровотечения (норма по Айви — 4–8 мин). Лекарственные препараты, воздействующие на сосудисто-тромбоцитарный гемостаз, можно разделить на две группы: А. Препараты, восстанавливающие сосудисто-тромбоцитарный гемостаз: 1. Концентрат тромбоцитов (КТ). Доза трансфузии КТ: в повседневной практике рекомендуют использовать простое правило — переливание 1 КТ на 10 кг массы тела. Эффективность трансфузий КТ оценивается по клиническим признакам прекращения или уменьшения кровоточивости, увеличению числа циркулирующих тромбоцитов через 1 ч и через 18–24 ч после переливания. 2. Этамзилат натрия (дицинон). Препарат ингибирует эффекты простациклина, в связи с чем усиливается агрегация тромбоцитов. Стимулирует ферментные реакции тромбоцитов, их новообразование из мегакариоцитов и выход из депо, усиливает реакцию освобождения тромбоцитов. Умеренно ускоряет образование тканевого тромбопластина. 3. Препараты кальция (кальция хлорид, кальция глюконат). Кальций участвует в агрегации и адгезии тромбоцитов, активирует тромбин и фибрин и таким образом стимулирует образование тромбоцитарных и фибриновых тромбов. Показания к применению — переливание больших количеств цитратной крови и тромбоцитопения. 4. Препараты, стабилизирующие сосудистую проницаемость (добезилат кальция (доксиум), продектин (пармидин), адроксон, эндотелон (процианидоловые олигомеры). Б. Лекарственные препараты, блокирующие агрегацию тромбоцитов: 1. Аспирин (ацетилсалициловая кислота). Вызывает необратимую инактивацию циклооксигеназы тромбоцитов. 2. Индометацин. Вызывает обратимую инактивацию циклооксигеназы тромбоцитов. 3. Дипиридамол (курантил). Ингибирует фосфодиэстеразу, препятствуя захвату аденозина, образовавшегося из своих предшественников в эритроцитах при микротравмах сосудов. 4. Производные ксантина (пентоксифиллин, кофеин, теофиллин). Повышают уровень внутриклеточных циклических нуклеотидов. 5. Реополиглюкин. Уменьшает агрегацию форменных элементов крови и улучшает реологические свойства крови. 6. Тиклид (тиклопидина гидрохлорид). Является мощным ингибитором агрегации тромбоцитов, вызванной АДФ. В отличие от аспирина, который тормозит только вторую фазу АДФ-индуцированной агрегации, тиклид ингибирует обе фазы. 7. Плавикс (клопидогрель). Селективно подавляет связывание АДФ с его рецептором на тромбоците и активацию комплекса GPIIb/ІІІa, ингибируя таким образом не только АДФ-индуцированную агрегацию тромбоцитов, но и частично агрегацию, обусловленную коллагеном. 8. Эпопростенол (простациклин). Применяется при необходимости замещения гепарина у некоторых пациентов при гемодиализе. II. Вторичный гемостаз, или ферментативная коагуляция, — процесс свертывания крови, который, согласно современным представлениям, протекает в три стадии: 1) формирование активной протромбиназы; 2) образование тромбиновой активности; 3) превращение фибриногена в фибрин: а) процесс полимеризации фибрина; б) стабилизация фибрина и ретракция сгустка. Это деление также условно, поскольку нельзя точно разграничить фазы и указать, в какой период заканчивается одна и наступает другая. Первая стадия ферментативной коагуляции наиболее сложная и продолжительная. Формирование протромбиназной активности является результатом многоступенчатого ферментативного процесса. Активация «каскада» свертывания проходит по 2 путям: внешнему и внутреннему. Ранее эти пути активации считались независимыми друг от друга. Их названия обусловлены характером активирующей поверхности. Для внешнего пути активатором является тканевой фактор (TF), расположенный в субэндотелиальных структурах, то есть вне циркуляции крови. Экспрессировать TF на своей поверхности могут гладкомышечные клетки, макрофаги, фибробласты и ряд других клеток. Возможность экспрессии TF на поверхности тромбоцитов и эндотелия дискутируется, хотя доминирует предположение об отсутствии TF на этих клетках. Для внутреннего пути активирующей поверхностью являются тромбоциты, контактирующие с поврежденной поверхностью эндотелия. Тромбоциты являются составной частью циркулирующей крови, то есть активирующая поверхность находится как бы внутри. Внешний путь начинается с активации тканевым фактором VII фактора. В комплексе с ионами Са2+ VIIа и TF активируют фактор Х. Внутренний путь образования фактора Ха протекает через цепь последовательных реакций активации факторов ХII — XI — IX — VIII. Процесс активации ХII фактора усиливается калликреином, а высокомолекулярный кининоген (ВМК) способствует образованию фактора XIа. От момента образования Ха-фактора процесс свертывания крови протекает по общему пути. Установлена взаимосвязь между внутренним и внешним путями ферментативной коагуляции, которая прослеживается в современной модели свертывающей системы, предложенной M. Hoffman и соавт. в 2001 г.. Ранее было известно, что и при внешнем, и при внутреннем механизмах свертывания взаимодействие и активация факторов осуществляется на фосфолипидных мембранах различных клеток, играющих роль матрицы. В настоящее время установлено, что активирующие поверхности (тромбоциты и клетки, несущие TF), несмотря на сходство мембранных структур, экспрессируют на своей поверхности рецепторы для различных компонентов свертывающей системы. Факт аффинности рецепторов для различных коагуляционных факторов на поверхностях субэндотелиальных клеток и тромбоцитов позволил по-новому увидеть последовательность их включения в процесс формирования фибринового сгустка. Современная модель свертывающей системы включает три фазы: 1-я фаза — инициация (initiation) процесса свертывания крови, которая развивается за счет образования комплекса TF + VIIа на поверхности субэндотелия в месте повреждения сосудистой стенки и приводит к образованию незначительного количества стартового тромбина; 2-я фаза — усиление (amplification) процесса свертывания крови за счет активации тромбоцитов и целого ряда коагуляционных факторов тромбином, который образуется под влиянием комплекса TF + VIIа; 3-я фаза — распространение (propagation) процесса свертывания крови с формированием теназного (факторы IХa + VIIIа на поверхности тромбоцитов) и протромбиназного (факторы Vа + Ха + Са2+ + фактор III тромбоцитов) комплексов на поверхности активированных тромбоцитов. В результате образуется значительное количество тромбина, способного сформировать сгусток фибрина. Тромбин расщепляет фибриноген и активирует фактор ХIII (фибринстабилизирующий), в результате чего образуется нерастворимый фибрин, необходимый для гемостатически эффективного сгустка. В настоящее время для остановки кровотечений у больных как гемофилией, так и другими геморрагическими диатезами широко используются препараты, обеспечивающие прямую активацию фактора X на тромбоцитарной поверхности. К таким препаратам относится препарат новосевен — рекомбинантный фактор VIIa. До конца гемостатический механизм действия этого препарата не ясен. Однако было показано, что высокий уровень фактора VIIa в крови после болюсной инъекции новосевена в концентрации не менее 50 нМ (2,5 мкг/мл) обеспечивает связь VIIa с наибольшим количеством рецепторов TF. Ограничение образования тромбина на поверхности субэндотелиальных клеток, несущих TF, контролируется в основном двумя веществами: 1) специфическим ингибитором пути тканевого фактора; 2) антитромбином III. Оценка состояния ферментативного звена коагуляции заключается в определении: 1) активированного частичного (парциального) тромбопластинового времени (АЧТВ); 2) протромбинового времени (ПВ); 3) тромбинового времени (ТВ); 4) концентрации фибриногена в плазме (рис. 1).
При наличии отклонений в скрининговых тестах дополнительно определяют маркеры активации первичного (фактор фон Виллебранда) и вторичного (циркуляция в крови повышенных количеств растворимых фибрин-мономерных комплексов) гемостаза. Свидетельством активации фибринолитической системы является появление в крови D-димеров. Лекарственные препараты, воздействующие на вторичный гемостаз, также можно разделить на две группы: А. Препараты, восстанавливающие вторичный гемостаз: 1. Свежезамороженная плазма. 2. Криопреципитат. Применяют обычно 1–2 дозы препарата. Вводят внутривенно капельно. 3. Витамин К. В клинической практике используют два производных метилнафтохинонов: витамин К3 — фитоменадион и викасол. Викасол (менадион) — синтетический аналог витамина К1. Применяют внутривенно или внутримышечно 1% раствор (1 мл). 4. Кальция хлорид. Применяют 10% раствор (10 мл) внутривенно медленно. Ионы кальция необходимы для нормального свертывания крови, способствуют превращению протромбина в тромбин, уменьшают проницаемость сосудов. Назначают также как кровоостанавливающее средство при кровотечениях для повышения свертываемости крови. Б. Лекарственные препараты, блокирующие преимущественно вторичный гемостаз: 1. Дезагреганты. 2. Прямые антикоагулянты (фракционированные и нефракционированные гепарины). 3. Рекомбинантные антикоагулянты (активированный протеин С, антитромбин III). 4. Гепариноиды. 5. Активаторы фибринолитической системы. 6. Непрямые антикоагулянты. Антикоагулянтная система. Активация свертывания крови неизбежно вызывает последующую активацию противосвертывающих механизмов. Биологическая роль антикоагулянтной системы в поддержании гомеостаза очень велика, поскольку она участвует в регуляции системы свертывания крови, сохранении жидкого состояния крови в циркуляции и препятствует переходу локального тромбообразования в чрезмерно распространенное или диффузное свертывание. Все образующиеся в организме антикоагулянты подразделяют на две группы: 1. Первичные (предсуществующие) — самостоятельно синтезируемые в организме антикоагулянты. 2. Вторичные — образующиеся в процессе свертывания крови, фибринолиза и активации других протеолитических систем. К первичным антикоагулянтам относят прежде всего гепарин — мукополисахарид, который образуется во всех органах и тканях. Больше всего гепарина синтезируется в легких и печени. Гепарин является непрямым ингибитором тромбина, так как для осуществления антикоагулянтного действия ему необходим кофактор — антитромбин ІІІ, который инактивирует тромбин (фактор Па) и другие факторы свертывания крови (XIa, Xa, IXa). Гепарин образует с антитромбином III комплекс, противосвертывающая способность которого возрастает почти в 1000 раз [3]. Поэтому гепарин является золотым стандартом для других антикоагулянтов. Таким образом, антитромбин III (кофактор гепарина) самостоятельно и в комплексе с гепарином инактивирует все три фазы ферментативной коагуляции. Наиболее частым клиническим проявлением дефицита антитромбина III является развитие тромбоза глубоких вен и, как следствие этого, тромбоэмболии. Частота выявления дефицита АТ III у больных с венозными тромбозами составляет около 3 %. Вероятность развития у больных тромботических осложнений, обусловленных дефицитом АТ III, увеличивается с возрастом. Кроме АТ III и гепарина, к физиологическим антикоагулянтам относятся: протеины С и S, APC, которые инактивируют факторы свертывания Va и VIIIa; тромбомодулин, который связывает и инактивирует тромбин, приводя к активации протеина С; ингибитор внешнего пути свертывания — TFPI, который является ингибитором комплекса «ТF + фактор VIIa + фактор Xа + Са++». Антиподом свертывающей системы крови является фибринолитическая система, которая осуществляет асептическое растворение фибрина (фибринолиз). Фибринолиз препятствует распространению тромба по сосудистой системе от места его образования, обеспечивает лизис фибрина при его появлении в общей циркуляции и тем самым поддерживает нормальное кровообращение. Главным компонентом этой системы является фермент — плазмин (фибринолизин), содержащийся в плазме в виде профермента (плазминогена). Плазминоген (профибринолизин) содержится в эуглобулиновой фракции плазмы и сыворотки. Ферментом, непосредственно расщепляющим фибрин, является плазмин, который образуется из неактивного предшественника плазминогена. Фибринолитическая система, как и свертывающая, имеет два механизма активации — внутренний, осуществляемый ферментными системами самой крови, и внешний, осуществляемый тканевыми активаторами. Внутренняя активация фибринолиза обусловлена образованием комплекса Ха с калликреином и высокомолекулярным кининогеном в ответ на свертывание крови. Благодаря действию внутреннего фибринолитического механизма, образующийся из фибриногена фибрин постоянно удаляется из кровотока. Внешняя активация фибринолиза обусловлена поступлением в кровоток тканевых киназ, в основном из сосудистого эндотелия. Активаторы фибринолиза содержатся во многих тканях и жидкостях, также его мощные активаторы содержатся в клетках крови. Физиологическое значение фибринолиза велико, поскольку он не только устраняет из кровотока фибрин, но и образует высокоактивные антикоагулянты и дезагреганты — продукты деградации фибрина (ПДФ). Лекарственные препараты, воздействующие на фибринолитическую систему, можно разделить на две группы: А. Препараты, активирующие фибринолитическую активность: 1. Стрептокиназа, или стрептаза К, — продукт жизнедеятельности бета-гемолитического стрептококка, обладает антигенными свойствами, поэтому лечение проводится на фоне применения кортикостероидов. Стрептокиназа — непрямой фибринолитик. 2. Стрептодеказа — пролонгированный препарат стрептокиназы. Однократное введение средней терапевтической дозы препарата обеспечивает повышение фибринолитической активности крови в течение 48–72 ч. Для предупреждения ретромбоза стрептодеказу комбинируют с гепарином, который начинают вводить с конца 1-х суток после введения лечебной дозы фибринолитика. 3. Урокиназа (укидан) — лишена антигенных свойств. Аллергические реакции наблюдаются редко, в связи с чем возможно повторное введение препарата. Препарат получают из культуры клеток почек человека, а также рекомбинантным путем. Урокиназа — прямой активатор фибринолиза: непосредственно активирует плазминоген и превращает его в плазмин. Препарат активирует фибринолиз как внутри тромба, так и на его поверхности. 4. Рекомбинантный тканевой активатор плазминогена (актилизе) — гликопротеин (полный аналог эндогенного вещества, вырабатываемого эндотелием), который после системного введения находится в плазме в неактивной форме до момента связывания с фибрином. После активации препарата он способствует переходу плазминогена в плазмин и растворению фибринового сгустка, таким образом повышая фибринолиз преимущественно в ткани тромба. Б. Препараты, угнетающие фибринолиз: 1. Антифибринолитики животного происхождения. Действующим началом этих препаратов является апротинин. Ингибиторы протеаз природного происхождения (трасилол, контрикал, гордокс и др.) получают либо из поджелудочной и околоушной желез, либо из легких крупного рогатого скота. 2. Синтетические антифибринолитики (эпсилон-аминокапроновая кислота — АКК, парааминометилбензойная кислота, транексамовая кислота и др.). АКК вводится внутривенно капельно в виде 4–5 % раствора в дозе 100–400 мл. Препарат можно применять перорально. Действие АКК заключается в ингибировании перехода плазминогена в плазмин. Препарат повышает коагуляционную способность крови, активность фактора VIII, увеличивает потребление протромбина, агрегационную способность тромбоцитов. 3. Транексамовая кислота (экзацил, Transamcha). Препарат ингибирует действие активатора плазминогена и плазмина, обладает гемостатическим действием при кровотечениях, связанных с повышением фибринолиза, а также противоаллергическим и противовоспалительным эффектом за счет подавления образования кининов и других активных пептидов, участвующих в аллергических и воспалительных реакциях. Показанием к применению препарата являются кровотечения на фоне усиления фибринолиза (послеродовые кровотечения, ручное отделение последа, заболевания печени, маточные, носовые, желудочно-кишечные кровотечения, гематурия и т.д.). При генерализованном фибринолизе его вводят внутривенно в разовой дозе 15 мг/кг массы тела в изотоническом растворе натрия хлорида или глюкозы. Скорость введения — 1 мл/мин. При профузном маточном кровотечении препарат назначают внутрь по 1–1,5 г 3–4 раза в день в течение 3–4 сут. При носовом кровотечении раствор для инъекций применяют местно путем закапывания или тампонирования носовых ходов марлей, смоченной раствором. В практике врача-интенсивиста наиболее частой причиной нарушений в системе гемостаза, требующей коррекции, являются тромбозы и эмболии. Тромбоз глубоких вен (ТГВ) и связанные с ним осложнения (в первую очередь тромбоэмболия легочной артерии — ТЭЛА) относятся к наиболее распространенным и представляющим опасность для жизни пациентов заболеваниям системы кровообращения. Ежегодно ТГВ и ТЭЛА диагностируют у 100–160 человек на 100 000 населения. Около 30 % из них погибают в ближайший месяц, еще у 20 % больных в течение последующих 2 лет развивается рецидив заболевания. Современная стратегия профилактики ТГВ предполагает комплексное воздействие на основные элементы системы регуляции агрегатного состояния крови — эндотелий сосудистой стенки, тромбоциты и плазменные факторы свертывания крови. Среди патологических состояний, сопровождающихся нарушением тромборезистентных свойств сосудистой стенки, следует выделить эндогенную интоксикацию, вызывающую усиление синтеза и увеличение количества тромбопластина на поверхности эндотелиоцитов, т.е. активацию ключевого механизма тромбогенеза и, соответственно, неконтролируемого патологического свертывания крови. Вероятность такого развития событий наиболее высока у больных с тяжелыми формами хирургической инфекции, при которых, по нашим данным, риск тромбоэмболии легочной артерии непосредственно зависит от степени эндогенной интоксикации, достигая 18 % у больных с «разлитым» перитонитом. Так как у хирургических больных степень воспалительной реакции непосредственно связана с травматичностью, объемом механического повреждения (оперативного вмешательства, травмы) и наличием инфекционных осложнений, очевидно, что применение менее инвазивных доступов, анатомичность оперирования, тщательный гемостаз и своевременная санация гнойных очагов имеют большее значение для профилактики послеоперационных тромбоэмболических осложнений, чем специфическая терапия. Не менее значимым условием для процессов венозного тромбообразования является развитие периферической венозной гипертензии и венодилатации с закономерным снижением объемной скорости кровотока в мышечно-венозных синусах. Вероятность таких нарушений наиболее высока при выполнении ортопедических операций и оперативных вмешательств на органах малого таза. Возникновение венозного стаза на фоне интра- и послеоперационной гиперкоагуляции (вследствие операционной травмы и появления большого количества активированного тромбопластина) является основным пусковым механизмом развития тромбоза. Венозный застой предупреждают ранняя активизация пациентов в послеоперационном периоде, лечебная физкультура; профилактическая компрессия нижних конечностей (бинтование эластичным бинтом от основания пальцев до верхней трети голени); применение лечебного и профилактического трикотажа; прерывистая пневматическая компрессия. В настоящее время имеется целый ряд низкомолекулярных гепаринов (НМГ): дальтепарин, надропарин, эноксапарин, бемипарин и др. с молекулярной массой (ММ) 4000–6500 дальтон, которые получают при помощи химической или ферментативной деполимеризации обычного гепарина. При назначении больным НМГ необходимо учитывать рекомендации, основанные на материалах рандомизированных многоцентровых исследований. Наиболее изученным в мире низкомолекулярным гепарином является эноксапарин (клексан производства Sanofi-Aventis).
|
||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 1316; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.113 (0.014 с.) |