
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Вплив на сперміїв факторів довкілляСодержание книги
Поиск на нашем сайте
Застосовувана для штучного осіменіння сперма, перш ніж потрапити у статеві шляхи самки, витримується (зберігається) деякий час в умовах довкілля. Тут на сперміїв можуть діяти різні фактори, які здатні сповільнювати або ж навіть порушувати процеси обміну речовин і як наслідок - живучість сперміїв, а отже і запліднююча здатність може чи то зберігатися, чи погіршуватися, чи, нарешті, втрачатися. Тому потрібно знати вимоги сперміїв до умов зовнішнього середовища. Спермії мають напівпроникну оболонку і можуть існувати лише у порівняно вузькому діапазоні концентрацій осмотично активних речовин у навколишньому середовищі. Сперма різних тварин відрізняється між собою за вмістом у ній солей (електролітів) та органічних сполук (неелектролітів). Виживання сперміїв у значній мірі залежить від співвідношення у спермі електролітів та неелектролітів. У чистих розчинах солей чи цукрів воно звичайно гірше, ніж у їх сумішках. Наявні у плазмі сперми солі розпадаються на позитивно заряджені іони металів (катіони) та від'ємно заряджені кислотні лишки (аніони). Одновалентні катіони (калію, натрію) не проявляють негативного впливу на спермії, а дво- і тривалентні каті- они (кальцію, магнію) знімають електричний заряд і викликають аглютинацію сперміїв. Аніони слабо дисоційованих кислот зміцнюють оболонку сперміїв, тоді як аніон хлору руйнує її і вкорочує виживання сперміїв. Високе виживання сперміїв у придатку сім'яника у значній мірі зв'язане з низьким вмістом тут електролітів. Збільшення їх вмісту у спермі під час еякуляції супроводжується зниженням живучості сперміїв. Чим сильніше сперма розріджена секретами додаткових залоз, тобто, чим вищий у ній вміст електролітів, тим швидше спермії гинуть. Розчинені у плазмі сперми органічні речовини та солі проявляють на спермії певний осмотичний тиск. При цьому неорганічні речовини, що звичайно розпадаються на йони, проявляють більший тиск, ніж органічні, які перебувають у розчині у вигляді цільних молекул. Величину осмотичного тиску звичайно виражають терміном "депресія", тобто рівнем зниження точки замерзання розчину у порівнянні з дистильованою водою, в градусах, паскалях (Па) чи атмосферах. У бугая, наприклад, вона складає 0,591° (4,812-9,42 атм. чи 0,94 кПа), барана - 0,644° (5,05-11,0 атм чи 1,02 кПа), кнура - 0,617° (6,17-9,20 атм. чи 0,93 кПа), жеребця - 0,56° (3,75-8,59 атм. чи 0,93 кПа). При зберіганні сперми поза організмом внаслідок накопичення продуктів обміну речовин змінюється її осмотичний тиск, що позначається на живучості сперміїв. Найкраще вони виживають у середовищах, осмотичний тиск яких на оболонку спермія зрівноважується з тиском розчинених у них речовин. Такі розчини називають ізотонічними. Якщо спермії помістити у середовище з нижчим осмотичним тиском, тобто гіпотонічне, або звичайну воду, то вони швидко набухають і гинуть внаслідок високого внутрішньоклітинного тиску; при цьому їх хвостики закручуються кільцеподібно. У гіпертонічному розчині спермії зморщуються від обезводнювання, їх хвостики вигинаються кривульчасто і вони гинуть. Особливо згубними для сперміїв є різкі зміни осмотичного тиску. Тому при виготовлені середовищ необхідно враховувати їх осмотичний тиск. Згідно правила Вант-Гоффа і Рауля при розчинені однієї граммоле- кули неелектроліту у 1 л дистильованої води її осмотичний тиск зростає до 22,4 атм. чи 2,98 кПа. При цьому точка депресії розчину знижується до -1,86 °С. Оскільки точка депресії сперми бугая у три рази нижча, то для виготовлення ізотонічного розчину неелектроліту, наприклад глюкози, необхідно розчинити 1/3 її граммолекули у 1 л дистильованої води, тобто 60 г. При виготовлені розчинів електролітів враховують те, що їх молекули не стійкі і осмотичний тиск розчину зростає у стільки разів, на скільки йонів розпадається молекула. Тому для виготовлення ізотонічного розчину хлористого натрію (№С1), що дисоціює на два йони (№+ та СІ), потрібно брати не 1/3 граммолекули, тобто не 20 г, а у два рази менше - 1/6 (10 г). Так само для виготовлення ізотонічного розчину сірчанокислого натрію (№^04), що дисоціює на три йони, потрібно брати 1/9 граммолекули на 1 л води. На підставі проведених розрахунків та кріоскопічної перевірки встановлено, що ізотонічними розчинами глюкози для сперми барана є 6,4 %-ний, бугая та кнура - 6, жеребця - 7,2, кроля - 5,4, пса - 8 %-й. Ізотонічними для сперми ссавців є також 1 %-й розчин хлористого натрію, 2,8 %-й розчин цитрату натрію, для сперми кнура - 3,7 %-й розчин желатину. При проведенні штучного осіменіння слід користуватися лише ізотонічними розчинами, уникати попадання у сперму води, оберігати її від підсихання. Реакція середовища. Як відомо, наявні у спермі ферментні системи вимагають для своєї активності відповідної реакції. У кислому середовищі їх активність, а отже, і рухливість сперміїв гальмується, а в лужному, навпаки, активується. Для визначення ступеню кислотності користуються показником рН. Це від'ємний десятинний логарифм кількості водневих йонів в 1л сперми, тобто рН-LgН. Він може бути виражений цифрами від 0 до 14. Підвищення чи зниження рН на одиницю означає зменшення чи збільшення кислотності у 10 разів, на 3 - у 100 разів; свіжоодержа- на сперма бугая має рН біля 6,5-6,7, барана - 7,08, жеребця - 7,23, кнура - 7,57. При зберіганні сперми реакція її поступово змінюється у бугая і барана - у кислий, кнура та жеребця - у лужний бік. У кислому середовищі рухливість сперміїв гальмується, а в лужному активується. Проте живучість сперміїв залежить не лише від величини рН, а й від того, якою кислотою обумовлені його зміни, здатністю цієї кислоти проникати всередину спермія. Оболонка живих сперміїв, що майже непроникна для вільних йонів водню, легко пропускає недисоційовані молекули слабких кислот. Проникнувши у клітину, молекули цих кислот розпадаються на іони і підкислюють внутрішньоклітинне середовище. Органічні кислоти (молочна, оцтова, янтарна, масляна та ін.) у розчинах не піддаються дисоціації, а проникають крізь ліпопротеїдну оболонку спермія і лише тоді розкладаються на іони, підкислюючи внутрішньоклітинне середовище і гальмуючи обмін речовин. Тому навіть у малій концентрації вони гальмують рухливість сперміїв. Неорганічні кислоти (соляна, сірчана, фосфорна та ін.) у розчинах повністю дисоціюють на вільні йони, які не проникають крізь оболонку спермія, тому навіть у значних концентраціях (при рН 4,1) вони не позначаються на їх рухливості, тоді як слабкі органічні кислоти (наприклад молочна) знижують їх рух уже при рН 6,0 (В. К. Ми- лованов). Буферність сперми. Різкі коливання концентрації водневих йонів несприятливо позначаються на виживанні сперміїв, проте у процесі філогенезу в організмі виробилися специфічні пристосування у вигляді буферних систем, які пом'якшують ці коливання кислотності чи лужності. Так, у плазмі сперми ссавців є значні концентрації слабо дисоційованих кислот (лимонної, фосфорної, вугільної), які, віддаючи свій метал сильно дисоційованій кислоті, перетворюють її на сіль і нейтралізують кислотність. Вивільнювані ж при цьому слабкі кислоти дають набагато менше водневих йонів, ніж сильні. Крім того, при наявності значної кількості лугу, вони здатні віддавати водень, нейтралізуючи цим гідроксильні йони (ОН). Тому солі слабких кислот є буферами сперми. Буферними властивостями володіють також білки сперми, оскільки вони здатні зв'язувати кислоти та лужні речовини. При розрідженні сперми концентрація наявних у ній солей зменшується, у зв'язку з чим знижується буферність середовища. Зміни рН сперми бугая та барана у межах 6,5-7 нешкідливі для сперміїв, тоді як вихід за ці межі негативно позначається на їх життєвості. Для підтримання рН у межах 6,5-7 до сперми додають буферні розчини солей слабких кислот - цитратів чи фосфатів. Вплив температури. Виживання сперміїв у зовнішньому середовищі у значній мірі залежить від температури зберігання сперми. Як уже повідомлялося, формування і дозрівання сперміїв відбувається при температурі, що на 3-4° нижча температури тіла. У придатку сім'яника вони можуть зберігатися у стані анабіозу біля двох місяців, а після змішування з секретами додаткових статевих залоз та активування життєвих процесів спермії гинуть при температурі тіла протягом декількох годин. Підігрівання сперміїв до 42 °С викликає швидку втрату ними рухливості та запліднюючої здатності, а при 48 °С вони гинуть внаслідок коагуляції білка. При зниженні температури рухливість сперміїв сповільнюється, біля 0 °С у них наступає стан анабіозу, при якому зупиняється рухливість, загальмовуються обмінні процеси, внаслідок чого збільшується виживання сперміїв. У стані глибокого анабіозу при температурі мінус 196 °С вони можуть зберігатися роками, поновлюючи свою рухливість та запліднюючу здатність після розморожування, якщо ж спермії раптово охолоджувати від 20 °С до 0° або навіть від 38° до 20 °С, то у них наступає "холодовий удар" (температурний шок), внаслідок якого гине більша частина чи навіть усі спермії. Механізм пошкоджуючої дії холодового шоку остаточно не з'ясований. Вважають, що під впливом холодового удару у сперміїв пошкоджується акрозома, цитоплазматичні мембрани, про що свідчить вихід електролітів та ферментів у навколишнє середовище. Акрозома втрачає свої специфічні фосфоліпіди. Ф. І. Осташко приписує важливу роль у механізмі шоку осмотичним та дифузним процесам. Щоб уникнути холодового удару слід суворо дотримуватися рекомендованого температурного режиму у приміщеннях, де працюють зі спермою; застосовувані інструменти, розчини, середовища повинні бути теплими; одержана сперма не повинна піддаватися різкому охолодженню. У середовища для розрідження сперми вводять жовток курячого яйця, ліпідні компоненти якого (ліпопротеїн, лецитин, фосфоліпіди) нашаровуються захисним шаром на поверхні сперміїв і захищають їх від температурного шоку. Вплив світла. У статевих органах самця та самки спермії ніколи не піддаються впливу світла, тому у них не виробилося будь-яких захисних пристосувань щодо нього. Хоча у далекому минулому спермії ссавців були пристосовані до виживання у водному середовищі та дії розсіяних сонячних променів. Ця риса у якійсь мірі збереглася у сперміїв ссавців - розсіяне світло не діє на них негативно. Що ж стосується прямих сонячних променів, то ультрафіолетова їх частина, активізуючи хімічні процеси, прискорює накопичення токсичних продуктів обміну речовин, а інфрачервоні промені проявляють негативний вплив через тепловий ефект. Шкідливим для сперміїв є також яскраве електричне світло. Тому слід оберігати сперму від прямих сонячних променів, працюючи з нею при неяскравому освітленні; бажано, щоб стекла у вікнах лабораторії, а також електричні лампочки були матовими. У крайньому випадку на вікнах чіпляють марлеві чи поліетиленові занавіски. При осіменінні тварин на відкритому повітрі флакони, ампули, пакети зі спермою, піпетки для осіменіння слід накривати марлевими серветками. Вплив хімічних речовин. У природних умовах спермії зустрічаються з обмеженою кількістю речовин, наявних в організмі у фізіологічних концентраціях. При штучному осіменінні змінюється кількість цих речовин та їх якість. Широко застосовують тут миючі, дезінфікуючі та лікарські речовини. Спермії дуже чутливі до дії різних хімічних речовин - лізолу, креоліну, формаліну, скипидару, марганцевокислого калію, нашатирного спирту, сулеми, ефіру, лугів, оцтової кислоти, окислів міді, заліза, срібла, нікотину та ін. Мінімальні їх кількості, навіть запах, шкідливі для сперміїв. Тому категорично заборонено зберігати ці речовини на племпідприємствах і пунктах штучного осіменіння або ж влаштовувати пункти поблизу ветеринарних установ. Всі інструменти, з якими стикаються спермії, повинні бути скляними, а металеві (наприклад піхвові дзеркала) повинні бути нікельованими. Миття та стерилізація посуду, інструментів і приладів слід проводити у ємностях з неокислюваних металів чи з антикорозійними покриттями (емалі, нікель і т. п.). Не дозволяється зберігати у лабораторії та поблизу неї сторонні речовини, особливо медикаменти та деззасоби. Токсичними для сперміїв є також окремі сорти гуми, в тому числі гумові камери, дистильована вода, поліетиленові прилади, а також вазелін, що застосовується для змащування штучних вагін. Тому для дезінфекції приміщень племпідприємств та пункту штучного осіменін- ня користуються лише такими засобами, які не мають запаху (їдкий нагрій, свіжо згашене вапно), а для стерилізації інструментів та матеріалів користуються кип'ятінням, автоклавуванням, сухим жаром і, як виняток, чистим спиртом - ректифікатом, пам'ятаючи, що навіть у 0,5 %-й концентрації він згубно діє на спермії. Вплив мікробного та грибкового забруднення. Одержана від плідників сперма дуже часто буває забруднена мікроорганізмами та грибами, які попадають сюди із сечівника та з довкілля. Суттєвим джерелом мікробного забруднення сперми кнурів є дивертикул препуція. Як довели І. Г. Мороз та М. М. Рязанський, дивертикулоектомія у кнурів знижує мікробне забруднення у них сперми, підвищує заплідненість та плодючість свиноматок. Ступінь мікробного забруднення сперми залежить від здоров'я плідника, його гігієнічного стану, чистоти штучної вагіни, манежу, лабораторії, терміну зберігання сперми та багатьох інших факторів. У 1 мл сперми бугаїв, що утримувалися у поганих гігієнічних умовах, П. Мари- нов виявляв до 230 млн мікроорганізмів, а в 1 см3 повітря приміщень пунктів штучного осіменіння - до 2,6 млн мікроорганізмів. У спермі виявляється як сапрофітна, непатогенна мікрофлора, так і патогенна, протозої та рікеції. Попадаючи у сперму мікроорганізми не лише конкурують зі сперміями за поживні речовини, діють на них несприятливо продуктами свого обміну, а й руйнують їх оболонки та перфораторій (Г. В. Звєрєва і Л. А. Чорномаз; Г. В. Звєрєва та В. А. Яблонський). Через штучне осі- меніння забрудненою спермою можуть передаватися такі захворювання, як трихомоноз, вібріоз, бруцельоз, лептоспіроз, ящур та ін. Осіменіння тварин інфікованою спермою може бути причиною ендометритів та різного виду ембріопатій. Для боротьби з мікрофлорою сперми застосовують різні антимікробні препарати, але, по-перше, видовий склад мікрофлори дуже багатий, а, по-друге, усі антимікробні засоби діють не лише на мікроорганізми, а й на спермії, тому застосовувати їх слід дуже обережно. Г. В. Звєрєва та А. М. Репко встановили, що у свіжій та збереженій спермі, поряд з бактеріями, зустрічається до 21 виду грибів, які володіють патогенними та токсичними властивостями. Такі патогенні гриби, як Candida albicans, Aspergillus fumigatus, Lichtheimia corymbifera сприяють виникненню ендометритів у корів, а при настанні вагітності викликають загибель ембріонів та плодів. Тому особливу увагу слід звертати на чистоту приміщень та стерильність застосовуваних інструментів та матеріалів. Дозволяється використовувати для осіменіння тварин сперму з вмістом у ній до 5 тис. мікробних тіл, вільну від патогенної мікрофлори та синьогнійної палички, а вміст інших мікробних тіл у ній не повинен перевищувати 5 тис. Колі-титр такої сперми бугая не повинен перевищувати 0,3. Оцінювання якості сперми Запліднюваність самок, що підлягають осіменінню, у значній мірі залежить від якості застосованої сперми. Тому одержану сперму використовують для осіменіння лише після попереднього її оцінювання. На підставі такого оцінювання сперми можна зробити висновок не лише про придатність її для осіменіння самок, а й про можливість використання плідника, від якого отримано цю сперму, для відтворення стада. З наявних методів оцінювання якості сперми у виробничих умовах найширше застосування знайшли: 1) візуальне оцінювання сперми за зовнішніми ознаками; 2) мікроскопічне оцінювання густини сперми та рухливості сперміїв; 3) визначення концентрації сперміїв. Інші методи (біохімічні, бактеріологічні і т. п.) використовуються у наукових дослідженнях або у випадку необхідності. Візуальне оцінювання сперми за зовнішніми ознаками (загальне, санітарне чи окомірне оцінювання). Одержану від плідника сперму, у першу чергу, оцінюють за кольором, запахом, консистенцією та об'ємом еякуляту. Колір сперми - характерний для кожного виду тварин і залежить, головним чином, від концентрації у ній сперміїв. Сперма барана - біла з жовтуватим відтінком; бугая - молокоподібна, інколи жовтувата; у жеребця та кнура - сірувато-біла, нагадує колір сильно розрідженого молока. Червонуватий або ж буро-червоний колір сперми Запах сперми. Нормальна сперма не має запаху, хоча у барана вона може мати запах жиропоту, у бугая - свіжо видоєного молока. При наявності запальних гнійних процесів у сім'яниках чи додаткових статевих залозах сперма може набувати гнильного запаху, а при попаданні у сперму сечі вона пахне аміаком. Консистенція сперми залежить від ступеня розрідження її секретами додаткових статевих залоз. Сперма барана, звичайно, густа, сметаноподібна; бугая - вершкопо- дібна; жеребця - водяниста, часто з домішками слизу; кнура - водяниста, з драглисто- клейкими зернами.
Поява у спермі пластівців свідчить про запальні процеси у додаткових статевих залозах, частіше всього - міхурцевих. Домішки калу, бруду і т. п. зустрічаються при антисанітарних умовах утримання плідників та недотриманні правил одержання сперми.
Об'єм еякуляту - кількість сперми, виділеної плідником за одну садку. Він залежить від ступеня розрідження густої маси сперміїв секретами додаткових статевих залоз. Для вимірювання об'єму еякуляту користуються чистими, сухими, теплими градуйованими циліндрами, мензурками, піпетками, колбами для змішування, градуйованими спермоприймачами. Об'єм еякуляту у кнура та жеребця вимірюють після фільтрації - для відокремлення густих секретів цибулинно-сечівникових залоз. Мікроскопічне оцінювання сперми за густиною та рухливістю сперміїв. Під густиною сперми розуміють насичення її статевими клітинами. Цей показник, як і Оцінювання сперми за густиною. Застосовується лише при дослідженні нерозрідженої сперми. При цьому розрізняють: густу, середню та рідку сперму (див. рис. 28). Густа сперма (позначають буквою Г) - все поле зору мікроскопа заповнене густою масою сперміїв і між ними майже не видно вільних проміжків; спермії рухаються суцільною масою, розрізнити рух окремих сперміїв неможливо. Середня сперма (С) - між сперміями добре помітні проміжки, у яких може поміститися по довжині один спермій, і рух окремих сперміїв добре розрізняється.
Рідка сперма (Р) - у полі зору мікроскопа спостерігаються окремі спермії, віддаль між якими перевищує довжину одного спермія. Відсутність у полі зору сперміїв називається аспермією. Таблиця 10
|
Для розрідження (розбавлення) можна використовувати сперму барана лише густу, а сперму бугая, жеребця та кнура - густу та середню. Визначення рухливості (активності) сперміїв.
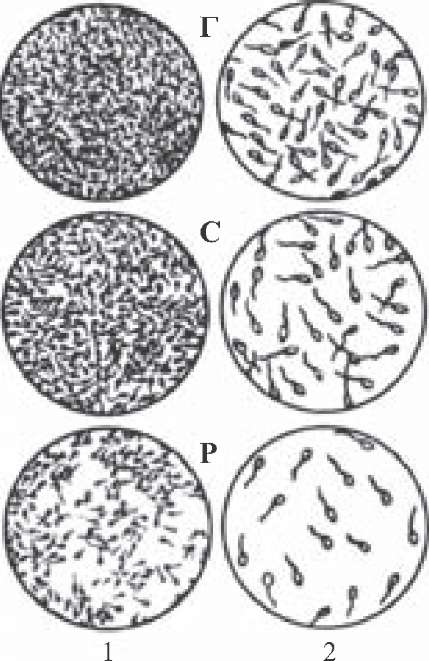 Рис. 28. Оцінювання густини сперми бугая (1) та кнура (2):
Г - густа сперма, С - середня, Р - рідка.
Рис. 28. Оцінювання густини сперми бугая (1) та кнура (2):
Г - густа сперма, С - середня, Р - рідка.
|
Під рухливістю сперміїв розуміють здатність їх до прямолінійного поступального руху. Чим менше у спермі таких сперміїв, тим менше шансів на запліднення.
Оцінювання рухливості сперміїв проводять у роздавленій краплі одночасно з визначенням густини сперми. При цьому визначають "на око" лише процент сперміїв з прямолінійно-поступальним рухом. Оцінювання проводять за десятибальною системою: за кожних 10 % сперміїв з прямолінійно-поступальним рухом ставлять один бал; найвищий бал - 10.
У свіжоотриманій густій спермі барана та бугая важко встановити процентне співвідношення сперміїв з різними видами руху. У подібних випадках керуються такими критеріями: при наявності у спермі активного вихрового руху сперміїв ставлять найвищу оцінку - 10; при дещо сповільненому вихровому русі ставлять бал 9 або 8 і т. д.
Слід мати на увазі, що у окремих еякулятах, особливо густих, спермії не встигають вийти повністю зі стану анабіозу. У таких випадках на предметному склі зміщують дві краплі манежним рухом і мертві)._________
теплого 2,9 %-го розчину цитрату натрію чи
0,9 %-го розчину натрію хлориду з краплею сперми, накривають накривним скельцем і розглядають під мікроскопом.
Заморожену сперму оцінюють після розморожування.
Рухливість сперміїв у спермі, розфасованій у відкритих гранулах, визначають після розморожування її у 2,9 %-му розчині натрію цитрату і, не проводячи додаткового розрідження, при оцінюванні сперми, замороженої в облицьованих гранулах, оболонка яких зроблена з оптично прозорого полімерного матеріалу. Протирають гранулу стерильною серветкою, затискають її за допомогою спеціального зажиму між двома предметними стеклами, кладуть на столик мікроскопа і досліджують.
Сперму, розфасовану у пайетах (соломинках), оцінюють за рухливістю вибірково, змішавши на предметному склі краплю сперми з краплею 2,9 %-го натрію цитрату і визначивши рухливість сперміїв.
Визначення концентрації сперміїв. Концентрацію сперміїв визначають у кожному еякуляті з тим, щоб знати у скільки разів можна її розріджувати. Для цього існує декілька методів, основними серед яких є підрахунок кількості сперміїв у лічильній камері.
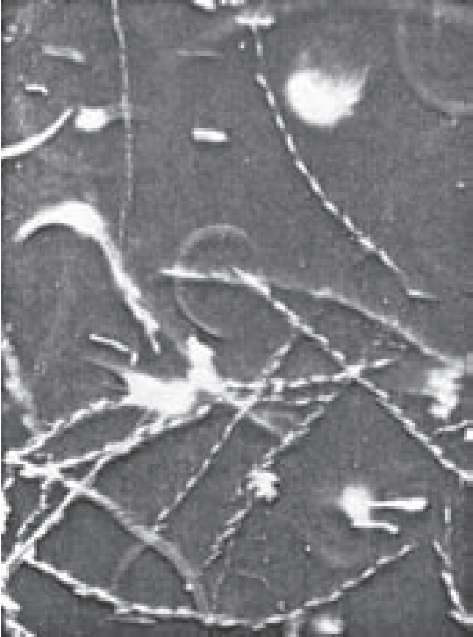 Рис. 29. Фотограма рухливості сперміїв (видно спермії з поступальним,
Рис. 29. Фотограма рухливості сперміїв (видно спермії з поступальним,
|
При визначенні концентрації сперміїв в лічильній камері Горяєва, для зручності підрахунку, сперму слід розбавити і позбавити спермії рухливості. З цією метою її розріджують у змішувачі (меланжері) 3 %-ним розчином хлористого натрію (сперму бугая - у 100 разів, барана - 200, кнура та жеребця - у 20 разів), вносять її під накрив-
Рис. 30. Патологічні форми сперміїв бугая (за Бретшнейдером):
А - ковпачок голівки: 1 - нормальний, 2 - широкий, 3 - гранульований, 4 - косий, 5 - маленький, 6 - не- прикріплений, 7 - виродковий; Б - форма і величина голівки: 1-3 - нормальна, 4 - вузька, 5 - грушоподібна, 6 - ланцетоподібна, 7 - лопатоподібна, 8 - колбоподіб- на; В - основа голівки і шийка: 1 - нормальна, 2-3 - звужена, 4 - вузька, 5 - широка, 6 - симетрична, 7 - несиметрична, 8 - з надламом, 9 - з перегином, 10 - з розломом, 11 - відсутність голівки; Г - тіло: 1 - нормальне, 2 - коротке, 3 - широке, 4 - тонке, 5 - виродкове, 6 - розриви, 7 - перегини, 8 - осьовий тип, 9 - розщеплене; Д - хвостик: 1 - крапелька на шийці, 2 - на тілі, 3 - на хвостику, 4 - при згинах хвостика, 5 - петлеподіб- ний, 6 - у формі завитка, 7 - хвостик навколо голівки, 8 - рудиментарний; Е - виродкові спермії: 1 - одноголовий двохвостий, 2 - одноголовий трихвостий, 3 - одноголовий чотирихвостий, 4 - двоголовий двохвостий, 5 - двоголовий чотирихвостий.
не скельце камери, поміщають на предметний столик мікроскопа і при малому збільшенні у затемненому полі підраховують кількість сперміїв у п'яти великих (80 малих) квадратах, розміщених по діагоналі. Підраховують концентрацію за формулою (див. В. А. Яблонський "Практичне акушерство...", 2002).
Значно точнішим і набагато швидшим є визначення концентрації сперміїв за допомогою електрофотоколориметра (що базується на врахуванні оптичної щільності сперми) чи швидкісного автоматичного лічильника клітин - цело скопу.
Визначення процента живих і мертвих сперміїв. Якщо змішати сперму з тим чи іншим мікробіологічним барвником, то наявні у ній мертві спермії зафарбуються у колір барвника, а живі залишаться блідими, оскільки їх оболонка непроникна для цих барвників. Цю властивість фарб використано для визначення процента живих і мертвих сперміїв. У арсеналі дослідників є цілий ряд методів такого диференціювального фарбування сперміїв. Найчастіше користуються 5 %-им водним розчином еозину за В. А. Морозовим чи еозин-нігрозиновою фарбою за В. А. Яблонським (еозин - 5 г, нігрозин - 3 г, дистильована вода - 100 мл).
На сухе знежирене предметне скло наносять (ближче до одного краю) краплю сперми і поряд краплю фарби. Швидко змішують їх краєм шліфованого предметного скла і, дещо відступивши від краплі, роблять тонкий мазок. Мазок повинен бути настільки тонким, щоб міг швидко висохнути на повітрі, у противному випадку живі спермії можуть загинути раніше, ніж висохне мазок.
| а 9 9 § 0 9 В^Е? 1 2 3 4 5 6 7 Б0РЄ09Й09 1 2 3 4 5 6 7 8 В ОД V V £ «19 1 6 7 8 9 10 11 г ттшп 12345 6 7 8 9 1 2 3 4 5 6 7 8 Е 1 2 3 4 5 |
Після висихання мазка його розглядають під мікроскопом при збільшенні у 400600 разів і підраховують окремо кількість живих (незафарбованих) і мертвих спер
міїв (із зафарбованими та напівзафарбованими голівками) та визначають процент мертвих сперміїв.
Визначення процента патологічних форм сперміїв. У спермі плідників завжди є певна кількість ненормальних, патологічних форм сперміїв та різних включень, особливо при порушенні режиму використання плідників і, безумовно, при виникненні тих чи інших хворобливих процесів, у першу чергу у статевій системі. Тому всі плідники племпідприємства не рідше одного разу на місяць, повинні піддаватися відповідному дослідженню. Кількість патологічних форм сперміїв у їх еякуляті не повинна перевищувати наведених у таблиці 11 показників.
Найчастіше трапляються аномалії хвостової частини спермія, основи його голівки та шийки (див. рис. 30). Наприклад, двоголові, двохвостові, карликові, гігантські, спермії з грушоподібною, колоподібною голівкою і т. п. Л. А. Чорномаз виявляв сперміїв із слабо вираженим перфораторієм, а то й без нього.
Блом запропонував ділити спермії за їх морфологією на три види: нормальні, з первинними патологічними змінами та з вторинними змінами. До первинних змін він відніс зміни величини та форми голівки, тіла і хвостика та їх забарвлення. Це - гігантські спермії, карликові, з круглою, грушоподібною або зрізаною голівкою, безголові, двоголові, двохвості і т. п. Такі зміни сперміїв виникають при розладах сперміогенезу у сім'яниках (запальних процесах у них), а також при авітамінозах, порушеннях тер- морегулюючої функції калитки.
До вторинних змін він відніс сперміїв з закрученими та обламаними хвостиками, з відокремленими ковпачками, безхвостих, з проксимальною протоплазматичною краплею. Подібні зміни виникають при розладах процесу дозрівання сперміїв у придатку сім'яника, ураженнях придатків сім'яників та сперміовивідних шляхів, патології додаткових статевих залоз, при порушенні режиму використання плідників (що буває часто), а також способу отримання сперми і послідуючого поводження з нею.
До конкретних причин появи патологічних форм сперміїв відносять також недостатній розвиток сім'яників, ураження їх патологічними процесами (наприклад, бру- цельозний орхіт та епідидиміт у баранів), тривалі інтервали у використанні плідників (зокрема баранів) чи, навпаки, статеве виснаження плідника при великому навантаженні, особливо при природному паруванні, нарешті, недотримання технології роботи зі спермою, зокрема, порушення ізотонічності середовищ та робочих розчинів, що може викликати закручування хвостиків сперміїв.
З невластивих включень до сперми найчастіше виявляють клітини плоского та перехідного епітелію, клітини сім'яних канальців, форменні елементи крові, гіалінові кульки та амілоїдні тільця, зерна лецитину, кристали сперміну і т. п.
Свіжоодержану сперму, для зручності підрахунку, розріджують 1 %-им розчином хлористого натрію і роблять з неї на предметному склі тоненький мазок, який після висушування та фіксації спиртом зафарбовують азуреозином чи метиленовою синькою і, розглядаючи під мікроскопом, підраховують кількість нормальних та патологічних форм.
Крім згаданого, при мікроскопічному дослідженні сперми можна виявити такі відхилення її якості:
> асперматизм (Азм) - відсутність сперми;
> олігосперматизм (Озм) - малий об'єм еякуляту;
> аспермія (А) - відсутність сперміїв у спермі;
> олігоспермія (О) - мала кількість сперміїв у еякуляті;
> некроспермія (Н) - мертві спермії;
> тератоспермія (Т) - патологічні спермії.
Визначення виживання сперміїв поза організмом самця. Запліднююча здатність сперміїв тісно пов'язана з їх виживанням, що у свою чергу залежить від їх стійкості до зовнішніх впливів. Тому на племпідприємствах періодично визначають абсолютний показник виживання сперміїв кожного плідника. Крім того, цей метод застосовують при оцінюванні якості розріджувачів. Існує декілька методів такого тестування. Класичним вважається визначення виживання сперміїв (тривалість збереження рухливості сперміїв у годинах) при різних ступенях розрідження (від 2 до 1024) при 37 °С та при 2-4 °С до повного відмирання усіх сперміїв.
При цьому беруть 11 чистих сухих стерильних пробірок місткістю 2 мл і в усі з них, окрім першої, вносять по 0,5 мл розріджувача. У першу (порожню) та другу пробірки вносять по 0,5 мл досліджуваної сперми. Змішують у 2-й пробірці сперму з розріджувачем і переносять з неї 0,5 мл розрідженої сперми у 3-тю пробірку, з неї (після змішування суміші) переносять 0,5 мл у 4-ту пробірку і т. д., щоб отримати серію розріджень: нерозріджена сперма і розріджена у 2, 4, 8, 16, 32, 64, 128, 256, 512, 1024 разів. Зразу ж після розрідження беруть з кожної пробірки краплю сперми, оцінюють у ній рухливість сперміїв під мікроскопом при 38-40 °С. Закривають усі пробірки стерильними корками і ставлять у холодильник на зберігання при температурі +2-4 °С.
Через кожних 24 години визначають рухливість сперміїв при 38-40 °С з кожної пробірки. Повторюють так кожної доби аж до загибелі усіх сперміїв.
На підставі даних записів визначають за спеціальною формулою абсолютний показник виживання та відносний показник виживання сперміїв (розріджена сперма у порівнянні з нерозрідженою).
Сперма бугая та барана доброї якості при розрідженні її у 16-32 рази повинна мати абсолютний показник виживання сперміїв не нижче 1400, кнура - не нижче 900, жеребця - не нижче 400.
При оцінюванні виживання сперміїв за спрощеною формулою визначають наскільки знижується рухливість сперміїв за період зберігання.
Обчислений таким чином показник зниження рухливості сперміїв у балах у середньому на добу зберігання є показником виживання. Якщо рухливість сперміїв знизилася всередньому за добу більше ніж на 0,6 бала, то виживання сперміїв добре, при зниженні на 0,6-0,9 бала - задовільне, якщо більше 0,91 - виживання погане.
Нарешті, у практичних умовах виживання сперміїв визначають за проміжком часу (у годинах), протягом якого спермії зберігають прямолінійно-поступальний рух при
інкубації їх при +38 °С. Рухливість сперміїв визначають при цьому через кожну годину. Придатною до використання вважають сперму з рухливістю після розморожування не менше 4-х балів, а після 5-годинного інкубування - не нижче 0,5 бала.
У науковій роботі для оцінювання якості сперми застосовують цілий ряд морфологічних, фізіологічних, біохімічних, імунологічних досліджень.
| Мінімальні показники нативної сперми, придатної до використання |
Санітарну оцінку сперми та технологічних процесів, що застосовуються при штучному осіменінні, проводять з використанням методів бактеріології.
Таблиця 11
|
Усі дослідження сперми проводяться з дотриманням чинних стандартів та інструкцій щодо штучного осіменіння тварин.
Проте ні один із застосовуваних у даний час методів не відповідає головній вимозі:
> дати швидку відповідь про запліднюючу здатність сперміїв;
> не бути громіздким;
> тісно корелювати з фактичною запліднюваністю самок.
Визначити точно запліднюючу здатність сперміїв, навіть стосовно певної групи самок, що перебувають у контрольованих умовах утримання, догляду та осіменін- ня, наявними клінічними методами важко тому, що на цей показник впливає багато факторів.
Одні автори вважають, що запліднююча здатність сперміїв становить 70-75 % від першого осіменіння, інші доводять, що у клінічно здорових корів при повноцінному статевому циклі вона становить не менше 90 %, лише у значної частини тварин буває рання ембріональна смертність.
У зв'язку з цим у практиці тваринництва запліднюючу здатність сперміїв оцінюють за кількістю корів, які не прийшли повторно в охоту через 18-22 та 60-90 днів після осіменіння, а також ректальним дослідженням на тільність. Але в таких випадках важко віддиференціювати потенціальні здатності самців від запліднюваності самок. Тобто, на плодючість бугаїв нашаровується здатність корів до запліднення.
|
| Поделиться: |




