
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Металдардың жалпы қасиеттері. ІА,ІІА топ элементтеріСодержание книги
Поиск на нашем сайте Электролиз. Жұмыстың мақсаты: Электролиз процесінің жүруін көру және оның әр түрлі жағдайының схемасын құру. №1 Тәжрибе. №2 Тәжрибе. Калий иодиді ерітіндісінің электролизі. Электролизерге калий иодиді ерітіндісін құйыңдар, графит электродтарын батырыңдар да оларды тұрақты тоқ көзіне қосыңдар. 3 минуттай электролиз жүргізіңдер, катодта газ тәріздес сутегі бөлінеді, ал анодта бос иод бөлінеді. Электролиз схемасын жазыңдар. Тәжірбие біткен соң электродтар мен электролизерді жақсылап кранның астына жуыңыздар. №3Тәжрибе.Мыс (ІІ) сульфатының ерітіндісінің электролизі.Электролизерге мыс сульфаты ерітіндісін құйыңдар, оған графит электродтарын батырыңдар, тұрақты тоқ көзімен қосыңдар. 3-5 минут электролиз жүргізіңіздер. Анодта оттегінің бөлінгенін байқаңдар. Тәжірибе біткен соң катодта мыс бөлінгенін байқаңдар.Енді тоқ көзінің полюсін ауыстырыңдар. Нені байқайсыңдар? Электролиздің схемасын жазып, байқаған құбылыстарыңды түсіндіріңдер. Өзін өзі бақылауға және зертханалық жұмысты қорғауға арналған сұрақтар: 1.Электролиз деген не? 2.Анод және катодта жүретін процестерді түсіндіріңдер. 3.Металды рафинадтау деген не? Ол қалай жүреді? 4.Электролиз заңдары? № 10 Зертханалық сабақ Металдар коррозиясы Жұмыстың мақсаты: Электрохимиялық коррозия жылдамдығына әр түрлі факторлар әсерін көру. №1 Тәжрибе. Хлор-ионының коррозияны жылдамдатуы Екі пробиркаға 6 мл мыс сульфатын, 2 мл күкірт қышқылын құйыңдар. Бір пробиркаға 5 мл натрий хлоридін құйыңдар. Екі пробиркаға да алюминий сымын батырыңдар. Қай пробиркада газ интенсивті бөлінеді? Анодтық, катодтық және жалпы процестердің теңдеулерін жазыңдар. Реакция жылдамдығына хлор-ионының әсерін түсіндіріңдер.
№2 Тәжрибе.Оттегінің концентарциясына байланысты коррозия. Болат пластинканы наждак қағазымен тазалаңдар. Кранның астына қойып жуыңдар. Фильтр қағазымен сүртіп кептіріңдер. Содан кейін таза пластинканың бетіне мынандай ерітінділер: натрий хлориді, калий гексацианоферрат (ІІІ) және фенолфталеин қоспасынан тұратын ерітіндіні тамызыңдар. 3-5 минут уақыттан соң тамшының ортасында көк түсті, ал шетінде қызыл түсті ерітінділер пайда болады. Тамшының арасында гальваникалық элемент түзіледі. Тамшының ортасында оттегі аз болғандықтан анодтық, шетінде оттегі көп болғандықтан катодтық зона пайда болады. Тамшының ортасында темір екі валентті ионға тотығады, сондықтан турнбулевая синь (көк түсті) пайда болады. Тамшының шетінде судың әсерімен оттегі тотықсызданып, гидроксид-ион түзеді, сондықтан фенолфталеин қызылға боялады. Катодтық және анодтық процесстердің теңдеуін жазыңдар: Ғе2+ және ОН- иондарын анықтау реакцияларының және темірдің тат басу (ржавчина) реакциясының теңдеуін жазыңдар.
№3 Тәжрибе.Металдарды коррозиядан протектор әдісімен қорғау. Пробиркаға сүйытылған сірке қышқылын құйыңдар. Оған бірнеше тамшы калий иодиді ерітіндісін тамызыңдар, бір-бірімен контактқа келтіріп мырыш және қорғасын пластинкаларын батырыңдар.І- ионы Pb2+ ионына индикатор болып саналады. PbІ2 сары түсті тұнба. Салыстыру үшін басқа пробиркаға осы ерітінділерді құйып, тек қорғасынды салыңдар. Қай пробиркада қорғасын иодиді тез түзіледі? Pb – Zn гальваникалық элементтің схемасын жазыңдар. Қай металл протектор болып саналады?
№4 Тәжрибе.Коррозия жылдамдығына ингибитор әсері. Екі пробиркаға 5-6 мл күкірт қышқылын құйыңдар. Әр пробиркаға жұқа темір пластинкасын салыңдар. Бір пробиркаға уротропин не басқа ингибитор қосыңдар. Ингибитордың коррозия жылдамдығына әсерін қорытындылаңдар.
Өзін өзі бақылауға және зертханалық жұмысты қорғауға арналған сұрақтар:1.Металдар коррозиясы деген не? 2.Коррозияның қандай түрлерін білесіңдер? 3.Электрохимиялық коррозияның химиялықтан айырмашылығы неде? 4.Коррозиялық микрогальвани элементтері неге пайда болады? 5.Қандай факторлар коррозия жылдамдығына әсер етеді? 6.Металдарды коррозиядан қорғау әдістері.Қысқаша әр әдісті сипатта. 7.Қандай заттарды ингибиторлар деп атайды?
№ 11 Зертханалық сабақ Комплексті қосылыстар №1 Тәжрибе. Тетраамин мыс (ІІ) сульфаты комплекс қосылысын алу және оны зерттеу.Екі пробиркаға 5 мл 1 н мыс сульфатын құйыңдар. Бір пробиркаға 2 тамшы барий хлоридін құйыңдар, екінші пробиркаға гранулды қалайы (Sn) салыңдар. Бірінші пробиркада тұнба пайда болғанын, екінші пробиркада қалайының бетінде мыс бөлінгенін байқайсыңдар. Реакция теңдеуін жазыңдар.Үшінші пробиркаға 5-7 мл мыс сульфатын құйып, біртіндеп 25% -аммиак ерітіндісін құйыңдар. Басында ақ тұнба (негіздік мыс сульфаты) пайда болады, ол біртіндеп ериді. Ерітінді түсі көкке боялады, яғни мыс (ІІ) тетраамин сульфаты комплексі пайда болады. Теңдеулерін жазыңдар. Бұл комплекс қосылысты екіге бөліп, біреуіне барий хлоридін тамызыңдар, екіншісіне қалайы тастаңдар. Тұнба түзіледі ме? Мыс бөлінеді ме? Неге?
№2 Тәжрибе.Аниондық комплекс қосылыс. Пробиркаға 3-4 мл висмут нитраты ерітіндісін құйыңдар. Тамшылап калий иодиді ерітіндісін бурыл тұнба болғанша құйыңдар. Содан кейін бұл тұнба ерігенше (висмут иодиді) калий иодиді ерітіндісін құйыңдар. Реакция теңдеулерін жазыңдар. Алынған қосылыстың формуласы: ВіІ3∙КІ.Оны комплекс қосылыс ретінде жазыңдар, оның диссоциациясын көрсетіңдер.
№3 Тәжрибе.Катиондық комплекс қосылыс.Пробиркаға 3-4 тамшы никель сульфаты ерітіндісін құйып, оған күйдіргіш натр ерітіндісін тамызып, никель гидроксиді тұнбасын алыңдар. Тұнбаның үстіндегі сұйық ерітіндіні төгіп, тұнбаға 25%-аммиак құйып, ерітіңдер. Реакциялар теңдеуін жазыңдар. (Комплекс қосылыста никельдің координаталық саны 6-ға тең) комплекс қосылыстың диссоциациясын жазыңдар. Өзін өзі бақылауға және зертханалық жұмысты қорғауға арналған сұрақтар: 1. Комплекс түзуші заттың тотығу дәрежесі мен координациялық санын көрсетіңдер. Комплекс қосылыстарды атаңдар: K[AuBr4], K2[Cd(CN)4], [Pt(NH3)2Cl2], K[Cr(SO4)2], Na3[Ag(S2O3)2]. Комплекс қосылыстың диссоциацияларын жазыңдар. 2. Комплекс қосылыстар жазып, оларды атаңдар: PtCl4∙6NH3, PtCl4∙5NH3, PtCl4∙4NH3, Co(NO3)3∙6NH3, Co(NO2)3∙KNO2∙2NH3. 3. Қай негіз күштірек: [Cu(NH3)4](OH)2 не Cu(OH)2 ме? Қай комплекс ион тұрақтырақ: [Zn(NH3)4]2+ не [Cd(NH3)4]2+?o(NH3)4]2+ не [Co(NH3)4]3+?
№ 12,13 Зертханалық сабақ №1 Тәжрибе.Натрий мен калийдің ауада тотығуы.Пинцетпен керосиннің астындағы металдың (калий немесе натрий) аз мөлшерін банкадан алып, фильтр қағазына қойып, пышақпен кесіңдер (металдарды қолдарыңмен ұстамаңдар). Металдың кесілген жері неліктен тез жылтырынан айрылды? Теңдеу жазыңдар. №2 Тәжрибе. Натрий карбонаты мен гидрокарбонатының гидролизі.Үш пробиркаға 6-7 см3 дистильденген су құйыңдар. Әрқайсысына 1-2 тамшыдан лакмус ерітіндісін құйыңдар. Бір пробиркаға бірнеше натрий карбонатының кристалдарын, екіншісіне осынша натрий гидрокарбонатын салыңдар. Үшінші пробирканы салыстыруға қалдырыңдар. Пробиркалардағы ерітінділерді араластырғаннан кейін үшінші пробиркадағы ерітінді түсімен салыстырыңдар. Реакция теңдеулерін иондық және молекулалық түрде жазыңдар. Неге пробиркалардағы (№1 және №2) ерітінділер түсі әртүрлі? №3 Тәжрибе.Натрий хлориді ерітіндісінен электролиз арқылы натрий гидроксидін алу.Натрий хлориді ерітіндісін электролиздеңдер. Анодта қандай газ бөлінеді? Катодтың жанындағы ерітінді ортасы қандай екенін тәжірибе арқылы анықтаңдар. Электролизпроцессінің теңдеуін жазыңдар. №4 Тәжрибе.Кальцийдің сумен әрекеттесуі. Пробирканың 1/3 дейін су құйып, пинцетпен кальций металының аз мөлшерін салыңдар. Қандай газ бөлінеді? Су неге тұнбаланады? Суға фенолфталеин тамшылатып, ерітіндіде ОН- -ионы пайда болғанын дәлелдеңдер. Фенолфталеин түсі қалай өзгереді? Кальцийдің сумен әрекеттескен реакция теңдеуін жазыңдар. Тотықтырғыш пен тотықсыздандырғышты айтыңдар. №5 Тәжрибе. Аз еритін магний тұздарын алу.Пробиркаға 2-3 мл магний тұзының ерітіндісін құйып, оған магний гидроксокарбонатының тұнбасы түзілгенге дейін сода ерітіндісін құйыңдар. Газ бөлінгенін байқаңдар. Бұл түзілген негіздік тұздың хлорлы сутек қышқылымен әрекеттесуінің теңдеуін жазыңдар.Магний гидроксокарбонатының түзілуінің теңдеуін жазыңдар. Өзін өзі бақылауға және зертханалық жұмысты қорғауға арналған сұрақтар: 1. Кальций мен магнийдің қандай қосылыстары суды кермектендіреді? Су кермектігін қалай жоюға болады? 2. Бірдей жағдайда мына тұздардың Ве(NO3)2, Mg(NO3)2 қайсысы гидролизге көбірек ұшырайды? Тұздардың гидролиздерінің иондық теңдеулерін жазыңдар 3. Be – Mg – Ca – Sr – Ba қатарындағы элементтердің химиялық активтігі оттегіне, фторға және азотқа қалай өзгереді? Теңдеулерін жазыңдар. 4. Кальций мен магнийді оксидтерінен тотықсыздандыру арқылы алу үшін қандай жағдайлар керек? 5. Өндірісте кальций мен магнийді қалай алады? 6. Кальцийді оның оксидінен алюминий арқылы тотықсыздандырып алуға бола ма? Реакцияны Гиббс энергиясын есептеу арқылы дәлелдеңдер. 7. Магний ауада жанғанда қандай заттар пайда болады? Бұл заттардың сумен әрекеттесу реакциясының теңдеулерін жазыңдар. 8. Магнийдің көміртегі диоксидінде жануының ∆G298 есептеңдер. Реакция өздігінен жүре ала ма? 9. ІІ топтың негізгі топшасының элементтерінің валенттілігі І не ІІ көп болатын қосылыс түзе ала ма? 10. Са, Sr, Ba элементтері неге сілтілік жер металдары деп аталады? 1.1. 500кг СаО өшіргенде қанша жылу бөлінеді? СаО гидратациялану энтальпиясы ∆Н= -66,6 Дж/моль. Жауабы: 594,6∙103 кДж
№ 14,15 Зертханалық сабақ
|
||
|
Последнее изменение этой страницы: 2024-06-27; просмотров: 65; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.008 с.) |

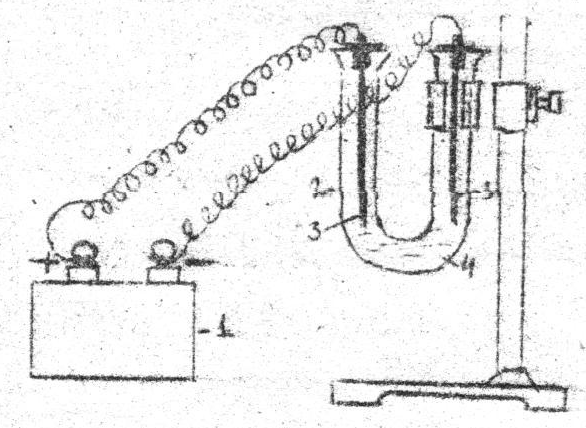 Тұрақты тоқ көзінің теріс полюсін анықтау. Зертханада электролизер ретінде U тәріздес шыны ыдыстан тұрақты екі электрод салынған прибор қолданылады. 1-тұрақты тоқ көзі; 2- U тәріздес шыны ыдыс; 3- электродтар; 4- электролит ерітіндісі. U- тәріздес шыны ыдысқа натрий сульфатының ерітіндісін құйып, 1-2 тамшы фенолфталеин тамызыңдар. Мыс электродтары тоқ көзімен қосыңдар. 30-40 секундтан кейін теріс полюс қосылғанэлектродтың жанында ерітінді қызыл түске боялады. Электрлиз схемасын жазыңдар.
Тұрақты тоқ көзінің теріс полюсін анықтау. Зертханада электролизер ретінде U тәріздес шыны ыдыстан тұрақты екі электрод салынған прибор қолданылады. 1-тұрақты тоқ көзі; 2- U тәріздес шыны ыдыс; 3- электродтар; 4- электролит ерітіндісі. U- тәріздес шыны ыдысқа натрий сульфатының ерітіндісін құйып, 1-2 тамшы фенолфталеин тамызыңдар. Мыс электродтары тоқ көзімен қосыңдар. 30-40 секундтан кейін теріс полюс қосылғанэлектродтың жанында ерітінді қызыл түске боялады. Электрлиз схемасын жазыңдар.


