
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Материальный баланс простой перегонкиСодержание книги
Поиск на нашем сайте Область применения 1 Разделение жидких смесей веществ, незначительно различающихся по температуре кипения (менее 60 °С, для различающихся более 60 °С: см. также простая перегонка, перегонка в вакууме). Но с температурой до 200 °С (более 200 °С вещества разлагаются и следует применять перегонку под вакуумом). Пример: разделение смеси ацетон (т. кип. 56 °С)/вода (т. кип. 100 °С). 2 Отделение жидкого вещества от нелетучих примесей (твердых компонентов). Пример: перегонка эфира (т. кип. 35 °С) над натрием (нелетуч). 3 Часто фракционная перегонка используется для очистки продажных реактивов, для очистки и выделения полученных продуктов реакций. Перегонка под вакуумом – способ разделения смеси жидких веществ, основанный на различной температуре кипения компонентов смеси в вакууме. Особое значение имеет при перегонке термолабильных веществ. В вакууме вещества кипят гораздо с меньшей температурой, приблизительное соответствие температуры в вакууме и при атмосферном давлении можно узнать из этой монограммы. Область применения 1 Разделение жидких смесей веществ, различающихся по температуре кипения (менее 60 °С – с дефлегматором, с более 60 °С – простая перегонка) и имеющих высокую температуру кипения. Пример: выделение ДМСО из смеси ацетон (т. кип. 56 °С)/диметилсульфоксид (ДМСО) (т. кип. 189 °С с разложением при 1 атм., ~60 °С в вакууме водоструйного насоса без разложения). 2 Отделение высоко кипящего жидкого вещества от нелетучих примесей (твердых компонентов). Пример: перегонка ДМСО над гидридом кальция (не летуч). 3Разделение смесей неразделимых при атмосферном давлении. Пример: разделение азеотропной смеси этанол/вода. Этанол кипит при 70 мм. рт. ст. при 28 °С без образования азеотропа с водой. 4Часто перегонка под вакуумом используется для очистки продажных высоко кипящих растворителей, реактивов, для очистки и выделения термолабильных или высоко кипящих продуктов реакций. Перегонка с водяным паром Перегонка с водяным паром – способ разделения смеси веществ малорастворимых в воде и не взаимодействующих с ней, обладающих значительным давлением пара при температуре кипения воды. Такая перегонка уменьшает термическое воздействие на разделяемые вещества и приближается к вакуумной перегонке. Область применения 1Отделение продуктов реакции от смолообразных веществ. Пример: очистка смол различного состава, смазочных масел, эфирных масел, жирных кислот. 2 Перегонка чувствительных к нагреванию веществ. Пример: лимонен (т. кип. 178 °С) перегоняется с водяным паром (т. кип. 100 °С).
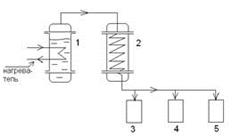
1 – перегонный куб; 2 – конденсатор-холодильник; 3,4,5 – сборники фракций. Простая перегонка заключается в постепенном испарении жидкости и конденсации образующихся паров. Рассмотрим периодически действующую перегонку. В куб залита жидкая смесь. Составим уравнение материального баланса. Пусть в момент времени τ в кубе L кг смеси, х – концентрация НК в смеси, Lх – количество НК в смеси. За время dτ испарится dL кг смеси и концентрация уменьшится на dx. При этом образуется dL кг пара, равновесного с жидкостью и имеющего концентрацию у*; dLy* - количество НК в паре. В кубе останется остаток (L – dL) кг с концентрацией (х – dx). Тогда уравнение материального баланса по НК: Lx = (L-dL)(x-dx)+dLy*; раскроем скобки Lх = Lх -dLх-Ldx+dLdx +dLy*, после сокращения получим dL(y*-х) = Ldx,разделим переменные F xF xF Тогда: ∫ dL/L = ∫ dx/(y* - х); ln(F/W) = ∫ dx/(y* - х) – W хW хW -уравнение простой перегонки. Вид функции у* = f(x) определяется формой кривой равновесия и не может быть установлен аналитически. Поэтому правую часть интегрируют графически (см. пред. лекц.). Из уравнения можно получить W, зная F и хF, хW. Средний состав дистиллята хр можно определить из уравнения материального баланса по НК:
|
||
|
Последнее изменение этой страницы: 2024-06-27; просмотров: 55; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.137 (0.008 с.) |

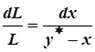 . Это дифференциальное уравнение проинтегрируем от L = F (количество исходной смеси) до L = W(количество остатка) и по х от хF до хW (хF – концентрация НК в исходной смеси; хW- концентрация в остатке )
. Это дифференциальное уравнение проинтегрируем от L = F (количество исходной смеси) до L = W(количество остатка) и по х от хF до хW (хF – концентрация НК в исходной смеси; хW- концентрация в остатке )


