Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Каковы причины нарушения функции кардиостимулятора в интраоперационном периоде?Содержание книги
Поиск на нашем сайте Электрокоагуляция, имитируя электрическую активность миокарда, способна нарушать ЭКС. Когда необходима электрокоагуляция, прибегают к следующим мерам: применяют очень короткие импульсы, ограничивают выходную мощность коагулятора, помещают плату заземления как можно дальше от кардиостимулятора, переходят на биполярную электрокоагуляцию. Кроме того, обязательно осуществляют непрерывный мониторинг пульсовой артериальной кривой (инвазивное АД, плетизмография, пульсоксиметрия), позволяющий контролировать адекватность перфузии в периоды работы электрокоагулятора. Миопотенциа-лы, возникающие при фасцикуляциях (побочное действие сукцинилхолина) и послеоперационной дрожи, могут неверно восприниматься как потенциалы от миокарда и блокировать ЭКС. Гипо- и гиперкалиемия, ишемия и инфаркт миокарда, постинфарктный кардиосклероз повышают порог стимуляции, что может привести к неспособности стимулирующего импульса деполяризовать желудочек. Что делать при нарушении функции кардиостимулятора во время операции? При сбое в работе временного кардиостимулятора необходимо увеличить FiO2 до 100 %. Следует проверить все соединения и питание кардиостимулятора. Большинство моделей снабжены индикатором зарядки элементов питания и световым индикатором, мигающим при каждом импульсе. Кардиостимулятор переводят в асинхронный режим, на желудочковый электрод подают импульс максимальной амплитуды. Нарушения навязывания импульса желудочкам при эндокардиальной ЭКС чаще всего обусловлены смещением стимулирующего электрода. Осторожное медленное продвижение электрода или катетера часто нормализует ЭКС. Во время налаживания ЭКС полезно назначение лекарственных препаратов (атропин, изопротеренол или адреналин). Если адреномиметиками не поддерживается адекватное АД, начинают сердечно-легочную реанимацию и не прекращают ее до тех пор, пока не будет произведена замена электрода или генератора кардиостимулятора. При возникновении сбоя в работе постоянного имплантированного кардиостимулятора (например, при электрокоагуляции) его переводят в асинхронный режим. Некоторые модели стимуляторов при обнаружении сбоя автоматически переключаются на асинхронный режим; другие модели кар-диостимуляторов должен перепрограммировать врач, используя магнит или, что предпочтительнее, перенастраивая наружное программирующее устройство. Влияние магнита на некоторые кардио-стимуляторы (особенно на фоне работы электро- ТАБЛИЦА 20-17. Классификация кардиостимуляторов
1 Частота импульсов автоматически изменяется в зависимости от потребности в сердечном выбросе.— Примеч. пер. коагулятора) непредсказуемо, поэтому его надо опробовать еще до начала операции. Какие анестетики применяют при ЭКС? У пациентов с установленным кардиостимулято-ром безопасно использовать любые анестетики. По-видимому, даже ингаляционные анестетики не влияют на порог стимуляции. Для имплантации постоянного кардиостимулятора прибегают к местной анестезии с легкой в/в седацией. Как оценить функцию постоянного электрода для эндокардиальной ЭКС после установки? Функцию постоянного электрода в окончательной позиции анализируют на внешнем тестирующем устройстве, которое измеряет порог стимуляции, импеданс электрода и амплитуду воспринимаемых потенциалов. При начальной выходной амплитуде импульса в 5 В и длительности импульса 0,5 mc частоту ЭКС увеличивают до тех пор, пока не будет навязан 100 % захват импульсов. После достижения этой точки выходную амплитуду начинают медленно снижать для определения минимальной выходной амплитуды, при которой сохраняется 100 % захват импульсов (синонимы: пороговое напряже- ние, порог стимуляции). Порог стимуляции для желудочков должен быть не выше 0,8 В, а для предсердий — не выше 1,5 В. Импеданс отведения должен составлять 250-1000 Ом при номинальном выходе 5 В. Амплитуда воспринимаемых потенциалов должна быть > 6 мВ для желудочковых электродов и > 2 мВ — для предсердных. Избранная литература Brown D. L. Risk and Outcome in Anesthesia, 2nd ed. Lippincott, 1992. Braunwald E. Heart Disease, 4th ed. Saunders, 1992. Goldman L. Cardiac risk in noncardiac surgery: an update. Anesth. Analg., 1995; 80: 810. Hensley F. A., Martin D. E. A Practical Approach to Cardiac Anesthesia, 2nd ed. Little, Brown, 1995. Kaplan J. A. Cardiac Anesthesia, 3rd ed. Saunders, 1993. Lynch C. Clinical Cardiac Electrophysiology, Lippincott, 1994. Mangano D. T. Preoperative Cardiac Assessment. Lippincott, 1990. Wood M., Wood A. J. J. Drugs and Anesthesia: Pharmacology for the Anesthesiologist, 2nd ed. Williams & Wilkins, 1990. Анестезия в сердечнососудистой хирургии
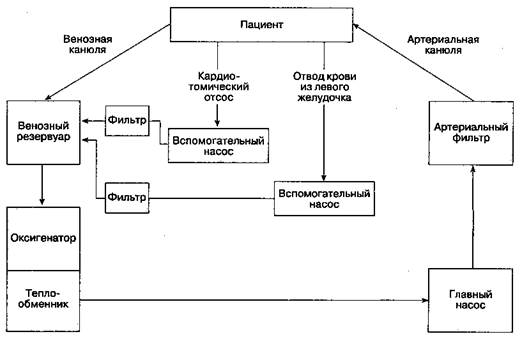
Анестезия в сердечно-сосудистой хирургии требует не только понимания физиологии, патофизиологии и фармакологии кровообращения, но также и знания методик проведения операций, искусственного кровообращения (ИК) и защиты миокарда. Кардиохирургические манипуляции воздействуют на систему кровообращения, поэтому анестезиолог должен внимательно следить за ходом операции и своевременно предупреждать возникновение осложнений на любом ее этапе. В настоящей главе дан обзор анестезии в сердечно-сосудистой хирургии, а также рассматриваются принципы, методики и физиология ИК. Кроме того, в ней обсуждаются анестезиологические аспекты при операциях на аорте, сонных артериях и перикарде. Искусственное кровообращение Искусственное кровообращение — это метод, позволяющий отвести венозную кровь от сердца, удалить CO2, насытить кровь кислородом и вернуть в крупную артерию (обычно в аорту). При ИК полностью прекращается кровоток в сердце и большая часть кровотока через легкие. Аппарат искусственного кровообращения (АИК) последовательно соединен с системным кровообращением и обеспечивает газообмен и перфузию. К сожалению, ИК абсолютно нефизиологично, поскольку АД, как правило, оказывается ниже нормы, а поток крови чаще всего имеет непульсирующий характер. Чтобы свести к минимуму повреждения органов во время ИК, обычно применяют системную гипотермию (20-28 0C). Для защиты сердца используют также местную гипотермию (талым льдом) и кардиоплегию (подавление электрической активности миокарда специальным раствором). Работа с АИК — сложный процесс, требующий непрерывного внимания высококвалифицирован- ного специалиста — перфузиолога. Наладить оптимальный режим ИК можно только при тесном взаимодействии хирурга, анестезиолога и перфузиолога. Основной контур Аппарат искусственного кровообращения (АИК) состоит из пяти основных компонентов: венозный резервуар, оксигенатор, теплообменник, главный насос и артериальный фильтр (рис. 21-1). В современных моделях АИК есть одноразовый моноблок, в котором объединены резервуар, оксигенатор и теплообменник. Большинство моделей АИК снабжены также отдельными вспомогательными насосами, которые предназначены для забора крови из раны (кардиотомический отсос), дренажа ЛЖ и кардиоплегии. Помимо того, используют дополнительные фильтры, тревожную сигнализацию, а также встроенные мониторы давления, SO2 и температуры. Перед началом применения АИК заправляют раствором (1500-2000 мл для взрослых), в котором не должно быть пузырьков воздуха. Обычно используют сбалансированный солевой раствор, но в него часто добавляют другие компоненты: коллоиды (альбумин или гидроксиэтилированный крахмал), маннитол (для защиты почек), гепарин (500-1000 единиц), бикарбонат и калий (если не предполагается проведение кардиоплегии). В начале ИК гемодилюция в большинстве случаев приводит к снижению гематокрита до 25 %. Кровь, во избежание чрезмерной гемодилюции, используют в качестве заправочного раствора только у маленьких детей, а также у взрослых с выраженной анемией. Резервуар В резервуар АИК кровь от больного (обычно из правого предсердия) поступает через одну или две венозных канюли под действием силы тяжести. Поскольку венозное давление в норме низкое, то движущая сила прямо пропорциональна разно- сти высоты между пациентом и резервуаром и обратно пропорциональна сопротивлению канюль и трубок. Заправка АИК приводит к эффекту сифона. Попадание воздуха в резервуар становится причиной возникновения воздушной пробки, препятствующей току крови. Уровень жидкости в резервуаре является критическим параметром: если резервуар опустошается, воздух может попасть в главный насос и вызвать летальную воздушную эмболию. Как правило, в АИК имеется тревожная сигнализация, предупреждающая о низком уровне жидкости в резервуаре. Оксигенатор Под действием силы тяжести кровь поступает из нижней части венозного резервуара в оксигена-тор. В настоящее время используют два типа окси-генаторов — пузырьковые и мембранные. Они отличаются по способу контакта крови с газовой смесью (главным образом с кислородом), проходящей через оксигенатор. Кроме того, в патрубок подачи газовой смеси нередко добавляют CO2 и ингаляционные анестетики. А. Пузырьковые оксигенаторы. В пузырьковых оксигенаторах газообмен происходит при прямом контакте газа с кровью. Венозная кровь взаимодействует с кислородом, поступающим че- рез маленькие отверстия на дне оксигенатора. В результате образуется много крошечных пузырьков (пена). Чем меньше размер пузырьков, тем больше площадь поверхности газообмена. Затем пузырьки удаляются посредством пропускания крови через пеногаситель (электрически заряженный силиконовый полимер). Степень ok-сигенации зависит от величины потока, площади поверхности газообмена (размера и числа пузырьков) и времени прохождения крови через колонку оксигенатора. Удаление CO2 прямо пропорционально потоку кислорода pi обычно не представляет проблемы. Таким образом, PaO2 и PaCO2 взаимосвязаны и зависят от потока кислорода. Если регуляцию КОС проводят в режиме рН-stat (см. ниже), то иногда необходимо добавление CO2. Как правило, пузырьковые оксигенаторы дешевле мембранных; но их главный недостаток состоит в том, что они травмируют форменные элементы крови. Чем дольше длится ИК, тем выраженнее повреждение. Если продолжительность ИК не превышает 2 ч, существенной травмы форменных элементов крови в пузырьковых оксигенаторах не происходит. В этом случае конструктивные различия между обоими типами оксигенаторов клинически не проявляются. Б. Мембранные оксигенаторы. Взаимодействие между кровью и газом в мембранных оксиге-
Рис. 21-1. Схема аппарата искусственного кровообращения. Месторасположение главного насоса в контуре зависит от типа оксигенатора: насос помещают дистальнее пузырькового оксигенатора, но проксимальнее мембранного, поскольку последний создает большее сопротивление потоку крови наторах осуществляется через очень тонкую газопроницаемую силиконовую мембрану. Оксигена-ция обратно пропорциональна толщине слоя крови, находящегося в контакте с мембраной, тогда как PaCO2 (как и в пузырьковых оксигенаторах) зависит от газового потока. Поскольку FiO2 может варьироваться, мембранные оксигенаторы позволяют независимо управлять PaO2 и PaCO2. Мембранные оксигенаторы меньше повреждают форменные элементы крови, поэтому их следует использовать при длительном ИК. Теплообменник Кровь из оксигенатора поступает в теплообменник. Здесь она охлаждается или нагревается, в зависимости от температуры воды, циркулирующей в обменнике (4-42 0C); теплопередача происходит в результате кондукции. Растворимость газов снижается при повышении температуры крови, поэтому для улавливания любых пузырьков, которые могут образоваться при согревании крови, в аппарате установлен фильтр. Основной насос В современных моделях АИК для перекачивания крови применяют либо роликовые, либо центри-фужные насосы. А. Роликовый насос создает поток путем пережатия трубки большого диаметра вращающимся роликом в главной насосной камере. Неполное пережатие трубки предотвращает чрезмерное повреждение эритроцитов. Благодаря постоянной скорости вращения роликов кровь выталкивается независимо от встречаемого сопротивления, так что возникает постоянный непульсирующий поток, величина которого прямо пропорциональна числу вращений в минуту. Некоторые модели насосов снабжены запасной батареей аварийного питания для работы в случае неполадок в электроснабжении. Все роликовые насосы имеют ручной привод. Б. Центрифужный насос состоит из нескольких соосно соединенных конусов в пластиковом корпусе. Когда они вращаются, создающиеся центробежные силы нагнетают кровь от расположенного в центре впускного штуцера к периферии. Производительность центрифужных насосов, в отличие от таковой у роликовых, зависит от давления в системе и потому подлежит контролю электромагнитным расходомером. Повышение давления в контуре дистальнее насоса уменьшает поток, что должно быть компенсировано увеличением скорости работы насоса. В центрифужных насосах не используют окклюзию, вследствие чего в них меньше повреждается кровь, чем в роликовых. В. Пульсирующий поток. Некоторые модели роликовых насосов формируют пульсирующий поток крови. Пульсация создается или мгновенными колебаниями скорости вращения роликовых головок, или добавляется уже после того, как поток сгенерирован. Центрифужные насосы не способны обеспечить пульсирующий поток. По мнению некоторых специалистов пульсирующий поток улучшает перфузию тканей, способствует лучшей экстракции кислорода в тканях, ослабляет высвобождение стрессорных гормонов и обеспечивает меньшее ОПСС во время ИК. Эти наблюдения подтверждены в экспериментальных исследованиях, обнаруживших улучшение почечного и мозгового кровообращения у животных при перфузии пульсирующим потоком. Артериальный фильтр Микрочастицы (тромбы, частицы жира, кальциевые депозиты, фрагменты тканей) попадают в кро-воток при ИК регулярно. Для предупреждения системной эмболии необходимо установить фильтр на линии артериальной магистрали (диаметр пор 27-40 мкм). Кроме того, вспомогательные фильтры подсоединяют и в других участках контура. После фильтрации кровь поступает к больному через канюлю в восходящей аорте. Нормально функционирующий аортальный клапан предотвращает ретроградный заброс крови из восходящей аорты в ЛЖ. Параллельно с артериальным фильтром монтируют шунт, который в нормальных условиях пережат. Это нужно на случай, если фильтр засоряется или создает большое сопротивление. По той же причине давление в артериальной магистрали измеряют перед фильтром. Фильтр также позволяет улавливать пузырьки воздуха, которые удаляются с помощью встроенного трехходового крана.
|
|||||||||||
|
Последнее изменение этой страницы: 2016-04-20; просмотров: 415; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.102 (0.013 с.) |