Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Экзокринные отделы поджелудочной железыСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
выделяют из клеток долек пищеварительные ферменты, которые растворены в жидкости с нейтральным pH и обогащенной ионами Cl-, а из клеток выводящих протоков - свободную от белков щелочную жидкость. К пищеварительным ферментам относятся амилазы, липазы и протеазы. Бикарбонат в секрете клеток выводящих протоков необходим для нейтрализации соляной кислоты, которая поступает с химусом из желудка в двенадцатиперстную кишку. Ацетилхолин из окончаний блуждающего нерва активирует секрецию в клетках долек, тогда как секреция клеток в выводящих протоках стимулируется прежде всего секретином, синтезируемым в S-клетках слизистой оболочки тонкого кишечника. За счет модуляторного влияния на холинергическую стимуляцию холецистокинин (ССК) воздействует на ацинарные клетки, в результатет чего их секреторная активность усиливается. Холецистокинин также оказывает стимулирующее влияние на уровень секрецию клеток эпителия протока поджелудочной железы. Если отток секрета затруднен, как при муковисцидозе (цистический фиброз); если сок поджелудочной железы особенно тягуч; или когда выводящий проток сужен в результате воспаления или отложений, то это может приводить к воспалению поджелудочной железы (панкреатит). Рис. 10-25. Строение экзокринной части поджелудочной железы. На нижней части рисунка схематично отображено существовавшее до настоящего времени представление о разветвленной системе протоков, на концах которых расположены ацинусы (концевые участки). На увеличенном изображении видно, что в действительности ацинус является сетью соединенных друг с другом секреторных канальцев. Внедольковый проток соединен через тонкий внутридольковый проток с такими секреторными канальцами
Механизм секреции бикарбонатов клетками поджелудочной железы Поджелудочная железа выделяет около 2 литров жидкости в день. Во время переваривания уровень секреции возрастает во много раз по сравнению с состоянием покоя. В покое, натощак, уровень секреции составляет 0,2-0,3 мл/мин. После приема пищи уровень секреции вырастает до 4-4,5 мл/мин. Такое увеличение скорости секреции у человека является достижением прежде всего эпителиальных клеток выводящих протоков. В то время, как ацинусы выделяют нейтральный богатый хлоридом сок с растворенными в нем пищеварительными ферментами, эпителий выводящих протоков поставляет щелочную жидкость с высокой концентрацией бикарбоната (рис. 10-26), которая у человека составляет больше 100 ммоль. В результате смешивания этого секрета с содержащим НС1 химусом рН поднимается до значений, при которых пищеварительные ферменты максимально активированы. Чем выше скорость секреции поджелудочной железы, тем выше концентрация бикарбоната в соке поджелудочной железы. При этом концентрация хлорида ведет себя как зеркальное отражение концентрации бикарбоната, поэтому сумма концентраций обеих анионов при всех уровнях секреции остается одинаковой; она равна сумме ионов К+ и Na+, концентрации которых изменяются так же незначительно, как и изотоничность сока поджелудочной железы. Такие соотношения концентраций веществ в соке поджелудочной железы могут быть объяснены тем, что в поджелудочной железе выделяются две изотоничные жидкости: одна богатая NaCl (ацинусы), а другая богатая NaНСО3 (выводящие протоки) (рис. 10-26). В состоянии покоя и ацинусы, и протоки поджелудочной железы выделяют незначительное количество секрета. Однако в покое преобладает секреция ацинусов, в результате чего конечный секрет богат С1-. При стимуляции железы секретином уровень секреции эпителия протока увеличивается. В связи с этим одновременно снижается концентрация хлорида, поскольку сумма анионов не может превышать (неизменную) сумму катионов. Рис. 10-26. Механизм секреции NaHCO3 в клетках протока поджелудочной железы похож на NaНС03-секрецию в кишечнике, поскольку он также зависит от локализованной на базолатеральной мембране Na+/K+-АТФазы и белка переносчика, осуществляющего обмен ионов Na+/H+ (антипорт) через базолатеральную мембрану. Однако в данном случае HCO3- попадает в проток железы не через ионный канал, а с помощью белка-переносчика, обеспечивающего анионный обмен. Для поддержания его работы подключенный параллельно Cl--канал должен обеспечивать рециркуляцию ионов Cl-. Этот Сl--канал (CFTR = Cystic Fibrosis Transmembrane Conductance Regulator) дефектен у пациентов с муковисцидозом (= Cystic Fibrosis), что делает секрет поджелудочной железы более тягучим и бедным HCO3-. Жидкость в протоке железы заряжается отрицательно по отношению к интерстициальной в результате выхода из клетки Cl- в просвет протока (и проникновения K+ в клетку через базолатеральную мембрану), что способствует пассивной диффузии Na+ в проток железы по межклеточным плотным контактам. Высокий уровень секреции HCO3- возможен, по всей видимости, потому, что HCO3- вторично-активно транспортируется в клетку с помощью белка-переносчика, осуществляющего сопряженный транспорт Na+-HCO3- (симпорт; белок-переносчик NBC, на рисунке не изображен; белок-переносчик SITS)
Состав и свойства ферментов поджелудочной железы В отличие от клеток протока, ацинарные клетки выделяют пищеварительные ферменты (табл. 10-1). Кроме того, ацинусы поставляют неферментативные белки, такие как иммуноглобулины и гликопротеины. Пищеварительные ферменты (амилазы, липазы, протеазы, DNазы) необходимы для нормального переваривания составных частей пищи. Существуют данные, что набор ферментов изменяется в зависимости от состава принятой пищи. Поджелудочная железа, чтобы защитить себя от самопереваривания своими же протеолитическими ферментами, выделяет их в форме неактивных предшественников. Так трипсин, например, секретируется в виде трипсиногена. В качестве дополнительной защиты сок поджелудочной железы содержит ингибитор трипсина, который предотвращает его активацию внутри секреторных клеток. Рис. 10-27. Свойства важнейших пищеварительных ферментов поджелудочной железы, выделяемых ацинарными клетками, и ацинарных неферментативных белков (табл. 10-1) Таблица 10-1. Ферменты поджелудочной железы
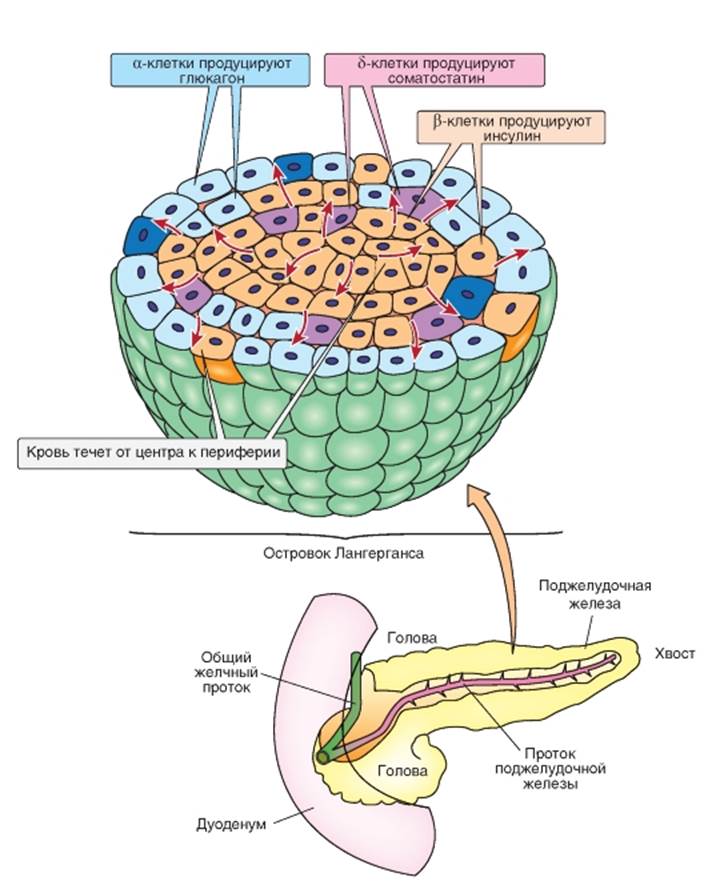
* Многие пищеварительные ферменты поджелудочной железы существуют в двух и более формах, которые отличаются друг от друга относительными молекулярными массами, оптимальными значениями pH и изоэлектрическими точками ** Классификационная система Enzyme Commission, International Union of Biochemistry Эндокринная функция поджелудочной железы Островковый аппарат представляет эндокринную часть поджелудочной железы и составляет только 1-2% ткани преимущественно экзокринной ее части. Из них около 20% - α -клетки, в которых образуется глюкагон, 60-70% составляют β -клетки, которые производят инсулин и амилин, 10-15% - δ -клетки, которые синтезируют соматостатин, угнетающий секрецию инсулина и глюкагона. Еще один тип клеток - F-клетки производит панкреатический полипептид (иное название - ПП-клетки), который возможно является антагонистом холецистокинина. Наконец, существуют и G-клетки, вырабатывающие гастрин. Быструю модуляцию высвобождения гормонов в кровь обеспечивает локализация этих эндокринно активных клеток в союзе с островками Лангерганса (названными так в честь открывателя - немецкого студентамедика), позволяющая осуществлять паракринный контроль и дополнительный прямой внутриклеточный транспорт веществ-передатчиков и субстратов через многочисленные Gap Junctions (плотные межклеточные контакты). Поскольку V. pancreatica впадает в воротную вену, концентрация всех гормонов поджелудочной железы в печени, самом важном для обмена веществ органе, в 2-3 раза выше, чем в остальной сосудистой системе. При стимуляции это соотношение возрастает в 5-10 раз. В целом, эндокринные клетки выделяют два ключевых для регуляции углеводородного обмена гормона: инсулин и глюкагон. Секреция этих гормонов главным образом зависит от концентрации глюкозы в крови и модулируется соматостатином, третьим по значимости гормоном островков, совместно с гастроинтестинальными гормонами и автономной нервной системой. Рис. 10-28. Островок Лангерганса
Глюкагон и инсулин-гормоны поджелудочной железы Глюкагон синтезируется в α -клетках. Глюкагон состоит из единственной цепи из 29 аминокислот и имеет молекулярную массу 3500 Dа (рис. 10-29 А, Б). Его аминокислотная последовательность гомологична некоторым гастроинтестинальным гормонам, таким как секретин, вазоактивный интестинальный пептид (VIP) и GIP. С эволюционной точки зрения, это очень старый пептид, который сохранил не только свою форму, но и некоторые важные функции. Глюкагон синтезируется через препрогормон в α-клетках островков поджелудочной железы. Сходные с глюкагоном пептиды у человека также дополнительно образуются в различных клетках кишечника (энтероглюкагон или GLP 1). Посттрансляционное расщепление проглюкагона в различных клетках кишечника и поджелудочной железы происходит по-разному, так что образуется целый ряд пептидов, функции которых еще не выяснены. Циркулирующий в крови глюкагон примерно на 50% связан с белками плазмы; этот, так называемый большой глюкагон плазмы, биологически не активен. Инсулин синтезируется в β -клетках. Инсулин состоит из двух пептидных цепочек, А-цепочки из 21 и В-цепочки из 30 аминокислот; его молекулярная масса составляет около 6000 Dа. Обе цепи связаны между собой дисульфидными мостиками (рис. 10-29 В) и образованы из предшественника, проинсулина в результате протеолитического отщепления С-цепи (связывающий пептид). Ген для синтеза инсулина локализован в 11-й хромосоме человека (рис. 10-29 Г). С помощью соответствующей мРНК в эндоплазматическом ретикулуме (ER) синтезируется препроинсулин с молекулярной массой 11 500 Dа. В результате отделения сигнальной последовательности и образования дисульфидных мостиков между цепочками А, В и С появляется проинсулин, который в микровези- кулах транспортируется к аппарату Гольджи. Там происходит отщепление С-цепочки от проинсулина и образование цинк-инсулиновых-гексамеров - запасающей формы в «зрелых» секреторных гранулах. Уточним, что инсулин разных животных и человека различается не только по аминокислотному составу, но и по α-спирали, которая обусловливает вторичную структуру гормона. Более сложной является третичная структура, образующая участки (центры), ответственные за биологическую активность и антигенные свойства гормона. Третичная структура мономерного инсулина включает гидрофобный кор, который образует шиловидные отростки на его поверхности, обладающие гидрофильными свойствами, за исключением двух неполярных областей, обеспечивающих агрегационные свой-ства молекулы инсулина. Внутреннее строение молекулы инсулина важно для взаимодействия с его рецептором и проявления биологического действия. При исследовании с помощью рентгеноструктурного анализа установлено, что одна гексамерная единица кристаллического цинк-инсулина состоит из трех димеров, свернутых вокруг оси, на которой расположены два атома цинка. Проинсулин так же, как и инсулин, образует димеры и цинксодержащие гексамеры. Во время экзоцитоза инсулин (А- и В-цепочки) и С-пептид выделяются в эквимолярных количествах, причем еще около 15% инсулина остается в виде проинсулина. Сам проинсулин оказывает лишь очень ограниченное биологическое действие, о биологическом действии С-пептида еще нет достоверных сведений. У инсулина очень короткий период полужизни, порядка 5-8 мин, у С-пептида - в 4 раза длиннее. В клинике измерение С-пептида в плазме используется в качестве параметра функционального состояния β-клеток, и даже при терапии инсулином позволяет оценить остаточную секреторную емкость эндокринной поджелудочной железы. Рис. 10-29. Структура глюкагона, проинсулина и инсулина. А - глюкагон синтезируется в α -клетках и его структура представлена на панели. Б - инсулин синтезируется в β -клетках. В - в поджелудочной железе β -клетки, вырабатывающие инсулин, распределены равномерно, тогда как α -клетки, производящие глюкагон, сосредоточены в хвосте поджелудочной железы. В результате отщепления С-пептида в указанных участках появляется инсулин, состоящий из двух цепей: А и В. Г - схема синтеза инсулина
Клеточный механизм секреции инсулина Панкреатические β-клетки повышают уровень внутриклеточной глюкозы за счет ее входа через GLUT2-транспортер и метаболизируют глюкозу, а также галактозу и маннозу, и каждое это вещество может вызвать секрецию инсулина островками. Другие гексозы (например, З-О-methylglucose или 2-deoxyglucose), которые транспортируются в β -клетки, но не могут там метаболизироваться, и не стимулируют секрецию инсулина. Некоторые аминокислоты (особенно аргинин и лейцин) и маленькие кетокислоты (α-ketoisocaproate) так же, как ketohexoses (фруктоза), могут слабо стимулировать секрецию инсулина. Аминокислоты и кетокислоты не разделяют никакого метаболического пути с гексозами, кроме окисления через цикл лимонной кислоты. Эти данные привели к предположению, что ATФ, синтезированный в результате метаболизма этих различных веществ может быть вовлечен в секрецию инсулина. Исходя из этого было предложено 6 ступеней секреции инсулина β-клетками, которые изложены в подрисуночной подписи к рис. 10-30. Рассмотрим весь процесс более детально. Секрецией инсулина в основном управляет концентрация глюкозы в крови, это означает, что прием пищи стимулирует секрецию, а при уменьшении концентрации глюкозы, например во время голодания (пост, диета), выброс тормозится. Обычно инсулин секретируется с интервалом в 15- 20 мин. Такая пульсационная секреция, по-видимому, имеет значение для эффективности инсулина и обеспечивает адекватную функцию инсулиновых рецепторов. После стимуляции секреции инсулина внутривенным введением глюкозы наблюдается двухфазный секреторный ответ. В первой фазе уже в течение минут происходит максимальный выброс инсулина, который через несколько минут опять ослабевает. Примерно через 10 мин наступает вторая фаза с сохраняющейся повышенной секрецией инсулина. Полагают, что за обе фазы отвечают различные запасающие формы инсулина. Возможно также, что ответственными за такую двухфазную секрецию являются разнообразные паракринные и ауторегуляторные механизмы островковых клеток. Механизм стимуляции секреции инсулина глюкозой или гормонами в значительной степени выяснен (рис. 10-30). Решающим является увеличение концентрации АТФ в результате окисления глюкозы, которая при возрастании концентрации глюкозы в плазме с помощью опосредованного переносчиком транспорта в увеличенном количестве поступает в β-клетки. В результате АТФ- (или от соотношения АТФ/АДФ) зависимый К+-канал ингибируется и мембрана деполяризуется. Вследствие этого открываются потенциалзависимые Са2+-каналы, экстраклеточный Са2+ устремляется внутрь и активирует процесс экзоцитоза. Пульсационное высвобождение инсулина является следствием типичного образца разрядки β -клетки «пачками». Клеточные механизмы действия инсулина очень многообразны и еще не полностью выяснены. Инсулиновый рецептор является тетрадимером и состоит из двух экстраклеточных α-субъединиц со специфическими местами связывания для инсулина и двух β-субъединиц, которые имеют трансмембранную и внутриклеточную части. Рецептор относится к семейству тирозинкиназных рецепторов и очень сходен по структуре с соматомедин-С- (IGF-1-)рецептором. β-субъединицы инсулинового рецептора с внутренней стороны клетки содержат большое число тирозинкиназных доменов, которые на первом этапе активируются с помощью аутофосфорилирования. Эти реакции являются существенными для активации следующих киназ (например фосфатидилинозитол 3-киназы), которые затем индуцируют различные процессы фосфорилирования, с помощью которых в эффекторных клетках происходит активация большинства энзимов, участвующих в обмене веществ. Кроме того, интернализация инсулина вместе со своим рецептором в клетку возможно также имеет значение для экспрессии специфических протеинов. Рис. 10-30. Механизм секреции инсулина β -клетками. Повышение уровня внеклеточной глюкозы является триггером для секреции β -клетками инсулина, который происходит в виде семи этапов. (1) Глюкоза входит в клетку через GLUT2 транспортер, работа которого опосредована облегченной диффузией глюкозы в клетку. (2) Увеличение входа глюкозы стимулирует метаболизм глюкозы в клетке и ведет к увеличению [АТФ]i или [АТФ]i / [АДФ]i. (3) Увеличение [АТФ]i или [АТФ]i / [АДФ]i ингибирует АТФ-сенситивные К+-каналы. (4) Ингибирование АТФ-сенситивных К+-каналов вызывает деполяризацию, т.е. Vm приобретает более положительные значения. (5) Деполяризация активирует потенциал-управляемые Са2+-каналы мембраны клетки. (6) Активация этих потенциал-управляемых Са2+-каналов увеличивает вход ионов Са2+ и, таким образом, увеличивает [Ca2+]i, что также вызывает Са2+-индуцированный Са2+-релиз из эндоплазматического ретикулума (ЭР). (7) Накопление [Ca2+]i ведет к экзоцитозу и выходу в кровь инсулина, содержащегося в секреторных гранулах
Ультраструктура печени Ультраструктура печени и желчевыводящих путей показана на рис. 10-31. Желчь выделяется клетками печени в желчные канальцы. Желчные канальцы, сливаясь друг с другом на периферии печеночной дольки, формируют более крупные желчные ходы - перилобулярные желчные проточки, выстланные эпителием и гепатоцитами. Перилобулярные желчные проточки впадают в междольковые желчные протоки, выстланные кубическим эпителием. Анастомозируя между собой и увеличиваясь в размерах, они образуют крупные септальные протоки, окруженные фиброзной тканью портальных трактов и сливающиеся в долевые левый и правый печеночный протоки. На нижней поверхности печени в области поперечной борозды левый и правый печеночный протоки соединяются и формируют общий печеночный проток. Последний, сливаясь с пузырным протоком, впадает в общий желчный проток, открывающийся в просвет двенадцатиперстной кишки в области большого сосочка двенадцатиперстной кишки, или фатерова соска. Рис. 10-31. Ультраструктура печени. Печень состоит из долек (диаметр 1-1,5 мм), которые на периферии снабжаются ветвями портальной вены (V.portae) и печеночной артерии (A.hepatica). Кровь из них протекает через синусоиды, которые снабжают кровью гепатоциты, и затем попадает в центральную вену. Между гепатоцитами лежат трубкообразные, закрытые сбоку с помощью плотных контактов и не имеющие собственной стенки щели, желчные капилляры или канальцы, Canaliculi biliferi. В них выделяется желчь (см. рис. 10-32), которая покидает печень через систему желчных ходов. Содержащий гепатоциты эпителий соответствует концевым отделам обычных экзокринных желез (например, слюнных желез), желчные канальцы - просвету концевого отдела, желчные протоки - выводящим протокам железы, а синусоиды - кровеносным капиллярам. Необычно же то, что синусоиды получают смесь артериальной (богатой O2) и венозной крови портальной вены (бедной O2, но богатой питательными и другими веществами, поступающими из кишечника). Клетки Купфера являются макрофагами
Состав и секреция желчи Желчь представляет собой водный раствор различных соединений, обладающий свойствами коллоидного раствора. Основными компонентами желчи являются желчные кислоты (холевая и в небольшом количестве дезоксихолевая), фосфолипиды, желчные пигменты, холестерин. В состав желчи входят также жирные кислоты, белок, бикарбонаты, натрий, калий, кальций, хлор, магний, йод, незначительное количество марганца, а также витамины, гормоны, мочевина, мочевая кислота, ряд ферментов и др. В желчном пузыре концентрация многих компонентов в 5-10 раз выше, чем в печеночной. Однако концентрация ряда компонентов, например натрия, хлора, бикарбонатов, в связи с их всасыванием в желчном пузыре значительно ниже. Альбумин, присутствующий в печеночной желчи, в пузырной вовсе не обнаруживается. Желчь образуется в гепатоцитах. В гепатоците различают два полюса: васкулярный, осуществляющий с помощью микроворсинок захват веществ извне и введение их в клетку, и билиарный, где происходит выделение веществ из клетки. Микроворсинки билиарного полюса гепатоцита образуют истоки желчных канальцев (капилляров), стенки которых образованы мембранами двух и более смежных гепатоцитов. Образование желчи начинается с секреции гепатоцитами воды, билирубина, желчных кислот, холестерина, фосфолипидов, электролитов и других компонентов. Секретирующий аппарат гепатоцита представлен лизосомами, пластинчатым комплексом, микроворсинками и желчными канальцами. Секреция осуществляется в зоне микроворсинок. Билирубин, желчные кислоты, холестерин и фосфолипиды, главным образом лецитин, выделяются в виде специфического макромолекулярного комплекса - желчной мицеллы. Соотношение этих четырех основных компонентов, достаточно постоянное в норме, обеспечивает растворимость комплекса. Кроме того, малая растворимость холестерина значительно увеличивается в присутствии солей желчных кислот и лецитина. Физиологическая роль желчи связана главным образом с процессом пищеварения. Наиболее важное значение для пищеварения имеют желчные кислоты, стимулирующие секрецию поджелудочной железы и обладающие эмульгирующим действием на жиры, что необходимо для их переваривания панкреатической липазой. Желчь нейтрализует кислое содержимое желудка, поступающее в двенадцатиперстную кишку. Белки желчи способны связывать пепсин. С желчью экскретируются и чужеродные вещества. Рис. 10-32. Секреция желчи. Гепатоциты выделяют электролиты и воду в желчные канальцы. Дополнительно гепатоциты выделяют первичные желчные соли, которые они синтезируют из холестерина, а также вторичные желчные соли и первичные желчные соли, которые они захватывают из синусоидов (кишечно-печеночная рециркуляция). Секреция желчных кислот сопровождается дополнительной секрецией воды. Билирубин, стероидные гормоны, чужеродные вещества и другие вещества связываются с глутатионом или глюкуроновой кислотой, для повышения их растворимости в воде, и в такой конъюгированной форме выделяются в желчь
Синтез желчных солей в печени Желчь печени содержит желчные соли, холестерин, фосфолипиды (прежде всего фосфатидилхолин = лецитин), стероиды, а также продукты обмена, такие как билирубин, и многие чужеродные вещества. Желчь изотонична плазме крови, а ее электролитный состав похож на электролитный состав плазмы крови. Значение рН желчи нейтральное или слегка щелочное. Желчные соли представляют собой метаболиты холестерина. Желчные соли захватываются гепатоцитами из крови портальной вены или синтезируются внутриклеточно, после конъюгации с глицином или таурином через апикальную мембрану в желчные канальцы. Желчные соли образуют мицеллы: в желчи - с холестерином и лецитином, а в просвете кишечника - прежде всего с плохо растворимыми продуктами липолиза, для которых необходимой предпосылкой реабсорбции является образование мицелл. При реабсорбции липидов желчные соли снова высвобождаются, реабсорбируются в концевых отделах подвздошной кишки и так вновь попадают в печень: желудочно-печеночный круговорот. В эпителии толстого кишечника желчные соли повышают проницаемость эпителия для воды. Секреция как желчных солей, так и других веществ сопровождается перемещениями воды по осмотическим градиентам. Секреция воды, обусловленная секрецией желчных солей и других веществ, составляет в каждом случае 40% от количества первичной желчи. Оставшиеся 20% воды приходятся на жидкости, выделяемые клетками эпителия желчного протока. Наиболее распространенные желчные соли - соли холевой, хеноде(з)оксихолевой, де(з)оксихолевой и литохолевой желчных кислот. Они захватываются клетками печени из крови синусоида с помощью переносчика NTCP (котранспорт с Na+) и переносчика OATP (независимый от Na+ перенос; OATP = O rganic A nion -T ransporting P olypeptide) и в гепатоцитах образуют конъюгат с аминокислотой, глицином или таурином (рис. 10-33). Коньюгация поляризует молекулу со стороны аминокислоты, что облегчает ее растворимость в воде, тогда как стероидный скелет липофилен, что облегчает взаимодействие с другими липидами. Таким образом конъюгированные желчные соли могут выполнять функцию детергентов (веществ обеспечивающих растворимость) для обычно плохо растворимых липидов: когда концентрация желчных солей в желчи или в просвете тонкого кишечника превышает определенную (так называюмую критическую мицеллярную) величину, они спонтанно образуют с липидами мельчайшие аггрегаты, мицеллы. Эволюция различных желчных кислот связана с необходимостью удерживать липиды в растворе в широком диапазоне значений рН: при рН = 7 - в желчи, при рН = 1-2 - в приходящем из желудка химусе и при рН = 4-5 - после того как химус смешивается с соком поджелудочной железы. Это возможно благодаря разным рКa ' -значениям отдельных желчных кислот (рис. 10-33). Рис. 10-33. Синтез желчных солей в печени. Гепатоциты, используя в качестве исходного вещества холестерин, образуют желчные соли, прежде всего хенодеоксихолат и холат. Каждая из этих (первичных) желчных солей может конъюгировать с аминокислотой, прежде всего с таурином или глицином, что снижает pKa'-значение соли с 5 до 1,5 или 3,7 соответственно. Кроме этого часть молекулы, изображенная на рисунке справа, становится гидрофильной (средняя часть рисунка). Из шести различных конъюгированных желчных солей справа показаны оба конъюгата холата с их полными формулами. Конъюгированные желчные соли частично деконъюгируются бактериями в нижнем отделе тонкого кишечника и затем дегидроксилируются у C-атома, таким образом из первичных желчных солей хенодеоксихолата и холата образуются вторичные желчные соли литохолат (не показан на рисунке) и деоксихолат, соответственно. Последние попадают в результате кишечно-печеночной рециркуляции снова в печень и вновь образуют конъюгаты, чтобы после секреции с желчью опять принимать участие в реабсорбции жиров
Кишечно-печеночный кругооборот желчных солей Для переваривания и реабсорбции 100 г жира необходимо около 20 г желчных солей. Тем не менее общее количество желчных солей в организме редко превышает 5 г, и лишь 0,5 г ежедневно синтезируются заново (холат и хенодоксихолат = первичные желчные соли). Успешная абсорбция жиров с помощью небольшого количества желчных солей возможна благодаря тому, что в подвздошной кишке 98% выделяемых с желчью желчных солей вновь реабсорбируется по механизму вторичного активного транспорта совместно с Na+(котранспорт), попадает в кровь портальной вены и возвращается в печень: кишечно-печеночная рециркуляция (рис. 10-34). В среднем данный цикл повторяется для одной молекулы желчной соли до 18 раз, прежде чем она будет потеряна с калом. При этом конъюгированные желчные соли деконъюгируются в нижнем отделе двенадцатиперстной кишки с помощью бактерий и декарбоксилируются, в случае первичных желчных солей (образование вторичных желчных солей; см. рис. 10-33). У пациентов, у которых хирургическим путем удалена подвздошная кишка или которые страдают от хронического воспаления кишечника (Morbus Crohn), большая часть желчных солей теряется с калом, поэтому нарушается переваривание и всасывание жиров. Стеаторея (жирный стул) и мальабсорбция являются последствиями таких нарушений. Интересно, что небольшой процент желчных солей, который попадает в толстый кишечник, играет важную физиологическую роль: желчные соли взаимодействуют с липидами люминальной клеточной мембраны и повышают ее проницаемость для воды. Если концентрация желчных солей в толстом кишечнике снижается, то уменьшается реабсорбция воды в толстом кишечнике и, как следствие, развивается диарея. Рис. 10-34. Кишечно-печеночная рециркуляция желчных солей. Сколько раз за день пул желчных солей циркулирует между кишечником и печенью, зависит от содержания жира в пище. При переваривании нормальной пищи пул желчных солей циркулирует между печенью и кишечником 2 раза за день, при богатой жирами пище циркуляция происходит 5 раз или еще чаще. Поэтому цифры на рисунке дают лишь приблизительное представление
Желчные пигменты Билирубин образуется в основном при расщеплении гемоглобина. После разрушения состарившихся эритроцитов макрофагами ретикулоэндотелиальной системы от гемоглобина отщепляется кольцо гема, а после разрушения кольца гемоглобин превращается сначала в биливердин и затем в билирубин. Билирубин, в силу своей гидрофобности, переносится плазмой крови в связанном с альбумином состоянии. Из плазмы крови билирубин захватывается клетками печени и связывается с внутриклеточными белками. Затем билирубин образует конъюгаты при участии фермента глюкуронилтрансферазы, превращаясь в водорастворимые моно- и диглюкурониды. Моно- и диглюкурониды с помощью переносчика (MRP2 = сМОАТ), работа которого требует затрат энергии АТФ, выделяются в желчный каналец. Если в желчи повышается содержание плохорастворимого, неконъюгированного билирубина (обычно 1-2% мицеллярного «раствора»), вне зависимости происходит ли это в результате перегрузки глюкуронилтрансферазы (гемолиз, см. ниже), или в результате повреждения печени или бактериальной деконъюгации в желчи, то образуются так называемые пигментные камни (билирубинат кальция и др.). В норме концентрация билирубина в плазме крови меньше 0,2 ммоль. Если она возрастает до значения превышающего 0,3-0,5 ммоль, то плазма крови выглядит желтой и соединительная ткань (сначала склера, а затем и кожа) окрашиваются в желтый цвет, т.е. такое повышение концентрации билирубина приводит к желтухе (иктерус). Высокая концентрация билирубина в крови может иметь несколько причин: (1) Массовая гибель эритроцитов по любым причинам, даже при нормальной функции печени повышает в плазме крови концентрацию неконъюгированного («косвенного») билирубина: гемолитическая желтуха. (2) Дефект фермента глюкуронилтрансферазы также приводит к увеличению количества неконъюгированного билирубина в плазме крови: гепатоцеллюлярная (гепатическая) желтуха. (3) Постгепатитная желтуха возникает, когда происходит закупорка желчных путей. Это может происходить как в печени (холостаз), так и за ее пределами (в результате возникновения опухоли или камня в Ductus choleodochus): механическая желтуха. Желчь скапливается выше места закупорки; она выдавливается вместе с конъюгированным билирубином из желчных канальцев через десмосомы во внеклеточное пространство, которое связано с синусом печени и, таким образом, с венами печени. Билирубин и его метаболиты реабсорбируются в кишечнике (около 15% от выделяемого количества), однако лишь после того как от них отщепляется (анаэробными бактериями кишечника) глюкуроновая кислота (рис. 10-35). Свободный билирубин превращается бактериями в уробилиноген и стеркобилиноген (оба бесцветны). Они окисляются до (окрашенных, желто-оранжевых) конечных продуктов уробилина и стеркобилина, соответственно. Небольшая часть этих веществ попадает в кровь системы кровообращения (прежде всего уробилиноген) и после клубочковой фильтрации в почке оказывается в моче, придавая ей характерный желтоватый цвет. В тоже время оставшиеся в кале конечные продукты, уробилин и стеркобилин, окрашивают его в коричневый цвет. При быстром прохождении по кишечнику неизменившийся билирубин окрашивает каловые массы в желтоватый цвет. Когда же в каловых массах, как при холостазии или закупорке желчного протока не обнаруживается ни билирубин, ни продукты его распада, то следствием этого является серый цвет кала. Рис. 10-35. Выведение билирубина. В день выводится до 230 мг билирубина, который образуется в результате расщепления гемоглобина. В плазме крови билирубин связан с альбумином. В клетках печени при участии глюкуронтрансферазы билирубин образует конъюгат с глюкуроновой кислотой. Такой конъюгированный, значительно лучше растворимый в воде билирубин выделяется в желчь и с ней попадает в толстый кишечник. Там бактерии расщепляют конъюгат и превращают свободный билирубин в уробилиноген и стеркобилиноген, из которых в результате окисления образуются уробилин и стеркобилин, придающие стулу коричневый цвет. Около 85% билирубина и его метаболитов выводится со стулом, около 15% вновь реабсорбируется (кишечно-печеночная циркуляция), 2% попадает через систему кровообращения в почки и выводится с мочой
Заключение Мы наконец завершили достаточно большую работу, в которой кроме нас принял участие ряд компетентных специалистов, фамилии и должности которых представлены в списке научных редакторов к первому и ко второму тому, и мы беспредельно признательны им за их вклад в создание Атласа. Мы также благодарны рецензентам - профессору А.А. Каменскому (заведующему кафедрой физиологии человека и животных биологического факультета ГОУ ВПО МГУ им. М.В. Ломоносова) и профессору И.Г. Козлову (заведующему кафедрой фармакологии ГОУ ВПО РГМУ) за конструктивные обоснованные предложения, особенно связанные с расширением информационного содержания отдельных глав и частыми дискуссиями по компоновке материала. При работе над Атласом мы ориентировались на лучшие зарубежные учебные издания и дополнительную научную литературу, однако чтобы сделать материал, изложенный в двух изданных книгах, унифицированным и доступным для понимания студенческой молодежью, мы представили часть известных и общепринятых рисунков в несколько упрощенной форме. Кроме того, короткий доступный текст описания механизмов, показанных на рисунках, адаптирован к знаниям студентов российских медицинских и био- логических вузов. Мы ограничили это издание двумя томами и 10 основными главами, содержание которых представлено в большинстве программ по физиологии. Заметим, что содержание второго тома определяется научными концепциями 2010 года. Мы отдаем себе отчет в позитивной тенденции развития высшего образования в России, в том числе дисциплины «Физиология», и в качестве основной цели ставим приведение программы по физиологии к международным требованиям (что, вп
|
|||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-20; просмотров: 691; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.221.221.171 (0.013 с.) |