Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
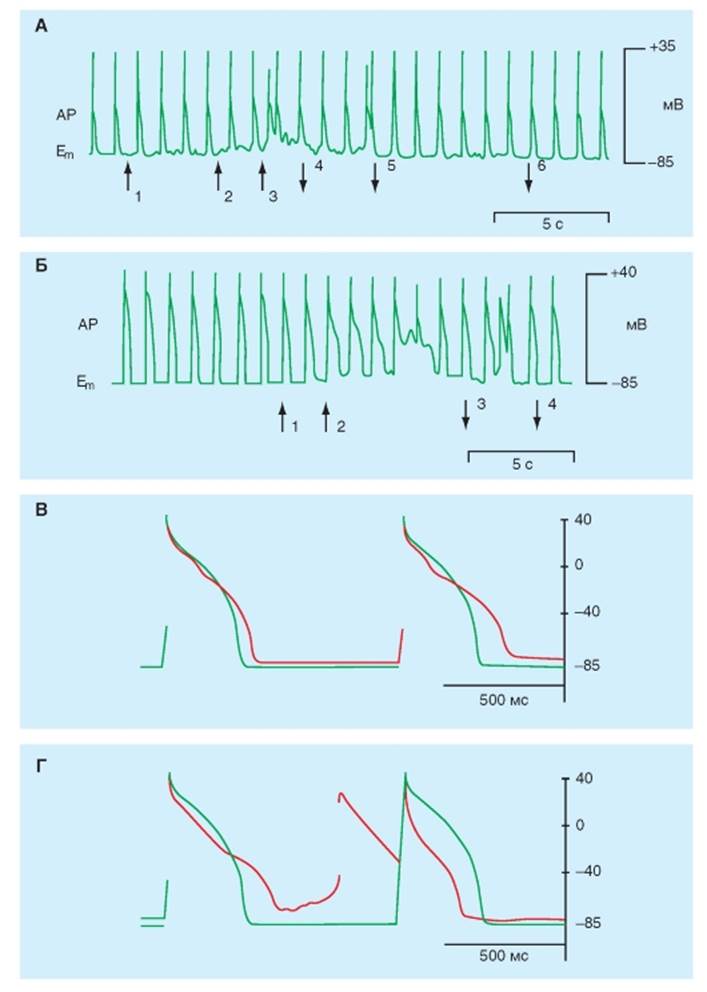
Зеленым обозначен исходный потенциал действия. Красным - ГД после растяжения тканиСодержание книги
Поиск на нашем сайте
Влияние растяжения мембраны на потенциалы покоя и действия В нормальном растворе Тироде с использованием метода patch-clamp в конфигурации wholecell изолированные вентрикулярные кардиомиоциты мыши (рис. 6-28 А) и морской свинки (рис. 6-28 Б) отвечают на их растяжение на 8-10 мкм деполяризацией мембраны клетки, увеличением длительности АР и возникновением экстра-АР. Снятие растяжения полностью возвращает регистрируемые параметры к исходному состоянию. На рисунках показан фрагмент непрерывной регистрации на самописце в режиме фиксации тока (current clamp) на клетке. При тех же экспериментальных условиях при компьютерной регистрации изолированные кардиомиоциты здорового желудочка морской свинки отвечают на растяжение изменением величины потенциала покоя и длительности потенциала действия. Растяжение на 2 мкм и 4 мкм не меняет величину потенциала покоя и форму ПД кардиомиоцитов. Растяжение на 6 мкм деполяризует покоящуюся мембрану в среднем на 3 мВ (рис. 6-28 В), а растяжение на 8 мкм деполяризует в среднем на 6 мВ (рис. 6-28 Г). Растяжение на 8 мкм удлиняют средние значения APD90 от 360 мс до 502 мс. Кроме того, растяжение на 8 мкм и, далее на 10 мкм запускает экстра-ПД, которые начинаются от диастолической деполяризации. Рис. 6-28. Растяжение изолированного кардиомиоцита левого желудочка при исследовании методом patchclamp в конфигурации whole-cell. А- влияние растяжения изолированного кардиомиоцита сердца мыши на потенциал покоя и потенциал действия. Б - влияние растяжения изолированного кардиомиоцита сердца морской свинки на потенциал покоя и потенциал действия. На обеих панелях (А) и (Б) символами ( ) показаны моменты увеличения растяжения клетки, символами ( ¯ ) - моменты возвращения к исходному растяжению. AP - потенциал действия, Em - потенциал покоя. В - кардиомиоцит желудочка морской свинки, растянутый на 4 мкм. Г - кардиомиоцит желудочка морской свинки, растянутый на 8 мкм. На обеих панелях (В) и (Г) показано изменение величины потенциала покоя, формы AP и возникновение внеочередного потенциала
Характеристика механоуправляемых токов Влияние растяжения на временной курс базового мембранного тока в реальных физиологических условиях, т.е. когда и перфузионный раствор и раствор в patch-пипетке содержит все необходимые для клетки ионы, представлено на рис. 6-29 А. Обычно такое соотношение растворов включает ионы K+ и поэтому называется Kin/Kout конфигурацией. Растяжение на 12 мкм меняет holding current от +0,15 нА (начало зеленой кривой - C на рис. 6-29 А1) до -0,65 нА (начало красной кривой - S на рис. 6-29 А1). Это свидетельствует, что растяжение индуцирует входящий ток, причем этот входящий ток равен -0,80 нА при -45 мВ. Этот ток представлен в виде дифференциальной кривой, отражающей разность между кривыми C и S (фиолетовая кривая - D на рис. 6-29 А1) и представляет собой истинный ток, текущий через МСК при растяжении кардиомиоцита. В течение ступеньки до 0 мВ растяжение смещает ток (т.е. ток, регистрируемый в конце ступеньки) от 0,30 нА (синяя кривая - С на рис. 6-29 А1) до 0,50 нА (красная кривая - S на рис. 6-29 А). Таким образом, механоиндуцированный дифференциальный ток равен +0,20 нА (рис. 6-29 А1, кривая D). Из рисунка следует, что растяжение клетки резко уменьшает ток Ca2+ через L-тип каналы (ICa-L), возникающий на фоне ступеньки до 0 мВ. Это связано с увеличением внутриклеточной концентрации ионов Ca2+ на фоне растяжения и, следовательно, снижения концентрационного градиента для ионов Ca2+. Аналогичным образом можно проанализировать рис. 6-29 А2, где смещение поддерживаемого потенциала проходило от -45 до -80 мВ. Результаты экспериментов были представлены как вольт-амперные характеристики (I-V кривые). Поскольку из внешней и внутренней среды не устранялся калий (Kin/Kout) интерпретация I-V кривых достаточно сложна и специфична. До растяжения клетки I-V кривая имела N-форму (рис. 6-29 Б1). В точке пересечения I-V кривой с осью потенциала ток равен нулю, и эта точка эквивалентна диастолическому мембранному потенциалу (V0), кото- рый обычно измеряется методом фиксации тока (примерно V0 = -80 - -85 мВ). В точке пересечения кривой с осью потенциала, т.е. при калиевом равновесном потенциале IK1 равен нулю. Поэтому отрицательный механоиндуцированный ток I (EK) может быть интерпретирован как механоиндуцированный катион-неселективный ток Ins в разное время названный как ISAC (stretch-activeted current) или IMGC (mechanically gated current). Горб на I-V кривой на уровне -60 мВ приписывается inwardly rectifying K+-current IK1. При V, более отрицательных, чем -20 мВ вклад в I-V кривую вносят ∆ GK1 и катион-неселективная ∆ G ns, определяемая работой MGCs. При V, более положительных, чем - 20 мВ механосенситивные токи переносятся ионами K+ через TRPC6 - outwardly rectifying channels и TREK1 (K2P2,1) и TREK2 (K2P10,1) - leak channels. Растяжение смещает I-V кривую вниз, уменьшает или устраняет пик IK1 и деполяризует V0. Модуляция растяжением вольт-амперной характеристики клетки приведена на рис. 6-29 Б1. До растяжения (синие треугольники, объединенные кривой), кривая имела типичную N-образную форму и пересала ось потенциала при V0 = -76 мВ, что соответствует диастолическому мембранному потенциалу в условиях типичных растворов внешней и внутренней среды. Растяжение клетки на 6 мкм смещает величину токов в более негативную область, а мембранный потенциал до -70 мВ, т.е. в более позитивную область (зеленые треугольники, объединенные кривой). Растяжение до 10 мкм смещает вольт-амперную характеристику клетки при негативных потенциалах еще в большую отрицательную область (красные кружечки, объединенные кривой) и деполяризует мембрану до -35 мВ. Значительное растяжение в 12 мкм практически устраняет N-образную форму вольт-амперной характеристики увеличивая входящий ток в негативной области и деполяризуя мембранный потенциал до -20 мВ (коричневые квадраты, объединенные кривой). Таким образом, и на клетках предсердий, и на клетках желудочков выявляется базовый мембранный IMGC, который увеличивался при увеличении степени прямого растяжения клетки (рис. 6-29 Б2) и уменьшался вплоть до полного исчезновения при снятии растяжения с клетки. Рис. 6-29. Вольтамперные характеристики механочувствительных ионных токов (К+ токи не заблокированы). А - поддерживаемый потенциал -45 мВ, стимулирующие импульсы до 0 мВ (А1) или -80 мВ (А2). Показаны записи токов, сделанные до (С) и на фоне растяжения на 12 мкм (S), и механочувствительный дифференциальный ток (D). Обратите внимание, что механочувствительный ток более отрицателен, чем ток в контроле, при потенциалах -80 и -45 мВ, однако более положителен при 0 мВ. Б1 - вольтамперная характеристика позднего тока (измеренного в конце импульса) до растяжения (пустые треугольники) и после растяжения на 6 мкм (заполненные треугольники), 10 мкм (заполненные кружочки) или 12 мкм (заполненные квадраты). Б2 - дифференциальные токи, активируемые при растяжении на 10 мкм (заполненные кружочки, Erev= 5 мВ) и 12 мкм (заполненные квадраты, Erev = 0 мВ)
Характеристика механоуправляемых токов в кардиомиоцитах сердца после инфаркта Дальнейшие исследования были посвящены разделению базового тока IMGC на компоненты. Чтобы сделать разделение базового тока на токовые компоненты у кардиомиоцитов токи через калиевые каналы были подавлены заменой К+ на Cs+ и в цитозоле, и в перфузионной камере (Csi/Cso). Это приводило, разумеется к изменению формы вольт-амперной характеристики, но полностью сохраняло реакцию МСК клетки на растяжение выделив только Ins. Кроме того, замена ионов K+ на ионы Cs+ позволила в качестве основы механоиндуцированного тока взять поздний ток (IL). Рис. 6-30 A1, A2, A3 демонстрируют модуляцию растяжением мембранных токов в течение 140 мс импульса от -45 мВ до -30 мВ, до -20 мВ и до 0 мВ. На рис. 6-30 Б сравниваются IV-кривые мембранных токов до растяжения (пустые символы) с мембранными токами на фоне растяжения (заполненные символы). Растяжение клетки уменьшает ICa-L ток (кружки). Более важно, что поздние токи, измеренные в конце 140 мс импульса (IL, отмеченные треугольниками), были выражено изменены на фоне растяжения клетки. В этих условиях растяжение кардиомиоцитов человека на 4 мкм вызывало поздний дифференциальный ток, который выражался как линейная IV-кривая и пересал V-ось координат при потенциале реверсии -16 мВ (-11±5 мВ) (рис. 6-30 В). У кардиомиоцитов желудочков крыс, морских свинок и человека ISAC во всех случаях был блокирован введением в перфузионный раствор 5 мкмоль Gd3+. На рис. 6-30 Г представлены типичные примеры изменения I-V кривой кардиомиоцита человека при его растяжении (заполненные символы) и при последующем добавлении на фоне растяжения в омывающий клетку раствор 5 мкмоль Gd3+ (пустые символы). На фоне растяжения поздние токи, измеренные в отсутствии и присутствии Gd3+ пересались при Еrev = -1±4 мВ. Линейная I-V зависимость, Еrev = -11 мВ и Gd3+ чувствительность предполагают, что ISAC - это ток, который течет через неселективные катионные механо-сенситивные каналы. Рис. 6-30. Активация растяжением Gd3+-чувствительного неселективного катионного тока при растяжении на 4 мкм кардиомиоцита левого желудочка человека после инфаркта миокарда в условиях подавленного цезием калиевого тока. А - модуляция растяжением мембранных токов на фоне ступеньки импульсного тока длительностью 140 мс от поддерживаемого потенциала -45 мВ до -30 мВ (А1), до -20 мВ (А2) и до 0 мВ (A3). Б - I-V кривые поздних токов, измеренных в конце 140 мс импульса (IL - отмечены треугольниками), и I-V кривые, характеризующие работу L-типа Ca2+ каналов (ICa-L - отмечены кружочками). I-V кривые мембранных токов до растяжения отмечены пустыми символами, а на фоне растяжения клетки на 4 мкм - заполненными символами. В - растяжение клетки индуцирует дифференциальный ток, характеризующийся линейной I-V кривой и потенциалом реверсии (Erev), равным -16 мВ. Г - механоиндуцированный поздний (треугольники) и входящий ICa-L ток (кружочки) до (заполненный) и после (пустые) добавления в перфузионный раствор 5 мкмоль гадолиния. Примечание: гадолиний, как это и должно быть, ингибирует входящий ICa-L
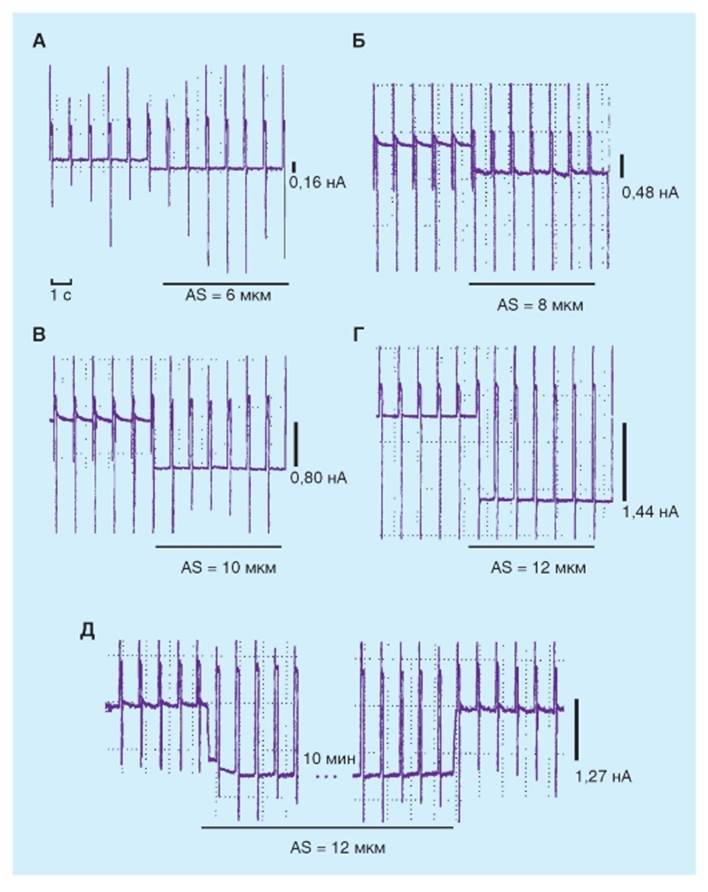
Суммарный механоуправляемый ток при различных величинах растяжения клетки У изолированных кардиомиоцитов потенциал фиксировали на уровне -45 мВ. В этих условиях увеличение степени растяжения кардиомиоцитов приводило к увеличению базового мембранного тока через МСК. На рис. 6-31 А, Б, В, Г показано, что растяжение клетки здорового сердца на 6 мкм вызывало появление входящего через МСК тока величиной 0.16 нА и дальнейшее увеличение растяжения до 8 мкм, 10 мкм, 12 мкм вызывало увеличе- ние этого тока до 0.48 нА, 0.80 нА, 1.44 нА, соответственно. Растяжение клеток здорового сердца на 2 мкм и 4 мкм не приводило к какой либо реакции со стороны МСК. (Растяжение клетки от исходного уровня до конечных значений длилось очень быстро и определялось только скоростью движения микроманипулятора). У растянутой до определенного значения клетки, ISAC был постоянным в течение нескольких минут регистрации, т.е. инактивация или адаптация не наблюдалась (рис. 6-31 Д). Отсутствие инактивации МСК в течение длительного растяжения было и у кардиомиоцитов, полученных от больных сердец. Рис. 6-31. При растяжении активируется суммарный входящий ток, который пропорционален величине растяжения и при возвращении к исходному состоянию исчезает. Запись суммарного мембранного тока, калиевые токи не блокированы. Мембранный потенциал фиксировали на уровне -45 мВ, от которого подавали стимулирующие импульсы до 0 мВ длительностью 140 мс с частотой 1 Гц. Показаны амплитуда растяжения и амплитуда активируемого растяжением входящего тока при потенциале -45 мВ. A-Г - амплитуда входящего тока увеличивается с увеличением степени растяжения. Д - при растяжении входящий ток в течение 10 мин остается постоянным (не инактивируется). После того как растяжение убирают, амплитуда тока возвращается к исходному значению. При растяжении на 2 и 4 мкм амплитуда тока не изменялась (не показано)
Зависимость механочувствительности кардиомиоцитов от возраста животного или человека и патологии сердца Как было показано выше, у изолированных кардиомиоцитов здорового сердца амплитуда ISAC увеличивалась с увеличением растяжения клеток. У клеток больных людей растяжение кардиомиоцита на 2 мкм вызывало ISAC, равный примерно -16 пА, а растяжение клетки на 4 мкм вызывало ISAC, равный -483 пА (рис. 6-32 А). Для сравнения, у кардиомиоцитов молодых и здоровых морских свинок ISAC вообще не возникал при растяжении на 2 мкм и 4 мкм. При дальнейшем увеличении степени растяжения ISAC реагировали у всех исследуемых клеток. На растяжение величиной 6 мкм клетки отвечали возникновением ISAC величиной до -300 пA, при растяжении на 8 мкм ISAC был равен около -557 пА, а при растяжении на 10 мкм ISAC был равен в среднем -1050 пA (рис. 6-32 Б). Таким образом, кардиомиоциты больных людей имеют несравнимо большую чувствительность к растяжению, чем кардиомиоциты здоровых морских свинок. Высокая чувствительность к растяжению клеток больных людей может быть объяснена за счет гипертрофии, которая возникает в течение заболевания и экспрессии SAC. Чтобы проверить связана ли чувствительность кардиомиоцитов к растяжению с вентрикулярной гипертрофией изучали эффект растяжения клеток, полученных от здоровых молодых крыс, здоровых старых крыс и также от старых спонтанно гипертензивных животных (рис. 6-32 В). У гипертензивных крыс не было симптомов сердечной недостаточности, однако их сердца были гипертрофированны. Растяжение кардиомиоцитов желудочков молодых крыс (3 мес) на 2 и 4 мкм не приводило к появлению ISAC. При дальней- шем увеличении степени растяжения клетки ISAC регистрировали у всех исследованных клеток. Так, растяжение кардиомиоцита на 8 мкм индуцирует входящий ток величиной примерно равной - 269 пА (при поддерживаемом потенциале -45 мВ). Аналогичное растяжение на 8 мкм кардиомиоцитов желудочков здоровых старых крыс (15 месяцев) вызывает значительно больший ISAC, равный около -460 пA. А растяжение кардиомиоцитов желудочков старых крыс (15 мес) со спонтанной гипертензией вызывает ISAC, среднее значение которого равно -420 пА уже при растяжении клетки на 2 мкм. У этих же животных растяжение клеток на 4 мкм вызывало ISAC, равный -1205 пА, а на 6 мкм ISAC, равный -1500 пА. Графики зависимости величины ISAC от степени растяжения у здоровых и больных крыс представлены на рис. 6-32 Г, а у человека на рис. 6-32 Д. Рис. 6-32 Г демонстрирует зависимость величины ISAC (пА) от величины растяжения клетки (мкм). Показана реакция кардиомиоцитов желудочка сердца здоровой крысы возрастом 3 мес, здоровой крысы возрастом 15 мес, гипертензивной крысы возрастом 15 мес. На рис. 6-32 Д показана зависимость величины ISAC (пА) от величины растяжения клетки (мкм). Показана реакция кардиомиоцитов желудочка сердца здорового молодого человека, и кардиомиоцитов желудочков и предсердий старого человека после инфаркта миокарда. Эти изменения являются важнейшими физиологическими данными и показывают, что чувствительность клеток к растяжению увеличивается с гипертрофией, которая развивается в течение возраста, но сильнее с гипертензией. Чувствительность к растяжению, определенная для клеток больных человеческих сердец, была сходной с величиной, полученной у кардиомиоцитов от спонтанно гипертензивных старых крыс. В целом, результаты демонстрируют, что чувствительность кардиомиоцитов к растяжению увеличивается с возрастом и крайне высока при гипертрофии сердца. Рис. 6-32. Оригинальные кривые токов, зарегистрированных до растяжения и при растяжении кардиомиоцитов. IK подавлен. А - кардиомиоциты желудочка человека после инфаркта миокарда. Б - кардиомиоциты желудочка морской свинки возрастом 3 мес. В - кардиомиоциты желудочка сердца здоровой крысы. В возрасте 3 мес (верхняя кривая), здоровая крыса в возрасте 15 мес (средняя кривая), гипертензивная крыса в возрасте 15 мес (нижняя кривая). Примечание к обозначениям: на каждой кривой растяжение клетки с указанием степени растяжения показано линией сверху. Графики зависимости величины ISAC от степени растяжения у здоровых и больных крыс представлены на панели (Г), а у человека на панели (Д)
Механоуправляемые каналы кардиомиоцитов Впервые SAC были выявлены и описаны в экспериментах с использованием метода patch-clamp в конфигурации cell-attached на культивируемых эмбриональных скелетных мышечных клетках цыпленка F. Guharay и F. Sachs (США) в 1984 году. На кардиомиоцитах желудочков SAC впервые описал в 1988 году W. Craelius (США) настоящему времени они обнаружены у кардиомиоцитов во всех отделах сердца. Вероятность открытия SAC увеличивается при приложении к фрагменту мембраны через patch-пипетку отрицательного давления. Казалось бы, что изучение одиночных каналов, реагирующих на механическое воздействие, отвечает на все вопросы, связанные с работой SAC в клетке. Однако это не так. Приложение положительного или отрицательного давления в пипетку вызывает не физиологическое растяжение мембраны, а ее деформацию в ту или иную сторону на локальном участке мембраны. Кроме того, не ясно, может ли открытие такого количества каналов (штук на диаметр пипетки) в пересчете на размер клетки, вызвать выраженную деполяризацию и возникновение AP. Хотя косвенно, используя методы математического моделирования, это возможно рассчитать. Рис. 6-33 А2 (увеличенный фрагмент регистрации) демонстрирует активацию SAC с проводимостью 21 пС при регистрации методом patch-clamp в конфигурации cell-attached от свежеизолированных вентрикулярных клеток эмбриона цыпленка. Разумеется, что речь идет не о прямом растяжении клетки, а о деформации клеточной мембраны под пипеткой отрицательным давлением -25 мм рт.ст. в пипетке. Используя метод patch-clamp в конфигурации cell-attached в 1988 году Craelius и соавт впервые зарегистрировали SAC у вентрикулярных миоцитов неонатальных крыс, которые открывались в ответ на отрицательное давление от -1 до -6 см рт.ст. (рис. 6-33 Б). Эти каналы имели проводимость 120 пС в изотоническом растворе KCl и средний реверсный потенциал 31 мВ, деполяризованный от потенциала покоя. Каналы не требовавали внешнего Са2+ для активации и были сравнительно неселективны для катионов. В дальнейших исследованиях на этой же модели и аналогичным методом деформации мембраны под пипеткой в конфигурации cell-attached приложение отрицательного давления запускало возникновение AP, которые зарегистрировали как «токи действия». Была изучена временная корреляция между возможностью открытия SAC и токами действия. На основе этих данных авторы предположили, что ток через небольшое число SAC достаточен (0,2 пС в течение 50 мс) чтобы запустить AP в кардиомиоцитах. Эти результаты свидетельствуют о том, что пассивное механическое растяжение миокарда может быть аритмогенным. Рис. 6-33. Механосенситивные ионные каналы сердца. А - активируемые растяжением ионные каналы клеток сердца. Одноканальная запись активируемого растяжением ионного канала проводимостью 21 пС в свежеизолированной клетке 17-дневного эмбриона цыпленка. Верхняя панель: токи до, во время и после приложения негативного давления величиной -25 мм рт.ст. к patch-пипетке. Канал активировался во время приложения негативного давления к пипетке и деактивировался при снятии давления. Нижняя панель: увеличение по временной шкале помеченного сегмента записи, показанной на верхней панели. Условия записи: пипеточный и омывающий растворы в ммоль, 150 NaCl, 5 KCl, 2 CaCl2, 1 MgCl2, 10 HEPES, pH 7,4 (NaOH). Поддерживаемый потенциал +60 мВ. Б - эффект suction в конфигурации cell-attached на катионселективный канал в мышце эмбриона цыпленка. Входящий ток представляет собой смещение нулевого тока вниз. (150 ммоль К+ в пипетке и обычный раствор Тироде в камере). Потенциал на пипетке +50 мВ. Б1 -0 мм рт.ст., Б2 -30 мм рт.ст., Б3 -50 мм рт.ст. подается в пипетку
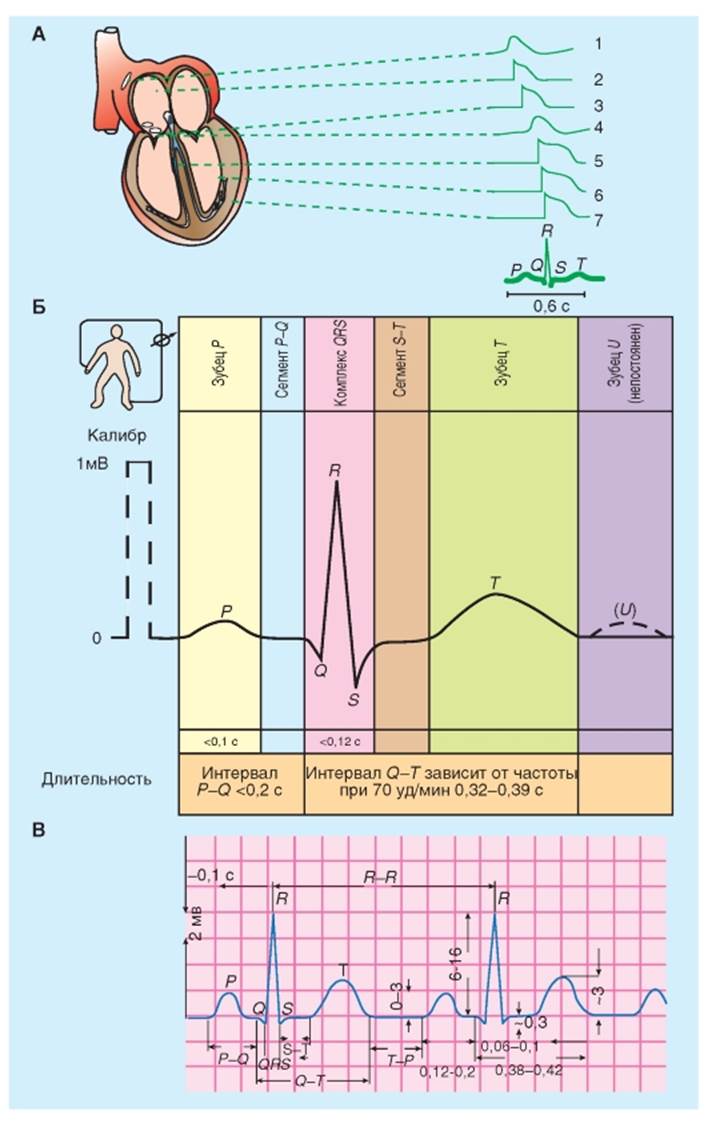
Электрокардиография Процесс возбуждения сердца сопровождается возникновением в его тканях разности потенциалов, закономерно изменяющихся по величине и направлению. Биоэлектрическая активность различных отделов сердца возникает в строго определенной последовательности (рис. 6-34 А), повторяющейся в каждом цикле возбуждения. В ходе возбуждения меняется поляризация клеточных мембран и между возбужденными и невозбужденными участками регистрируется разность потенциалов, которую можно представить как электродвижущую силу (ЭДС) сердца. Поскольку сердце окружено проводящей средой, то эту разность потенциалов можно после соответствующего усиления зарегистрировать и с поверхности тела. При этом получается характерная кривая, состоящая из нескольких зубцов, разделенных определенными интервалами. Эта кривая получила название электрокардиограммы - ЭКГ. Зубцы ЭКГ обозначаются латинскими буквами - P, Q, R, S, T (зубцы перечислены в порядке их появления), а соответствующие интервалы: P-Q, S-T, T-P. На рис. 6-34 Б, В показана их длительность и амплитуда. В общих чертах кривая ЭКГ состоит из волн: P, QRS, и T (рис. 6-34 Б, В). Интервал P-Q - это промежуток времени от начала активации предсердий до начала активации желудочков, он обычно колеблется в пределах от 0,12 до 0,20 с. Значительная часть этого времени включает прохождение импульса через AV -узел (Патологическое удлинение интервала P-Q связано с нарушениями проведения через AV -узел, которое может быть вызвано воспалительными процессами, патологией сосудов, фармакологическими веществами или влиянием нервной системы). Конфигурация и амплитуда QRS комплекса варьирует в значительной мере у разных индивидуумов. Продолжительность обычно составляет 0,06-0,10 с. Аномально удлиненный QRS комплекс может указывать на блокаду в проводящей системе желудочков (типа блокады правой или левой ножек пучка). В течение ST-сегмента весь миокард желудочков деполяризован. Поэтому, ST-сегмент обычно находится на изоэлектрической линии. (Любое заметное отклонение ST-сегмента от изоэлектрической линии может указывать на ишемическое повреждение миокарда). Интервал Q-T иногда рассматривается как период «электрической систолы» желудочков; интервал Q-T тесно коррелирует со средней продолжительностью потенциала действия кардиомиоцитов желудочков. Интервал Q-T имеет продолжительность около 0.4 сунд, и он изменяется обратно пропорционально частоте сердечных сокращений главным образом потому, что продолжительность потенциала действия кардиомиоцитов изменяется пропорционально частоте сердечных сокращений. В большинстве отведений, T-волна отклоняется в том же самом направлении от изоэлектрической линии, как и большинство компонентов QRS комплекса, хотя бифазные или направленные в противоположную сторону T-волны являются совершенно нормальным явлением в некоторых отведениях. Отклонение в одном направлении от изоэлектрической линии T-волны и QRS комплекса указывает на то, что процесс реполяризации развивается в противоположном направлении. (T-волны, которые являются атипичными по направлению или по амплитуде, могут указывать на повреждение миокарда, нарушения электролитного баланса или на гипертрофию сердца). ЭКГ позволяет сделать заключение о пути распространения волны возбуждения в сердце, регистрируя изменения электрического потенциала от различных участков поверхности тела. Анализируя детали этих флуктуаций электрического потенциала, можно получить важные сведения об: (1) анатомической ориентации сердца; (2) относительных размерах камер; (3) различных нарушениях ритма и проведения; (4) степени, местоположении и прогрессе ишемического повреждения миокарда; (5) эффектах измененных концентраций электролита; и (6) влиянии определенных препаратов (особенно наперстянки, антиаритмических средств, и антагонистов Ca2+-каналов). Рис. 6-34. Электрокардиография. А - потенциалы действия, характерные для основных частей сердца, и их соответствие во времени фазам электрокардиограммы (ЭКГ): 1 - синусный узел, 2 - правое предсердие, 3 - атриовентрикулярный узел, 4 - пучок Гиса, 5 - ножки пучка Гиса, 6 - конечные волокна Пуркинье, 7 - сократительный миокард левого желудочка. Б - образец электрокардиограммы человека во II стандартном отведении. В - амплитудно-временные характеристики зубцов, сегментов и интервалов нормальной электрокардиограммы
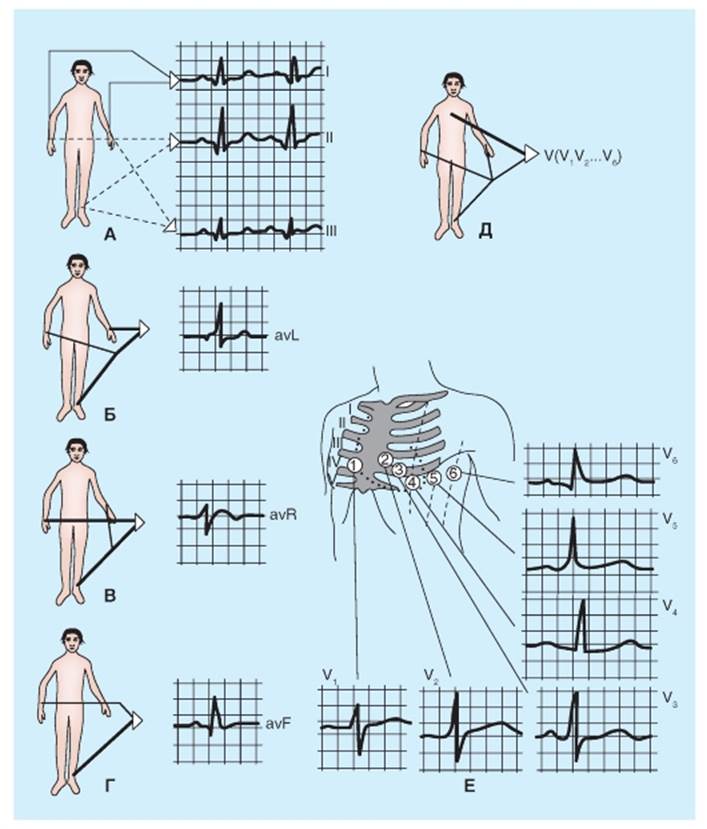
Стандартные и грудные отведения ЭКГ Отведение в электрокардиографии - это электрическое соединение кожной поверхности пациента с регистрирующим устройством (электрокардиографом). Контакты от пациента связаны с гальванометром (устройством, измеряющим силу электрического тока), который находится в электрокардиографе. Точки отведений, используемые для записи обычных ЭКГ, располагаются в определенных плоскостях тела. Следует подчеркнуть, что ЭКГ отражает именно процесс возбуждения в сердце, а не сокращения его структур. Эти два процесса в известной мере разделены во времени, так как второй является следствием первого. При определенных экспериментальных условиях (например, при перфузии сердца бескальциевым раствором) сократительный акт можно устранить, однако при этом продолжает регистрироваться нормальная ЭКГ, отражающая процесс распространения возбуждения. Амплитуда и направленность зубцов ЭКГ зависят от ряда факторов, таких как расстояние электродов от сердца, степени электропроводности ткани между электродами и сердцем, а также величиной вектора ЭДС и соотношение с осью отведений. (Ось отведения - воображаемая линия между электродами, расположенными на кожной поверхности конечностей и соединенными с прибором для регистрации). Поэтому, для того чтобы можно было сравнивать ЭКГ между собой, необходимо стандартизировать методы их регистрации. С этой целью отводящие электроды накладываются на строго определенные участки тела - в зависимости от этого говорят о том или ином способе отведения. Основными способами являются отведения от конечностей, или стандартные отведения, усиленные отведения и однополюсные отведения от грудной клетки. Стандартные отведения приняты как обязательный метод, так как они регистрируют колебания потенциалов во фронтальной плоскости от больших поверхностей сердца. Определенные международные соглашения диктуют способ, которым эти стандартные отведения от конечностей связаны с гальванометром электрокардиографа (рис. 6-35 А). Отведение I регистрирует разность потенциалов между левой (LA) и правой (RA) руками. Соединения гальванометра устроены таким образом, что когда потенциал в LA (VLA) превышает потенциал в RA (VRA), пищик гальванометра отклоняется вверх от изоэлектрической линии. На рис. 6-35 А и Б, это расположение соединений гальванометра для отведения I обозначено (+) в LA и (-) в RA. Отведение II регистрирует разность потенциалов между RA и LL (левая нога), и пищик отклоняется вверх, когда VLL превышает VRA. Наконец, отведение III регистрирует разность потенциалов между LA и LL, и пищик отклоняется вверх, когда VLL превышает VRA. Эти соединения гальванометра были произвольно выбраны так, чтобы QRS-комплексы были направлены вверх во всех трех стандартных отведениях от конечностей у большинства нормальных индивидуумов. В дополнение к стандартным отведениям от конечностей: I, II, и III. проводят регистрацию также и от грудных отведений, чтобы определить проекции вектора сердца на сагиттальных и поперечных плоскостях тела. Эти грудные отведения регистрируют от шести выбранных точек на передней и латеральной поверхностях груди около сердца. Рис. 6-35. Расположение электродов на поверхности тела для записи стандартных (I, II и III) электрокардиографических отведений по Эйнтховену (А) и грудных отведений (V1-V6) по Вильсону (Б)
Основные виды электрокардиографических отведений Регистрация временных изменений разности потенциалов между двумя точками на поверхности кожи называется скалярной ЭКГ. Скалярная ЭКГ обнаруживает временные изменения электрического потенциала между некоторыми точками на поверхности кожи и индифферентным электродом или между парами точек на поверхности кожи. Сердечный импульс распространяется в виде сложной трехмерной волны возбуждения. Следовательно, точная конфигурация ЭКГ изменяется от индивидуума к индивидууму, и у любого отдельно взятого индивидуума, картина меняется в зависимости от анатомического местоположения отведения. Графическое изображение электрической активности, зарегистрированной методом ЭКГ, называется кривой ЭКГ. Разность потенциалов правой и левой руки обозначается как I отведение, разность потенциалов правой руки и левой ноги - как II отведение, разность потенциалов левой руки и левой ноги - как III отведение ЭКГ (рис. 6-36). При грудных отведениях (рис. 6-36) один из электродов накладывают на определенную точку грудной клетки, а второй электрод представляет объединенный электрод от конечностей, поскольку электроды от правой, левой рук и от левой нижней конечности соединяют в приборе через сопротивление. В результате этого регистрируется разность потенциалов между активным электродом, расположенным на грудной клетке, и объединенным «нулевым» электродом от конечностей. Электрод, расположенный на грудной клетке, является активным (так называемым дифферентным электродом). В связи с тем что активный электрод располагается в непосредственной близости от сердца, колебания потенциала под ним значительно превышают колебания потенциала под вторым, удаленным сердца электродом (так называемым индифферентным электродом). Колебания потенциала, возникающие под индифферентным электродом, условно считают близкими к нулю. При этом форма ЭКГ в основном определяется локализацией активного электрода, расположенного на грудной клетке. Даже незначительные смещения этого электрода существенно изменяют форму ЭКГ в связи с тем, что при этом происходит дифференцированная регистрация колебаний потенциалов от локальных участков миокарда, расположенных непосредственно под данным электродом. Используют шесть позиций грудных электродов: V1 - четвертое межреберье справа от грудины, V2 - четвертое межреберье слева от грудины, V3 - на равном расстоянии от левого края грудины и среднеключичной линии, на линии, соединяющей положение 2-й и 4-й позиций, V4 - пятое межреберье по средней ключичной линии, V5 - пятое межреберье по левой передней подмышечной линии, V6 - пятое межреберье. V1 и V2 отражают активность правого желудочка, V5 и V6 - активность левого желудочка, причем самых близких к электроду участков сердца. В клинике и в физиологических экспериментах помимо указанных выше отведений используется целый ряд других способов регистрации ЭКГ: униполярные отведения от конечностей и грудной клетки, пищеводные отведения (активный электрод локализуется в пищеводе в области расположения тех или иных отделов сердца), внутриполостные отведения (в качестве активного электрода служит электрод-катетер, который вводится через яремную вену в полость сердца) и др. Амплитуда и длительность зубцов, а также величина интервалов ЭКГ закономерно меняются при различных физических и физиологических воздействиях на сердце - при физической нагрузке, изменении положения тела и др. Эти изменения могут быть обусловлены, с одной стороны, чисто физическими явлениями, например изменением положения сердца в грудной клетке при дыхании, при перемене позы, изменением электропроводности тканей между сердцем и отводящими электродами при дыхании. С другой стороны, они могут быть обусловлены и физиологическими причинами: изменением венозного притока, рефлекторными влияниями на работу сердца и на скорость проведения в нем. Таким образом, при нормальном функционировании сердца форма ЭКГ может варьировать в определенных пределах. В связи с этим непременным условием правильного толкования ЭКГ при различных видах сердечной патологии является умение распознавать нормальную электрокардиографическую кривую во всех ее разновидностях. Рис. 6-36. Основные виды электрокардиографических отведений. А - стандартные двухполюсные отведения от конечностей: I, II, III - первое, второе и третье стандартные отведения; Б, В, Г - однополюсные отведения от конечностей avL, avR, avF. Д - однополюсные грудные V1-V6. Е - точки наложения электродов на грудную клетку при грудных отведениях
Принцип формирования электрокардиограммы Хотя первые попытки создания теории, объясняющей механизм формирования ЭКГ, были предприняты практически одновременно со становлением самого метода, законченной теории формирования ЭКГ нет до настоящего времени. Трудности, возникающие при создании теории генеза ЭКГ, связаны с тем, что такая теория должна объяснить связь ЭКГ с элементарными формами биоэлектрической активности всех структур сердца. При этом следует учитывать, что сердце представляет собой электрический генератор сложного строения, состоящий из огромного числа клеток - элементарных генераторов. Последовательность моментов включения этих генераторов, их число и пространственное расположение, а следовательно и структура суммарного генератора сердца непрерывно меняются. На ЭКГ эти сложные изменения предстают в обобщенном и упрощенном виде. При проекции ЭДС сердца на поверхность тела, где обычно в клинике располагают отводящие электроды, возникают дополнительные искажения, которые во многом зависят от электрической неоднородности окружающей сердце среды. Дополнительные трудности возникают также в связи с тем, что отводящие электроды регистрируют активность участков, расположенных как непосредственно под электродом, так и вдали от него. Количественные соотношения ЭДС прилежащих и удаленных участков неизвестны для любого положения отводящего электрода. Все названные выше факторы не поддаются количественной оценке и затрудняют создание полного представления о механизме генерации ЭКГ. Тем не менее основные моменты формирования ЭКГ могут быть объяснены в рамках существующих в настоящее время теорий, гипотез, моделей. Одной из основных теорий, на основе которой в настоящее время ведется векторный анализ ЭКГ и строят математические модели генераторов сердца, является дипольная теория. Дипольная теория и ее различные модификации исходят из представлений о том, что граница между возбужденными и невозбужденными участками миокарда представляет собой линию, вдоль которой как бы выстроен двойной слой электрических зарядов - диполей. На протяжении сердечного цикла двойной слой непрерывно перемещается, изменяет свою конфигурацию и в некоторые моменты может состоять из нескольких фрагментов (рис. 6-37 А). Совокупность этих диполей можно представить в виде одного суммарного дип
|
||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-20; просмотров: 399; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.229.217 (0.015 с.) |