Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
A - нормальный синусный ритм. Б - синусовая тахикардия. В - синусовая брадикардияСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
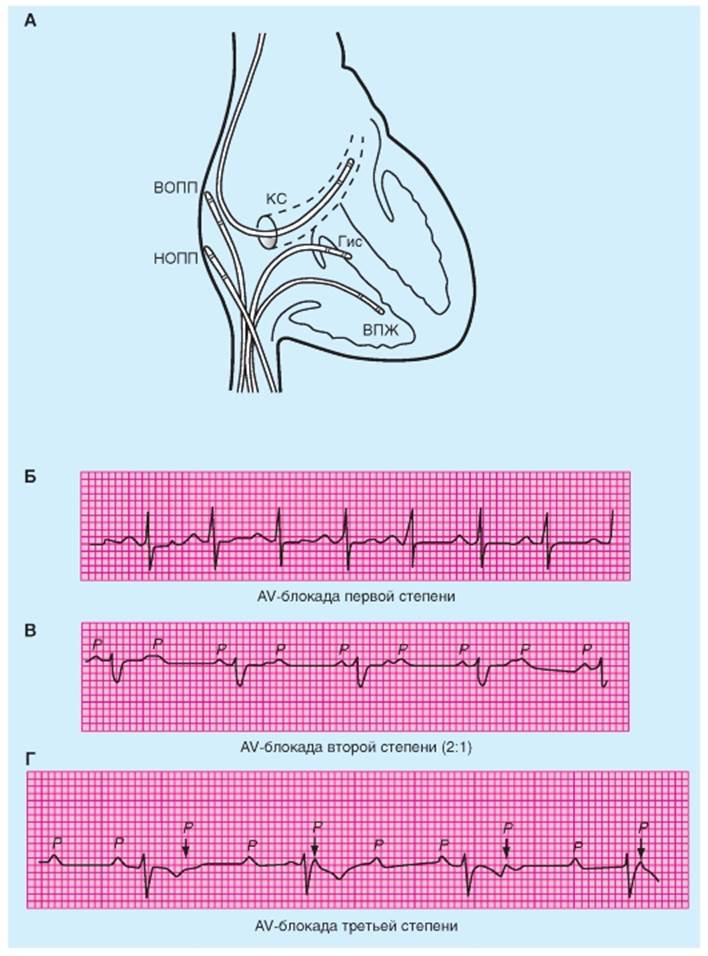
Нарушение атриовентрикулярной проводимости Атриовентрикулярные блокады проведения Различные физиологические, фармакологические воздействия и патологические процессы могут препятствовать распространению импульса через проводящую ткань AV-узла. Место блокады может быть локализовано более точно при регистрации электрограммы пучка Гиса. Чтобы получить такие записи, электродный зонд вводится в периферическую вену и перемещается к центру до тех пор, пока электрод не ляжет в области AV-узла (рис. 6-41 А). Когда электрод должным образом установлен, регистрируется хорошо различимое отклонение при прохождении сердечного импульса через пучок Гиса. Промежуток времени, требуемый для распространения возбуждения от предсердия до пучка Гиса (A-H интервал) и от пучка Гиса к желудочкам (H-V интервал), может быть точно измерен. Патологическое удлинение первого или последнего упомянутого интервалов указывает на блокаду выше или ниже пучка Гиса соответственно. По электрокардиограмме различают три степени AV-блокады, как это показано на рис. 6-41 Б, В и Г. AV-блокада первой степени характеризуется длительным интервалом P-Q(R). На рис. 6-41 Б интервал P-Q(R) составляет 0.28 сунды; а интервал больше чем 0,20 с является отклонением от нормы. В большинстве случаев блокады первой степени, интервал A-H удлинен а интервал H-V нормальный. Следовательно, задержка при AV-блокаде первой степени расположена выше пучка Гиса (т.е. в AV-узле). В AV-блокаде второй степени, всем QRS-комп- лексам предшествуют P-волны, но не все P-волны сопровождаются QRS-комплексами. Отношение P-волн к QRS-комплексам обычно выражается отношением двух малых целых чисел (например: 2:l, 3:l или 3:2). Рис. 6-41 В иллюстрирует типичную блокаду 2:l. Место блокады может быть расположено выше или ниже пучка Гиса. В тех случаях, когда место блокады ниже пучка Гиса это последствия бывают более серьезные, чем в тех случаях, когда место блокады расположено выше пучка Гиса, потому что в первом случае развивается блокада третьей степени. Когда место блока расположено ниже пучка Гиса, то часто имплантируют электрокардиостимулятор. AV-блокада третьей степени часто именуется как полная блокада сердца, потому что импульс полностью не способен преодолеть AV-путь проведения от предсердий к желудочкам. Чаще всего область полной блокады располагается дистальнее пучка Гиса. При полной блокаде сердца, предсердные и желудочковые ритмы полностью независимы, как показано на рис. 6-41 Г. Из-за медленного желудочкового ритма (в данном случае 32 уд/мин), кровоснабжение оказывается недостаточным, особенно при мышечной нагрузке. Блокада третьей степени часто сопровождается обмороком (резко выраженным головокружением), причиной которого в большинстве случаев является недостаточный мозговой кровоток. Блокада третьей степени - одно из наиболее часто встречаемых состояний, которые требуют применения искусственных водителей ритма. Рис. 6-41. Атриовентрикулярные (AV) блокады. А - схематическое представление положения катетеров-электродов при внутрисердечных регистрациях электрограмм. ВОПП и НОПП - верхний и нижний отдел правого предсердия, Гис - пучок Гиса, ВПЖ - верхушка правого желудочка, КС - коронарный синус. Б - блокада первой степени. P-R интервал составляет 0,28 с. B - блокада второй степени (2:1). Г - блокада третьей степени, обратите внимание на расхождение между P-волнами и QRS-комплексами
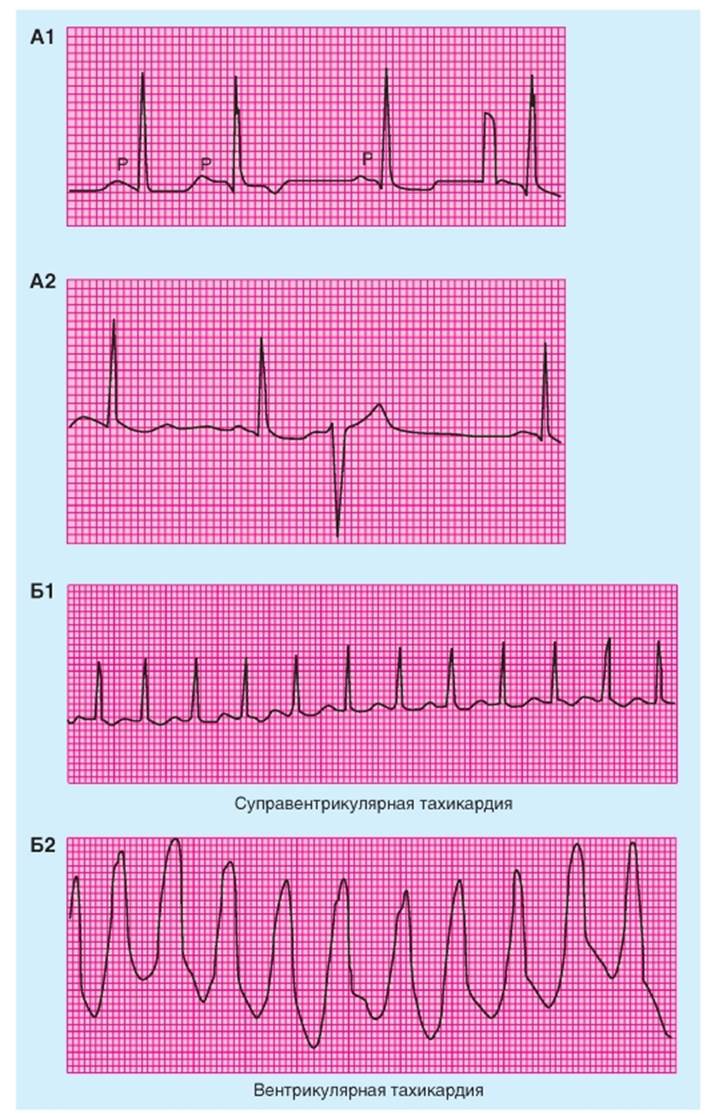
Внеочередные сокращения сердца Экстрасистолы Внеочередные деполяризации (экстрасистолы) возникают иногда у здоровых людей, но чаще всего они бывают при определенных патологических состояниях. Их источниками могут быть предсердия, AV-узел или желудочки. Внеочередная предсердная деполяризация показана на рис. 6-42 A1. На этой записи нормальный интервал между сокращениями составляет 0,89 с (частота сердечных сокращений - 68 уд/мин). Внеочередная предсердная деполяризация (вторая P-волна на рисунке) следует за предшествующей P-волной всего через 0,56 с. Конфигурация внеочередной P-волны отличается от конфигурации другой, нормальной P-волны, потому что ход предсердного возбуждения, которое возникает в некотором эктопическом фокусе предсердия, отличается от нормального распространения возбуждения, которое возникает в SA-узле. Конфигурация комплекса QRS при внеочередной предсердной деполяризации обычно бывает нормальной, потому что возбуждение в желудочке распространяется по обычным проводящим путям. Внеочередная желудочковая деполяризация представлена на рис. 6-42 А2. Распространение импульса происходит аномально, и конфигурации QRS и T-волны полностью отличаются от таковых на нормальной электрокардиограмме, потому что внеочередное возбуждение возникает в некотором эктопическом фокусе в желудочках. Внеочередной QRS-комплекс следует за предшествующим нормальным QRS-комплексом всего через 0,47 с. Интервал после экстрасистолы составляет 1,28 с, что значительно длиннее нормального интервала между ударами (0,89 с). Интервал (1,75 с) от QRS-комплекса сразу перед экстрасистолой до QRS-комплекса сразу после него фактически равен длительности двух нормальных сердечных циклов (0,89 + 0,89 = 1,78 с). Длительный интервал, который обычно следует за внеочередной желудочковой деполяризацией, называется компенсаторной паузой. Эта пауза происходит, потому что эктопический желудочковый импульс не нарушает естественного ритма SA-узла, так как эктопический желудочковый импульс не проводится ретроградно через AV-узел. Импульс SA-узла, возникший сразу до или после желудоч- ковой экстрасистолы, обычно не оказывает влияние на желудочек, потому что AV-узел и, возможно, также желудочки являются все еще рефрактерными из-за внеочередного возбуждения. На рис. 6-42 А2 P-волна, связанная с экстрасистолой, совпадает с T-волной внеочередной желудочковой деполяризации, и, следовательно, ее не так-то легко идентифицировать на записи. Эктопические тахикардии В отличие от постепенных изменений в частоте, которые служат отличительным признаком синусовой тахикардии, тахикардии, которые происходят из эктопического центра, обычно начинаются и кончаются резко. Поэтому такие эктопические тахикардии обычно называют пароксизмальными тахикардиями. Приступы пароксизмальной тахикардии могут продолжаться всего лишь в течение нескольких сокращений или в течение многих часов и дней, причем приступы часто повторяются. Пароксизмальные тахикардии могут быть следствием: (1) высокочастотных разрядов из эктопического водителя ритма, (2) вторичной пусковой активности, обусловленной потенциалами последействия достигших порога, или (3) циркуляции возбуждающего импульса по петле реентри. Пароксизмальные тахикардии, которые возникают в предсердиях или в тканях AV-узла (рис. 6-42 Б1) обычно неразличимы и поэтому обе обозначаются термином пароксизмальная суправентрикулярная тахикардия. При этой форме тахикардии, импульс часто ходит по кругу (реентри), который включает в себя предсердную и AV-узловую ткань. QRS-комплексы часто бывают нормальными, потому что возбуждение желудочков происходит по традиционному проводящему пути. Как следует из самого названия, желудочковая пароксизмальная тахикардия возникает в эктопическом фокусе желудочков. В этих случаях ЭКГ характеризуется частыми, измененными QRS-ком- плексами, которые отражают аномальное внутрижелудочковое проведение импульса (рис. 6-42 Б2). Желудочковая пароксизмальная тахикардия гораздо более грозное нарушение ритма, чем суправентрикулярная тахикардия, потому что первая часто является предшественником желудочковой фибрилляции, смертельной аритмии, описываемой в следующем разделе. Рис. 6-42. Экстрасистолы и пароксизмальные тахикардии. А - внеочередные деполяризации. Внеочередная предсердная деполяризация (A1) и внеочередная желудочковая деполяризация (А2). Ранняя предсердная деполяризация (второе сокращение на верхней записи) характеризуется инвертированной P-волной и нормальными QRS- и T-волнами. Интервал после внеочередной деполяризации ненамного длиннее обычного интервала между ударами сердца. Короткое прямоугольное отклонение перед последней деполяризацией - калибровочный сигнал. Внеочередная желудочковая деполяризация характеризуется измененными комплексом QRS- и T-волнами и сопровождается компенсаторной паузой. Б - пароксизмальные тахикардии. Суправентрикулярная тахикардия (Б1) и вентрикулярная тахикардия (Б2)
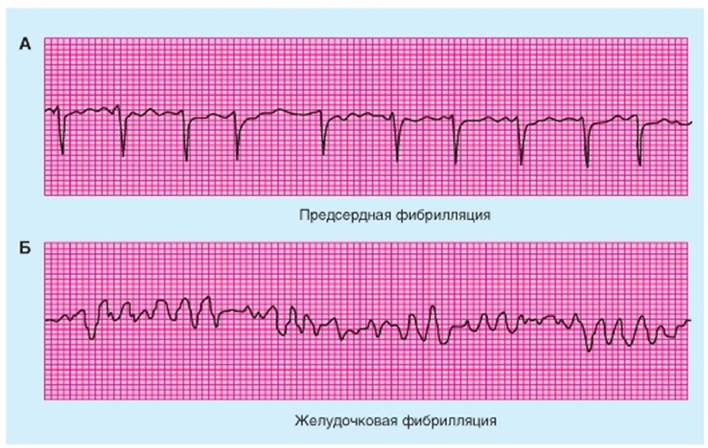
Фибрилляция предсердий и желудочков Фибрилляция При некоторых условиях сердечная мышца начинает сокращаться некоординировано и полностью не эффективно для выброса крови. Такая аритмия называется фибрилляцией, и это нарушение может затрагивать или предсердия или желудочки. Фибрилляция, вероятно, представляет собой явление циркуляции возбуждения, при котором реентри фрагментируется во множественные, беспорядочные цепи. Изменения в ЭКГ при предсердной фибрилляции показаны на рис. 6-43 А. Эта аритмия происходит при различных типах хронических заболеваний сердца. Предсердия не сокращаются и не расслабляются последовательно в течение каждого сердечного цикла, и, таким образом, они не способствуют наполнению желудочков. Вместо этого предсердия совершают непрерывные, некоординированные пульсирующие сокращения. P волны не появляются на ЭКГ; они заменены непрерывными неправильными колебаниями потенциала, которые называются f-волнами. AV-узел активируется с интервалами времени, которые могут значительно изменяться от цикла к циклу. Следовательно, отсутствует постоянный интервал между последовательными QRS-комплексами или между последовательными желудочковыми сокращениями. Так как сила желудочкового сокращения зависит от интервала времени между сокращениями, то объем и периодичность ритма становятся нерегулярными. У многих больных предсердный цикл реентри и проведение импульса через AV-узел являются более регулярными, чем при предсердной фибрилляции. Поэтому этот ритм получил название «трепетание предсердий». Предсердная фибрилляция и трепетание не опасны для жизни некоторые люди с этими расстройствами могут даже полноценно трудиться. Желудочковая фибрилляция, наоборот, ведет к потере сознания в течение нескольких сунд. Постоянные, беспорядочные, несогласованные сокращения желудочковых мышечных волокон не способны перекачивать кровь. Если не произведена немедленная, действенная реанимация и если не произошло спонтанного восстановления ритма, что происходит редко, то наступает смерть. Желудочковая фибрилляция может развиться, когда весь желудочек, или некоторая часть его, лишена нормального кровоснабжения. Она может также возникнуть в результате электрического удара или в ответ на действие некоторых лекарств и анестезирующих средств. На ЭКГ (рис. 6-43 Б) при этом регистрируются нерегулярные колебания потенциала. Желудочковая фибрилляция часто инициируется, когда внеочередной импульс приходит во время так называемого уязвимого периода сердечного цикла, который совпадает с нисходящей волной зубца T на ЭКГ. В течение этого периода возбудимость клеток сердца разная в разных его участках. Некоторые волокна все еще находятся в эффективном рефрактерном периоде, другие почти полностью восстановили свою возбудимость и они по-прежнему способны проводить импульсы, но только с очень медленными скоростями проведения. Следовательно, потенциалы действия распространяются в виде множества нерегулярных волн возбуждения, которые перемещаются по обходным путям с различными скоростями проведения. Когда кардиомиоциты определенной области становится снова возбудимыми, то в конечном счете какая-нибудь перемещающаяся волна возбуждения начинает циркулировать по кругу. Следовательно, процесс является самоподдерживающимся. Предсердная фибрилляция может быть изменена на нормальный синусный ритм препаратами, которые продлевают рефрактерный период. Тогда, по мере того как импульс сердца завершает цикл реентри, он поступает к волокнам миокарда, которые еще не возбудимы. При желудочковой фибрилляции необходимо иное воздействие. Преобразование патологического ритма в нормальный синусовый ритм осуществляется посредством применения сильного электрического тока, который на короткое время приводит все клетки миокарда в рефрактерное состояние. Были разработаны приемы безопасного воздействия током через интактную грудную клетку. В успешных случаях, SA-узел снова берет на себя функцию нормального нейсмейкера для всего сердца. Когда действие препаратов не приводит к удовлетворительным результатам при предсердной дефибрилляции, то для коррекции этого состояния также может быть использована электрическая дефибрилляция. Рис. 6-43. Фибрилляция. Предсердная фибрилляция (А) и желудочковая фибрилляция (Б)
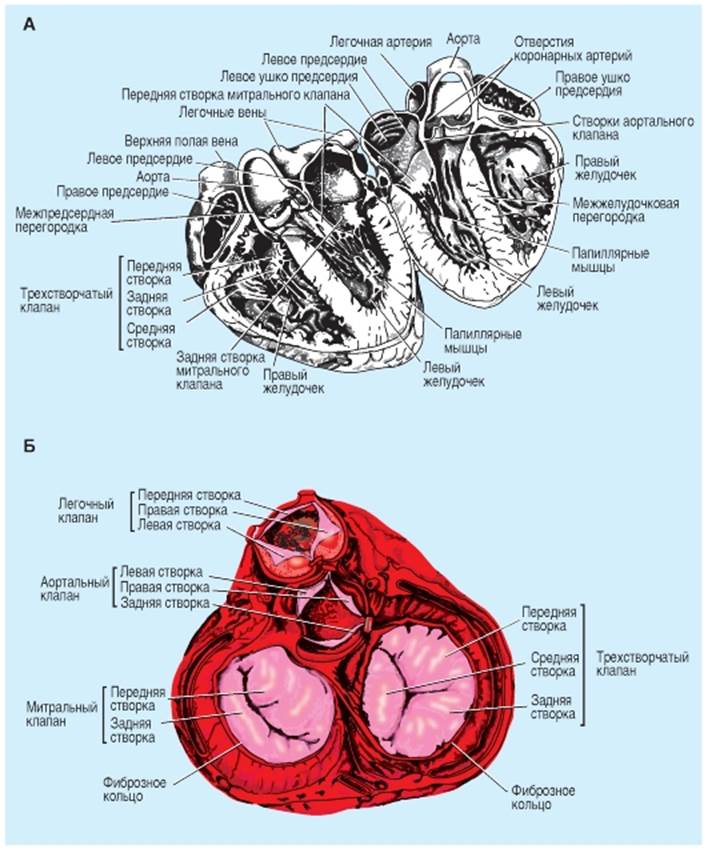
Клапанный аппарат сердца Сердечные клапаны. Клапаны сердца состоят из тонких листков гибкой, упругой, покрытой эндотелием фиброзной ткани (створки клапанов), которые прочно прикреплены к основанию фиброзных колец клапанов. Движения створок клапанов в значительной степени пассивны, и расположение сердечных клапанов отвечает за одностороннее направление кровотока через сердце. Различают два вида сердечных клапанов: атриовентрикулярные (предсердно-желудочковые) и полулунные клапаны (рис. 6-44). Атриовентрикулярные клапаны. AV-клапан, расположенный между правым предсердием и правым желудочком, сформирован тремя створками (трехстворчатый клапан), тогда как клапан, расположенный между левым предсердием и левым желудочком, имеет две створки (митральный клапан). Общая площадь створок каждого AV-кла- пана примерно вдвое больше соответствующего AV-отверстия, так что в закрытом положении имеет место значительное взаимное перекрывание створок клапана (рис. 6-44). К свободным кромкам этих клапанов прикреплены тонкие, сильные связки (сухожильные нити), которые отходят от мощных папиллярных мышц соответствующих желудочков и не позволяют клапанам выворачиваться наружу во время сокращения желудочков. В нормальном сердце во время наполнения желудочков створки клапана располагаются относительно близко друг к другу и, таким образом, служат воронкой для перехода крови из предсердия в желудочек. Частичное сближение поверхностей клапана во время диастолы вызывается вихревыми потоками позади створок, а также некоторым напряжением свободных кромок клапанов. Это напряжение вызывают сухожильные нити и папиллярные мышцы, растянутые наполняющимся желудочком. Полулунные клапаны. Полулунные клапаны расположены между правым желудочком и легочной артерией и между левым желудочком и аортой. Они представлены тремя чашеобразными створками, прикрепленными к клапанному кольцу (рис. 6-44). В конце фазы медленного изгнания систолы желудочков кровоток быстро меняет направление в сторону желудочков. Этот обратный ток крови сближает створки вместе, закрывая отверстие и препятствуя забрасыванию крови в желудочки. Во время систолы желудочков створки не примыкают плотно к стенкам легочной артерии и аорты, а плавают в кровотоке, находясь примерно посередине между стенками сосуда и положением, когда клапан находится в закрытом состоянии. Позади полулунных клапанов находятся маленькие закрытые участки легочной артерии и аорты (пазухи Вальсальвы), где создаются вихревые потоки, удерживающие створки клапана на расстоянии от стенок сосуда. К тому же отверстия правой и левой коронарных артерий расположены позади соответственно правой и левой створок аортального клапана. Если бы не пазухи Вальсальвы и не вихревые потоки, образующиеся в них, коронарные отверстия могли бы быть блокированы створками клапана. Рис. 6-44. Схема перпендикулярного разреза сердца вдоль межжелудочковой перегородки, иллюстрирующая анатомическую взаимосвязь створок атриовентрикулярных и аортальных клапанов (А). Четыре сердечных клапана. Вид от основания сердца (Б). Обратите внимание, как створки закрытых клапанов перекрывают друг друга
Ультразвуковое исследование клапанного аппарата сердца Движения створок митрального клапана в течение сердечного цикла показаны на эхокардиограмме (рис. 6-45). Принцип эхокардиограммы заключается в том, что на человека воздействуют короткими высокочастотными сигналами звукового диапазона (ультразвук), которые проходят сквозь ткани грудной клетки и сердца и при этом регистрируют отраженный от различных органов сигнал, т.е. эхо. Применительно к сердцу, как органу, этот метод называется эхокардиограммой. Время отражения и вид отраженных волн дают информацию о диаметре сердца, толщине стенок желудочка, величине и направлении движения различных структур сердца. На рис. 6-45 эхокардиограмма расположена так, чтобы показать движение передней створ- ки митрального клапана. Движения задней створки представляют собой зеркальное отражение движений передней створки, но в проекции, представленной на рис. 6-45, ее движения кажутся гораздо меньшими. В точке D митральный клапан открывается, и во время быстрого наполнения (от точки D до точки Е) передняя створка движется по направлению к межжелудочковой перегородке. В течение фазы медленного наполнения (от Е до F) створки клапанов движутся навстречу друг другу, но клапан не закрывается. Наполнение желудочка вследствие сокращения предсердия (от F до А) раздвигает створки; затем наступает второе сближение створок клапана (от А до С). В точке С клапан закрыт сокращением желудочка. Створки клапана, выгнутые в направлении предсердия, остаются сжатыми вместе в течение систолы желудочка (от С до D). Рис. 6-45. Принцип эхокардиографии. Датчик испускает и улавливает ультразвуковые сигналы, т.е. работает по принципу эха. Стрелками отмечен момент захлопывания митрального клапана в начале систолы. ПЖ - правый желудочек, МЖС - межжелудочковая стенка, ЛЖ - левый желудочек, ПМК и ЗМК - передний и задний митральные клапаны соответственно
Закон сердца Старлинга К внутриклеточным механизмам регуляции силы сокращений относится механизм Франка- Старлинга, называемый также закон сердца Старлинга. Закон Франка-Старлинга указывает на зависимость силы сердечных сокращений от степени растяжения мышечных волокон в диастолу. Зависимость «сила-длина» впервые обнаружил Франк. На рис. 6-46 показана схема эксперимента, из которой видно, что увеличение растяжения волокон изолированного сердца в диастолу приводит к усилению сердечных сокращений. Окончательную формулировку этого эффекта дал Э. Старлинг «чем больше конечно-диастолический объем желудочка, тем больше величина систолического выброса». Механизм Франка-Старлинга является идеальным средством для поддержания соответствия сердечного выброса венозному возврату. Физиологическая сущность этого эффекта заключается в обеспечении согласованности величины притока крови и сердечного выброса. Причем соответствие достигается не только при любом изменении притока крови к предсердиям, т.е. при изменении преднагрузки, но также и в результате изменения ритма сердца, например, при брадикардии. Впоследствии заметили, что увеличение объема желудочков связано с увеличением длины каждого мышечного волокна миокарда, образующего камеры желудочков. Был сделан вывод, что увеличение длины волокон влияет на работу сердца, главным образом, за счет изменения количества взаимодействующих перекрещивающихся соединений миофиламентов. Позднее показали, что основной механизм, с помощью которого осуществляется влияние на сердечную деятельность, заключается в изменении чувствительности сердечных миофиламентов к Ca2+ в связи с растяжением миокарда желудочков. Существует оптимальная длина мышечных волокон. Чрезмерно высокие значения наполняющего давления, когда мышечные волокна миокарда растягиваются слишком сильно, скорее понижают, чем увеличивают насосную мощность желудочков. Старлинг также показал, что препараты изолированного сердца способны приспосабливаться к изменениям силы, противодействующей выбросу крови из желудочков во время систолы. При сокращении левого желудочка выброс крови в аорту не производится, пока желудочек не разовьет давление, которое будет выше давления в аорте. Давление в аорте во время желудочкого выброса в основном и составляет постнагрузку левого желудочка. В экспериментах, проведенных Старлингом, артериальное давление контролировалось с помощью гидравлического устройства, находившегося в трубке, которая соединяла восходящую часть аорты с резервуаром крови, соединенным с правым предсердием. Постоянный объем венозного возврата в правое предсердие поддерживался на постоянном уровне путем поддержания гидростатического уровня крови в резервуаре. Когда Старлинг повышал артериальное давление до нового постоянного уровня, левый желудочек сначала реагировал на увеличившуюся постнагрузку, уменьшением систолического объема. Так как поддерживался постоянный объем венозного возврата, то уменьшение систолического объема сопровождалось увеличением диастолического объема желудочка и удлинением мышечных волокон миокарда. Это изменение конечно-диастолической длины волокон в результате давало возможность желудочку прокачивать нормальный систолический объем при большем периферическом сопротивлении. Хотя изменение количества циклических поперечных связей (cross-bridges) между толстыми и тонкими филаментами, возможно, способствует адаптации сердечной мышцы к изменившимся условиям, основным фактором здесь является изменение чувствительности сократительных белков к кальцию, вызванное растяжением миокарда. Механизм Франка-Старлинга является идеальным средством для поддержания соответствия сердечного выброса венозному возврату. Любой внезапный, слишком большой выброс из одного желудочка вызывает увеличение венозного возврата к другому желудочку. Последующее увеличение длины мышечных волокон в диастолу увеличивает выброс из второго желудочка для соответствия выбросу, сделанному первым желудочком. Так механизм Франка-Старлинга позволяет поддерживать точное равновесие между выбросами из правого и левого желудочков. Так как два последовательно расположенных желудочка являются частью замкнутой цепи, то любое, пусть маленькое, но продолжительное нарушение равновесия между выбросами из обоих желудочков имело бы катастрофические последствия. Рис. 6-46. Внутрисердечные механизмы регуляции работы сердца. Закон сердца Старлинга - первый принцип внутриклеточного механизма регуляции работы сердечной мышцы. А - сердце на канюле Штраубе. Б - подсоединенное к механоэлектрическому преобразователю сердце на канюле Штраубе. В - увеличение амплитуды сократительной активности сердца в ответ на увеличение к нему притока раствора. Стрелками обозначено увеличение притока и возвращение его к норме
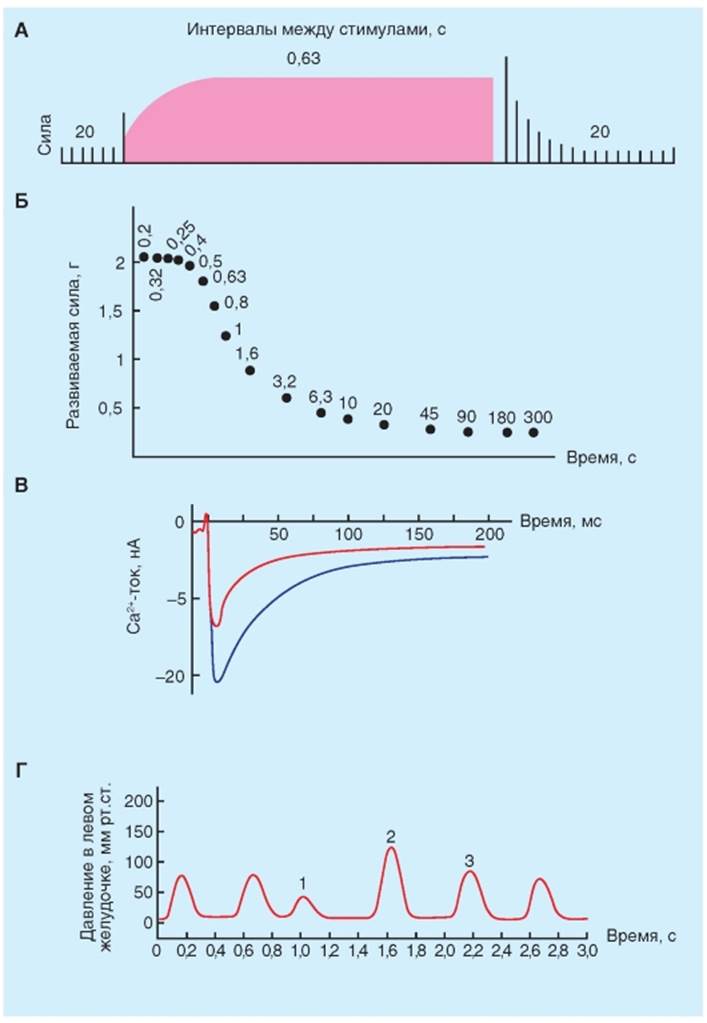
Ритмоинотропная регуляция Ритмоинотропная зависимость - это зависимость силы сокращений от частоты сокращений, которая рассматривается как внутриклеточный механизм регуляции работы сердечной мышцы. Работа миокарда также регулируется путем изменения частоты, при которой миокардиальные волокна сокращаются. Влияние изменений частоты сокращений на силу, развиваемую при изометрическом сокращении папиллярной мышцы кошки, показано на рис. 6-47 А, Б. Сначала сокращение полоски сердечной мышцы вызывали стимуляцией 1 раз через каждые 20 с (рис. 6-47 А). Когда интервал между стимуляцией (а следовательно и сокращениями) внезапно сократили до 0,63 с, развиваемая сила прогрессивно возрастала на протяжении нескольких следующих сокращений. Когда установилось новое стабильное состояние, то новое значение силы более чем в 5 раз превышало ее предыдущее значение, достигнутое при более редких сокращениях. Возврат к большему интервалу между сокращениями (20 с) произвел обратный эффект на развиваемую силу. Эффект широкого диапазона интервалов между сокращениями на достигнутые постоянные значения развиваемой силы показан на рис. 6-47 Б. При уменьшении интервала между сокращениями с 300 до 20 с развиваемая сила сокращений изменялась незначительно. При дальнейшем укорочении интервала до 0,5 с развиваемая сила сокращений резко возрастала. Дальнейшее уменьшение паузы между сокращениями до 0,2 с производило уже незначительный дополнительный эффект на развиваемую силу сокращений. Прогрессирующее увеличение силы вначале, когда интервал между сокращениями резко уменьшается (например, с 20 до 0,63 с на рис. 6-47 Б), вызвано постепенным увеличением концентрации внутриклеточного Са2+. Увеличению концентрации внутриклеточного Са2+способствуют два механизма: (1) увеличение числа деполяризаций в минуту и (2) увеличение входящего Са2+-тока за одну деполяризацию. Действие первого механизма заключается в следующем: Са2+ входит в клетку миокарда в период плато каждого потенциала действия. Когда интервал между сокращениями уменьшается, количество фаз плато в минуту возрастает. Второй механизм действует следующим образом: когда интервал между сердечными сокращениями резко уменьшается, входящий Са2+- ток (ICa) прогрессивно увеличивается с каждым последующим сокращением до тех пор, пока не будет достигнут новый устойчивый максимум силы при новой длительности между стимулами, вызывающими сокращение. На рис. 6-47 В показано, что в изолированной мышечной клетке желудочка, подвергнутой повторяющимся деполяризациям, вход Са2+ в кардиомиоцит возрастал с каждым последующим сокращением. Например, максимальный уровень ICa был значительно выше во время седьмой деполяризации, чем во время первой. Кроме того, скорость его инактивации во время седьмой деполяризации происходила значительно медленнее, чем во время первой. Обе из этих характеристик ICa приведут к большему входу Са2+ в кардиомиоцит во время седьмой деполяризации, чем при первой деполяризации. Больший вход Са2+, естественно, увеличивает силу сокращений. Кратковременное изменение интервалов между сокращениями также сильно влияет на силу сокращений. Когда левый желудочек сокращается раньше времени (рис. 6-47 Г, сокращение 1), такое внеочередное сокращение (экстрасистола) само по себе является слабым, тогда как сокращение (2) (следующее сокращение после экстрасистолы) после компенсаторной паузы является очень сильным. Эта реакция частично зависит от механизма Франка-Старлинга. Неадекватное наполнение желудочка непосредственно перед внеочередным сокращением частично является причиной его слабости. Следовательно, увеличенное наполнение, связанное с компенсаторной паузой, частично объясняет значительную силу постэкстрасистолического сокращения. Хотя объем левого желудочка оставался постоянным на протяжении всего наблюдения, внеочередное сокращение (1) было слабым, а постэкстрасистолическое сокращение (2) было сильнее обычного. Это усиление сокращения у следующего за экстрасистолой сокращения служит примером постэкстрасистолической потенциации и может проявляться на протяжении одного и более последующих сокращений (например, в сокращении 3). Рис. 6-47. Внутрисердечные механизмы регуляции работы сердца. Ритмо-инотропная зависимость - второй принцип внутриклеточного механизма регуляции работы сердечной мышцы. А - изменения силы, развиваемой изолированной папиллярной мышцей кошки при изменении интервала между сокращениями с 20 до 0,63 с и затем обратно до 20 с. Б - на графике точки обозначают устойчивые значения силы, развиваемой той же папиллярной мышцей во время указанных интервалов между сокращениями (в секундах). В - ток кальция, вызванный в кардиомиоците морской свинки во время первой и седьмой деполяризации в последовательной серии деполяризаций. Г - на изоволюмическом препарате левого желудочка сердца собаки внеочередная систола желудочка (сокращение 1) обычно слабая, тогда как постэкстрасистолическое сокращение (сокращение 2) обычно сильное. Увеличившаяся сократимость может уменьшаться на протяжении нескольких последующих сокращений (например, сокращение 3)
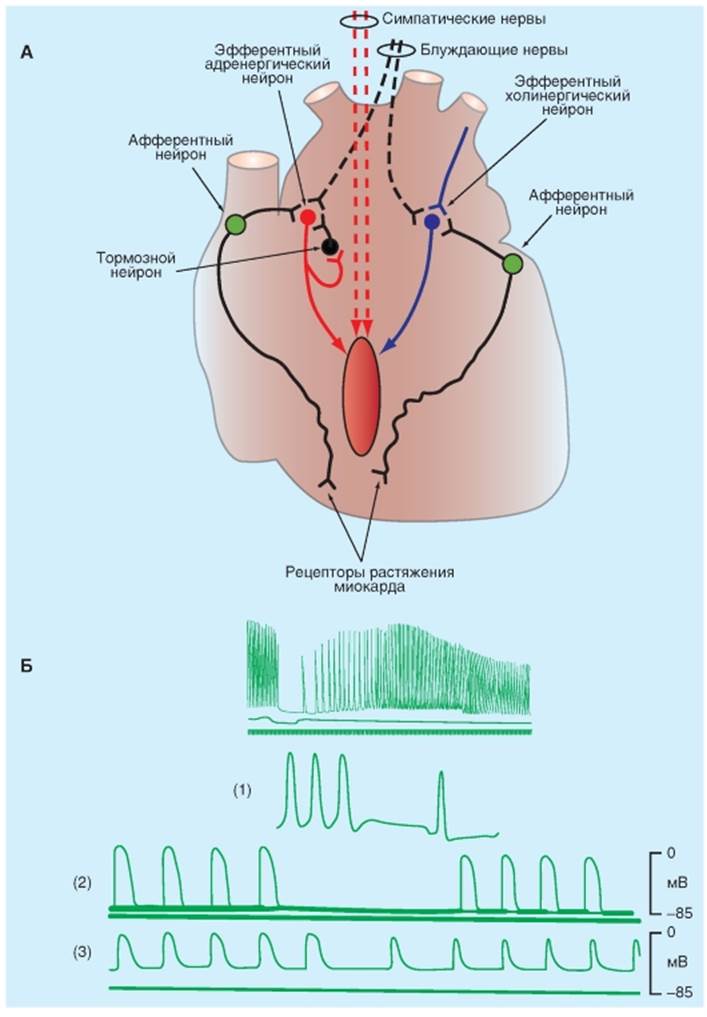
Внутрисердечная нервная система Сердце способно к автоматическому контролю своей деятельности. Автоматический контроль осуществляется как за счет миогенных механизмов (закон Франка-Старлинга и ритмоинотропная зависимость), так и за счет нейрогенных с участием внутрисердечной нервной системы. Внутрисердечная нервная система - это совокупность нервных сплетений и ганглиозных клеточных структур, расположенных в тканях сердца. Ганглиозно-синаптические структуры внутрисердечной нервной системы участвуют в процессах саморегуляции сердца как периферический нервный аппарат, в котором происходит замыкание местных внутрисердечных рефлекторных дуг (рис. 6-48 А). Внутрисердечная нервная система включает афферентные нейроны, дендриты которых образуют рецепторы растяжения на миокардиальных волокнах и коронарных сосудах, вставочные нейроны и эфферентные нейроны. Их аксоны иннервируют кардиомиоциты и коронарные сосуды. Все эти нейроны соединены между собой синаптическими связями. На изолированных сердцах холоднокровных (М.Г. Удельнов с сотр.) и теплокровных (Г.И. Косицкий с сотр.) животных в 60-х годах ХХ века было доказано участие внутрисердечной нервной системы в рефлекторной регуляции силы сердечных сокращений, ритма, возбудимости, проводимости, расслаблении миокарда и регуляции тонуса коронарных сосудов. Существенным является факт разнонаправленных рефлекторных реакций при раздражении одних и тех же рецепторов в зависимости от исходного состояния деятельности рабочей камеры. В настоящее время в интрамуральных ганглиях сердца доказано наличие не только холинергических нейронов, но и нервных клеток, выделяющих дофамин, норадреналин и некоторые пептиды. На нейронах, расположенных в ганглиях сердца, обнаружены М-, Н-холинорецепторы и адренорецепторы. Ганглии в основном сгруппированы в предсердиях, меньшее их количество обнаружено в желудочках. На нейроны ВСНС конвергируют волокна парасимпатической, симпатической и интракардиальной нервной системы. Было показано, что экстракардиальные входы внутрисердечных нейронов составляют всего лишь 25%. Чувствительных клеток приблизительно в 5 раз больше, чем двигательных клеток. Путем избирательной блокады, фармакологического анализа было показано, что каждый ганглий иннервирует только определенную структуру сердца и соответственно регулирует какой-то параметр деятельности: ЧСС, проводимость, силу сокращений. В естественных условиях ВСНС не является автономной, а подчиняется вышележащим регулирующим системам. Однако ее функционирование показывает возможность приспособительных реакций уже на уровне самого органа. После экстракардиальной денервации (например, при трансплантации сердца) именно внутрисердечные рефлексы совместно с миогенными механизмами обеспечивают приспособление работы сердца к изменяющимся гемодинамическим потребностям организма. В интактном организме экстракардиальные и внутрисердечные механизмы регуляции функционируют как единый регуляторный аппарат. Особенностью внутрисердечной нервной системы лягушки является наличие двух внутрисердечных нервных стволов, идущих по межпредсердной перегородке от ганглиозных структур венозного синуса к атриовентрикулярной воронке и к желудочку. В состав этих стволов входят афферентные волокна рецепторов желудочка, постганглионарные нервные волокна симпатической нервной системы, преганглионарные и постганглионарные нервные волокна парасимпатической нервной системы. Афферентные волокна могут направляться в ЦНС или принадлежать ганглиям вегетативной и внутрисердечной нервной системы. В последнем случае возможно замыкание внутрисердечного рефлекса. Рис. 6-48. Внутрисердечные механизмы регуляции работы сердца. Внутрисердечная нервная система. А - принципиальная схема организации внутрисердечной нервной системы по Г.И. Косицкому. Б - внутрисердечные рефлекторные эффекты, вызванные стимуляцией центрального конца внутрисердечного нерва межпредсердной перегородки сердца лягушки. Верхняя запись - механограмма сердца: хронотропные и инотропные эффекты. Нижние кривые - изменения потенциалов действия в пейсмейкере (1), предсердии (2) и желудочке (3) соответственно
Влияние ацетилхолина на работу сердца Показано, что во внутрисердечной нервной системе определенную роль играют холинергические нейроны, поэтому рассмотрим влияние ацетилхолина на сердце. В передаче нервных воздействий со стороны вегетативной нервной системы на эффекторные органы участвуют ацетилхолин (парасимпатическая система). Для изучения действия ацетилхолина на механическую работу сердца лягушки пользуются препаратом изолированного на канюле Штраубе (рис. 6-49 А, Б). Верхушка сердца через серфин или лигатуру соединяется со штырем механоэлектрического преобразователя. На рис. 6-49 В показан контрольный период, во время которого записывают работу желудочка сердца при нахождении в нем постоянно сменяемого физиологического раствора. Стрелка показывает момент смены физиологического раствора на раствор, содержащий 10-6 г/мл ацетилхолина. На рис. 6-49 Г показан контрольный период, во время которого записывают работу желудочка сердца при нахождении в нем постоянно сменяемого физиологического раствора. Первая стрелка показывает момент смены физиологического раствора на раствор, содержащий 10-7 г/мл ацетилхолина, а вторая стрелка показывает момент смены физиологического раствора на раствор, содержащий 10-8 г/мл ацетилхолина, Действие ацетилхолина выражается в снижении амплитуды и частоты сердечных биений. При избытке ацетилхолина может наступить остановка сердца в диастоле. Влияние блуждающего нерва на миокард желудочков осуществляется с помощью, по крайней мере, двух механизмов. Действие одного механизма заключается в том, что ацетилхолин, высвобожденный нервными окончаниями блуждающего нерва, получает возможность взаимодействовать с мускариновыми рецепторами мембраны кардиомиоцитов синусного узла. Это взаимодействие вызывает угнетение аденилатциклазы. Последующее уменьшение внутриклеточной концентрации циклического АМФ приводит к уменьшению Са2+ проводимости клеточной мембраны и, таким образом, приводит к уменьшению сократительной способности миокарда. Во время действия другого механизма ацетилхолин (ACh), освобождаемый нервными окончаниями блуждающего нерва, может также угнетать освобождение норадреналина соседними окончаниями нервных волокон симпатической нервной системы (см. рис. 6-55). Эксперименты показывают, что стимуляция симпатических нервов сердца вызывает значительное увеличение поступления норадреналина в кровь коронарного синуса. Сопутствующая стимул
|
||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-20; просмотров: 991; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.141 (0.015 с.) |