Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Из: Hunter T. Cooperation between oncogenes. Cell, 64: 249, 1991Содержание книги
Поиск на нашем сайте
Регуляторный ген (р53), предотвращающий излишнюю пролиферацию клеток, служит супрессивным геном для опухолевых клеток. Характерно, что активация супрессорных генов происходит в два этапа. В ядре клетки существует по две копии любого гена. Супрессивные гены обладают так называемым "доминирующим" действием, когда для супрессии пролиферации клеток достаточно лишь одной полной копии гена. Теория супрессорных генов согласуется с теорией наследственной предрасположенности к возникновению рака. Инактивация одной из двух аллелей может быть фенотипически "немой" (т. е. не происходит развития злокачественного фенотипа), если достаточно одной (второй) аллели для сохранения незлокачественного фенотипа клеток. Но у таких людей особенно высок риск развития рака, т. к. при одной лишь мутации супрессорных генов клетки трансформируются в раковые. В таблице 10-2 приведены наиболее важные гены тканевой супрессии (TSGs). Образование запретных клонов. Большинство генетических исследований подтверждают, что опухоль развивается из одной клетки. Принятая в настоящее время теория многоступенчатого канцерогенеза гласит, что эпителий желудочно-кишечного тракта подвергается воздействию вредных факторов окружающей среды. Вследствие этого происходит постепенное повреждение ДНК с накоплением генетических мутаций. При этом мутации обычно возникают в участках ДНК, ответственных за выживаемость и рост клетки. Многие из них способны ингибировать процессы, необходимые для жизнедеятельности клетки, и тем самым привести ее к гибели. Некоторые мутации могут усиливать рост и выживаемость мутированных клеток, позволяя им размножаться быстрее, чем окружающие их клетки. В конце концов мутированные клетки начинают составлять большую часть органа или ткани. Часть мутированных клеток теряет способность исправлять повреждения ДНК, и, следовательно, из поколения в поколение происходит накопление мутаций. Этот пул клеток также подвержен дополнительным мутациям. Периодически отдельные клетки мутантного клона подвергаются дополнительной мутации, повышающей их выживаемость и способность к росту. Такие клетки постепенно вытесняют из популяции родительские клетки. Увеличение клона мутированных клеток обычно происходит при появлении новых мутаций, которые увеличивают выживаемость клетки. При наблюдении за развитием опухоли на ранней стадии в клетках выявляется определенное количество мутаций, число которых возрастает с течением времени. На Рис. 10-1 показана прогрессия опухоли на фоне появления клонов с новыми характеристиками.
Таблица 10-2. примеры генов, подавляющих рост опухоли У человека
Многоступенчатый канцерогенез. Концепция генетической основы развития рака толстой кишки была разработана Vogelstein с соавторами. Согласно этой концепции процесс протекает медленно, и в него вовлечено множество генов. Количество генетических повреждений опухолей постепенно увеличивается по мере роста. Часть повреждений появляется только на ранних стадиях, часть — только на поздних. Еще до конца не ясна последовательность появления опреде-
Рис. 10-1. Опухолевый рост. На данной схеме представлена типичная последовательность канцерогенеза. На первой стадии показано действие канцерогена. После накопления критической массы мутировапных генов (единой точки зрения на их количество и локализацию нет) клетка превращается в опухолевую. На второй стадии происходит разрастание клона мутировавших клеток с формированием доброкачественной опухоли. Без каких-либо дополнительных воздействий доброкачественная опухоль способна сохранять свою доброкачественность. Но при дополнительном воздействии она трансформируется в злокачественную и приобретает способность к инвазивному росту и метастазированию (стадия 3). Не существует единой точки зрения на природу этого воздействия. Злокачественная опухоль склонна к инвазивному росту с повреждением органов хозяина. Генотип злокачественных клеток очень нестабилен, поэтому их клон оказывается гетерогенным (стадии 4 и 5). Клинически такая гетерогенность приводит к формированию отдаленных метастазов. (Но: Yamada Т., Alpers D. H., Owyang С., Роwell D. W., Silverstein F. E., cds. Textbook of Gastroenterology, 2nded. Philadelphia: J. B. Lippincott, 1995:586.)
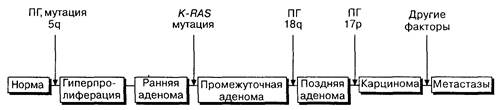
Рис. 10-2. Схема последовательных генетических изменений в многоступенчатом канцерогенезе при раке толстой кишки с дополнениями по Fearon, Vogelstcin. Сверху над схемой показаны мутации, ведущие к потере гетерозиготности (П1), лежащие в основе развития колоректального рака
ленных повреждений в опухолевых клетках, но уже выяснено, что при различных типах рака возможны разные мутации и хромосомные делеции. Для выявления потери участков хромосом используются лабораторные методы, а процесс утраты генетической информации был назван "потерей гетерозиготности". В ходе своего развития опухолевая клетка кишечника человека претерпевает определенные изменения (рис. 10-2). Гипометилирование ДНК происходит на ранних стадиях возникновения канцерогенеза в аденомах. В клетках небольших аденом могут происходить как мутации, так и выпадения участков хромосом, например изменения на 5q хромосоме при аденоматозном полипозе кишки. Обнаруживаемые в крупных аденоматозных полипах мутации генов K-RASvip53 играют заметную роль в поддержании опухолевого роста. Делеции генов супрессоров опухолевого роста на 18q (встречается при раке толстой кишки) и 17р (локус гена р53) происходят на поздних стадиях и означают малигнизацию процесса. Несмотря на наличие сходства канцерогенеза в толстой кишке и в других отделах желудочно-кишечного тракта, последовательность изменений, а также вовлеченные в процесс гены различны. Детали этих процессов только начинают исследоваться. Механизмы, замедляющие опухолевую прогрессию. В происхождении опухолей толстой кишки, помимо выпадения супрессорных генов, задействованы и другие механизмы генетических изменений. Микросателлиты — участки ДНК, используемые для картирования генов хромосом. Обычно микросателлиты полностью копируются при репликации клеток, но в некоторых опухолевых клетках отмечается незначительное изменение их длины. Микросателлиты в геноме могут иметь до 103 копий. Было замечено, что в некоторых случаях рака толстой кишки эти микросателлиты копируются не полностью. Наличие "нестабильных" микросателлитов в геноме опухолевых клеток говорит об утрате ими способности адекватно копировать гены. Такое нарушение процессов исправления мутаций считается еще одним механизмом канцерогенеза. Примерная схема этого механизма приведена на Рис. 10-3.
Развитие опухоли
Потеря контроля над процессом пролиферации. В норме процесс регуляции пролиферации осуществляется в каждой эпителиальной клетке ЖКТ. При восстановлении эпителия после перенесенной травмы или воспаления эта регуляция ослабевает, и скорость пролиферации увеличивается. После того, как количество вновь образующихся клеток сравнивается с количеством отмирающих, скорость пролиферации снижается.
Рис. 10-3. Альтернативный генетический механизм был предложен для многоэтапного канцерогенеза в толстой кишке. Все колоректальные раки накапливают мутации в АРС, K.-RAS-2, р53 локусах с нарушением функции генных продуктов. Вверху показана ситуация, когда нестабильность генома приводит к множественной ПГ. При опухолях в проксимальной части толстой кишки и при врожденном неполипозном раке толстой кишки ПГ наблюдается редко. У таких больных происходят множественные мутации ДНК, приводящие к нарушению продуктов данного гена. (По: Fearon E. R., Vogelstein В. A genetic model for colorectal tumorgenesis. Cell, 61:759,1990; Aaltonen L. A., Peltomaki P., Leach F. S., et al. Clues to the pathogenesis of familial colorectal cancer. Science 260:812,1993; Thibodeau S. N., Bren G., Schaid D. Microsatellite instability in the cancer of the proximal colon. Science, 260: 816, 1993; lonovY., Peinado M. A., Malkhosyan S., et al. Ubiquitous somatic mutations in simple repeated sequences reveal a new mechanism for colonic carcinogenesis. Nature, 363:558, 1993.)
Установлено, что потеря контроля над процессом пролиферации является ранней стадией канцерогенеза в толстой кишке. Это заключение было сделано на основании того, что у больных с высоким риском развития рака толстой кишки пул пролиферирующих клеток занимает все пространство от основания до верхушки крипт (в норме — только в основании крипт). Но нарушение регуляции пролиферации само по себе не может привести к развитию рака. Для этого необходимы дополнительные, пока неидентифицированные, генетические изменения, вызывающие нарушение клеточной дифференцировки, процессов старения и слущивания клеток. В состав аденомы входят гиперпролиферирующие, незрелые клетки, которые, не имея инвазивной способности, располагаются на слизистой оболочке кишки, образуя полип. Эту стадию развития проходят все опухоли толстой кишки, но она не характерна для опухолей пищевода, желудка и поджелудочной железы. Рост доброкачественных опухолей. Небольшие аденоматозные полипы встречаются очень часто и обычно не имеют тенденции к дальнейшему росту. Однако с течением времени некоторые аденомы увеличиваются и их морфология изменяется. В желудочно-кишечном тракте гиперпролиферирующие клетки синтезируют новую ДНК под воздействием содержимого желудочно-кишечного тракта. В норме пролиферация происходит в основании крипты, поэтому вновь образующиеся клетки защищены от содержимого просвета кишечника и продуктов метаболизма бактерий. Отсутствие регуляции клеточного роста приводит к накоплению мутировавших клеток, ускорению появления повреждений эпителия и, в свою очередь, усилению клеточного роста. Образование аденом в толстой кишке носит обратимый характер. Так, у больных с наследственным аденоматозным полипозом после субтотальной колонэктомии наблюдалось спонтанное исчезновение небольших аденом. Это — генетически детерминированное заболевание, при котором мутировавший ген находится в АРС- локусе. Это приводит к появлению большого количества полипов (аденом) либо карциномы на ранней стадии развития. У больных со множеством аденом толстой кишки возможна их регрессия на фоне приема нестероидных противовоспалительных препаратов (например, сулиндака). Механизм процесса инволюции аденом неизвестен. Уже давно установлено, что небольшие аденоматозные полипы могут исчезать без лечения. Это было подтверждено при проведении колоноскопий, но в настоящее время считается, что такие аденомы являются динамической стадией развития неоплазий толстой кишки. Клональный рост клеток может быть связан с увеличением количества факторов роста, увеличением числа клеточных рецепторов, нарушением передачи сигналов от клеточной мембраны к ядру. До сих пор не известно, при какой стадии неопластический процесс может быть остановлен, когда и как происходит регресс опухоли. Малигнизация опухоли. Субстратом для опухолевого роста является гиперпролиферирующий пул клеток, который длительно подвергается воздействию канцерогенов окружающей среды. В тканях, предрасположенных к малигнизации, любое изменение генотипа может привести к началу роста опухоли. Как уже говорилось выше, существуют два генетических механизма образования рака. Оба этих механизма связаны с изменением гомеостаза клетки при репликации ДНК и хромосом. Злокачественные клетки обладают способностью постоянного роста, инвазии, образования метастазов. В отличие от доброкачественных опухолевых клеток, они не могут самопроизвольно регрессировать. Постоянный рост злокачественных клеток связан с их генетической нестабильностью. Злокачественные клетки могут в процессе жизнедеятельности терять белки, что приводит к их гибели. Этим обусловлено появление многочисленных очажков некроза в опухолях. В процессе дальнейших генетических перестроек в опухоли могут возникать другие, более жизнеспособные клетки, которые постепенно замещают строму опухоли. Вследствие выраженной фенотипической нестабильности злокачественных клеток среди них постоянно происходит отбор по способности роста, инвазии, распространения. Метастазы. Метастазирование опухолевых клеток происходит не случайно. Для этого клетки должны повредить базальную мембрану и другие окружающие их соединительные структуры. Далее клетки проникают в кровеносные и лимфатические сосуды, по ним мигрируют по организму, преодолевая действие его защитных сил. В месте будущего метастаза клетки накапливаются, выходят из сосуда и начинают разрастаться. Для осуществления этого в клетках должно произойти множество генетических изменений. Поэтому метастазы появляются на поздних стадиях развития заболевания. Для роста опухолевым клеткам необходимо постоянное кровоснабжение. Кислород может примерно на 100-400 нм проникать из сосуда в ткани, т. е. на диаметр 4—10 клеток (в зависимости от их типа). Опухоли способствуют росту и появлению новых капилляров (неоваскуляризация), что позволяет им выживать при метастазировании. Этот опухолевый ангиогенез стимулируется различными факторами роста, например действием фактора опухолевого ангиогенеза. Место метастазирования может быть случайным, зависящим лишь от кровоснабжения органа. В некоторых органах имеются специфические клеточные рецепторы, способствующие развитию опухолевых клеток. Генетические основы метастазирования еще до конца не изучены. Обнаружен ген, который присутствует в отдаленных метастазах при определенных видах рака. Ген NM23, вероятно, является супрессором метастазов и поэтому практически всегда отсутствует в отдаленных метастазах при раке толстой кишки. Клеточный механизм действия гена NM23 не известен. Скорее всего в образовании метастатического фенотипа участвует много генов, их накопление в малигнизированных клетках лежит в основе процесса диссеминации, наблюдаемом при опухолях различного происхождения.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 233; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.166.45 (0.013 с.) |