Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Глава 7. Желтуха и нарушение функции печениСодержание книги
Поиск на нашем сайте
Д. Ким Таржеон, Ричард X. Моуслей
Введение
Большинство заболеваний печени начинаются с желтухи и/или с повышения в крови маркеров поражения печени. В этой главе представлена целостная картина механизмов и диагностики заболеваний печени, ассоциированных с желтухой или нарушением функции печени. В первой части представлены основные сведения по нормальной анатомии и физиологии печени. Далее приводятся описания лабораторных тестов, позволяющих судить о различных заболеваниях печени, в соответствии с классификацией этих болезней и выделением их патофизиологических категорий. В конце главы данная клиническая проблема представлена обсуждением случая лабораторного обследования больного с синдромом желтухи.
Патофизиология
Структура и функция печени
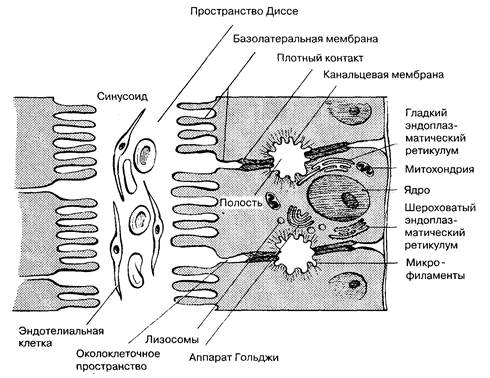
Для правильного понимания гепатобилиарной патологии необходимо знание анатомии и ультраструктуры билиарного тракта печени (рис. 7-1). Гепатоциты расположены в один ряд, образуя плотную клеточную пластинку. Гепатоциты отделены от желчных капилляров базолатеральной мембраной, а от синусоидов — синусоидальной. Из-за разницы в строении синусоидальной мембраны и мембраны, обращенной к желчному капилляру, гепатоцит является полярной клеткой. Смежные пластинки гепатоцитов отделены друг от друга синусоидами, которые выстланы эндотелиальными клетками. Отростки эндотелиальных клеток образуют поры (фенестры), служащие для прямого контакта плазмы и гепатоцита с синусоидальной мембраной. В отличие от других типов эндотелия, синусоидальный эндотелий не имеет базальной мембраны. Это способствует переносу белковосвязанных веществ (билирубина и желчных кислот) из синусоидов в пространство Диссе и, в дальнейшем, в гепатоцит, а также ускоряет экскрецию липопротеинов из гепатоцита в синусоиды. В печени алкоголика в синусоидах снижается число фенестр, что приводит к нарушению обмена веществами между гепатоцитом и кровью синусоидов.
Рис. 7-1. Особенности структуры желчного секреторного аппарата. (Но: Yamada Т., Alpers D. Н., Owyang С., Powell D. W., Silvcrstein Е., eds. Textbook ot Gastrocntcrology, 2nd ed. Philadelphia: J. B. Lippincott, 1995; 386.)
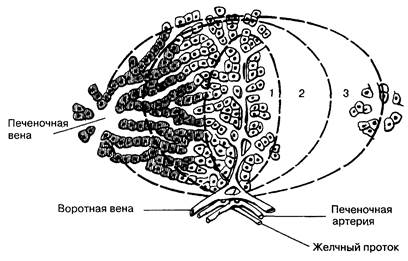
Таким образом, функционально синусоидальная мембрана вовлечена в процесс двухстороннего переноса веществ. Транспортные процессы включают захват аминокислот, глюкозы, органических анионов, таких как желчные и жирные кислоты билирубина, для последующих рецептор-опосредованных внутриклеточных реакций. На синусоидальной мембране гепатоцита находятся специфичные транспортеры, в частности Na,K-АТФаза, и происходят процессы выделения альбумина, липопротеидов и факторов свертывания крови. В отличие от нее, основной функцией мембраны, обращенной в желчные капилляры, является секреция желчи, но всасывающая способность этой мембраны ограничена. На этой же части мембраны гепатоцитов расположены специфические ферменты: щелочная фосфатаза, лейцинаминопептидаза, g-глютамилтранспептидаза. Из капилляров желчь попадает в терминальные желчные протоки, каналы Геринга, выстланные полигональными клетками "закрытой" связи с расположенными рядом гепатоцитами. Эти короткие протоки постепенно соединяются в более крупные протоки, затем в интралобулярные протоки, выстланные кубическим эпителием и имеющие диаметр 30—40 мкм. Из них желчь поступает в общий желчный проток и далее в желчный пузырь и двенадцатиперстную кишку. Основные функции желчного пузыря: (1) концентрация и депонирование желчи между приемами пищи; (2) эвакуация желчи посредством сокращения гладкомышечной стенки желчного пузыря в ответ на стимуляцию холецистокинином; (3) поддержание гидростатического давления в желчных путях. Желчный пузырь обладает способностью десятикратно концентрировать желчь. В результате этого образуется пузырная, изотоничная плазме желчь, но содержащая более высокие концентрации натрия, калия, желчных кислот, кальция и более низкие — хлоридов и бикарбонатов, чем печеночная желчь. Особенностью архитектоники печени является образование гепатоцитами ацинусов, которые разделены на три функциональные зоны (рис. 7-2). В первой зоне гепатоциты прилежат к портальному тракту, следовательно, соприкасаются с синусоидами и содержат более высокие концентрации кислорода и питательных веществ. Наоборот, клетки третьей зоны, расположенные в околоцентральной области вокруг терминальной печеночной вены, содержат меньшее количество кислорода. Как следствие, ишемия может привести к некрозу гепатоцитов, расположенных в центральной зоне. Клетки третьей зоны активно участвуют в метаболизме и выведении лекарств, и, следовательно, гепатотоксичные препараты приводят к некрозу гепатоцитов этой зоны.
Рис. 7-2. Печеночный ацинус. Его ось формируется терминальной веточкой воротной вены, печеночной артерией, желчным протоком. Кровь вначале поступает в синусоиды в зону 1, далее — в зону 2, затем — в зону 3, после чего покидает ацинус через печеночную вену. (По: Traber P. G., ChianaleJ., Gumucio J.J. Physiologic significance and regulation of hepatoccllular heterogeneity. Gastroenterology 95: 1131,1988.)
Метаболизм лекарств
Считается, что примерно 2 % всех случаев желтух у госпитализированных больных — лекарственного происхождения. Выделяют две фазы метаболизма лекарственных препаратов в печени. Первая представляет собой связанные с цитохромом Р450 окислительно-восстановительные реакции, которые модифицируют лекарства. Вторая фаза включает конъюгацию лекарств водорастворимыми веществами, такими как глюкуроновая кислота, сульфаты и глутатион. Препараты могут метаболизироваться последовательно в фазах 1 и 2 или только в фазе 2. При заболеваниях печени реакции фазы 1 почти целиком вытесняются реакциями фазы 2. Цитохром Р450 принадлежит к семейству гемопротеинов и локализован в эндоплазматическом ретикулуме гепатоцитов в мембраносвязанной форме. Несмотря на обычно детоксицирующее действие цитохрома Р450, в процессе метаболизма лекарств в результате микросомального окисления образуются токсические компоненты, такие как свободные радикалы. Если они не подвергаются дальнейшему метаболизму, то могут связываться с клеточными белками, а также стимулировать перекисное окисление липидов мембран. Конъюгация с глутатионом ускоряется ферментами цитоплазмы, глутатион-S-трансферазами, которые играют важную роль в детоксикации электрофильных компонентов, образующихся при участии системы цитохрома Р450. Чаще всего к процессам биотрансформации в печени относятся глюкуронидация и сульфатация при помощи ферментов микросомальной уридиндифосфатглюкуронилтрансферазы и цитозольной сульфотрансферазы соответственно. Воздействие лекарственных препаратов на ферменты, участвующие в метаболизме лекарств, стимулирует активность этих ферментов. Такая активация может быть клинически значимой, если в результате реакции ферменты индуцируют образование токсических метаболитов. Например, хроническое воздействие алкоголя приводит к активации цитохрома Р450, который окисляет ацетаминофен до токсических продуктов, чем объясняется повышенная чувствительность алкоголиков к токсическому воздействию ацетаминофена.
Метаболизм билирубина
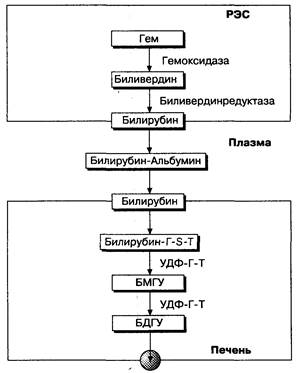
Желтуха проявляется желтой окраской кожи, слизистых оболочек, мочи и полостных жидкостей при участии билирубина. Для правильной дифференциальной диагностики желтух необходимо знать фундаментальные физиологические основы образования и экскреции билирубина. Билирубин образуется при разрушении гема (рис. 7-3): примерно 80 % — при разрушении гема эритроцитов, 20 % — при разрушении других гемопротеинов, таких как миоглобин, тканевые цитохромы. Микросомальный фермент — гемоксигеназа — превращает гем в биливердин, который под действием биливердинредуктазы превращается в билирубин. Образовавшийся в результате этих реакций неконъюгированный билирубин транспортируется кровью при помощи альбумина. Вытеснение лекарственными препаратами билирубина из связей с альбумином у новорожденных приводит к диффузии неконъюгированного билирубина через гематоэнцефалический барьер и к билирубиновой энцефалопатии или к истинной желтухе. Неконъюгированный билирубин поступает в печень, где из него образуется конъюгированный водорастворимый билирубиндиглюкуронид. Этот процесс облегчает экскрецию конъюгированного билирубина в желчь и катализируется микросомальным ферментом UDP-глюкуронилтрансферазой.
Рис. 7-3. Метаболизм билирубина. Превращение гема в биливердин под действием микросомальных оксидаз происходит преимущественно в ретикулоэндотелиальных клетках селезенки. В дальнейшем биливердин подвергается окислению цитозольной биливердинредуктазой с образованием билирубина. Неконъюгированный билирубин циркулирует в плазме, связанный, в основном, с альбумином. После диссоциации билирубин захватывается печенью, где он связывается с цитозольными белками, глутатион-S-трапсферазами. Глюкуронидизация билирубина катализируется микросомальной UDP-глюкуронилтрансферазой, что приводит к образованию моно- (БМГУ) и диглюкуронида билирубина (БДГУ). Конъюгированный билирубин экскретируется в желчь. Таблица 7-1. патофизиологическая классификация желтух
|
||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 399; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.108 (0.012 с.) |