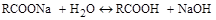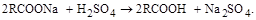Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Физико-химические свойства мыл и их водных растворовСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
а) Консистенция: В зависимости от природы и свойств жирового сырья и жирозаменителей, щёлочи, а также содержания жирно-кислых солей в нём, получаемые мыла могут иметь твердую, мягкую или мазеобразную консистенцию. Обычно, на основе твердых жирных кислот получают твердые мыла, на основе жидких жирных кислот – мягкие или мазеобразные. При использовании в качестве щёлочи едкого кали или поташа (К2СО3) образуются мыла более мягкие, (т.е. при одинаковой природе кислотного радикала и концентрации солей жирных кислот в нём, такие мыла имеют меньшую температуру плавления). Данный эффект связан с тем явлением, что атомный радиус калия намного больше атомного радиуса натрия, что мешает более плотной упаковке молекул образующегося мыла в пространстве и приводит к аморфному (неупорядоченному) состоянию; б) Температура плавления: Чистые, абсолютно безводные мыла характеризуются весьма высокой температурой плавления, находящейся в пределах 225-2700С, зависящей от природы используемых жирных кислот и природы щелочного металла. Присутствие в мыле воды снижает его температуру плавления и в тем большей степени, чем больше доля воды в нём. Например, хозяйственное 60% по содержанию жирнокислотных солей мыло (40% мас. влаги в нём), плавится уже при температуре ниже 1000С. в) Плотность: Плотность мыла зависит от степени упорядоченности его макромолекул (кристаллизации) в пространстве и обусловливается, содержанием в мыле солей жирных кислот, количества воды, природы щелочного металла, составом жировой основы, количеством электролитов в нём. Например, плотность 60% мыла при 90–950С, в жидком состоянии равна 970 кг/м3. При наличии в мыле избытка электролитов, сверх допустимых значений – плотность его возрастает; г) Гигроскопичность: Мыла являются гигроскопичными продуктами. Причём, калиевые, в большей степени, чем натриевые; мыла на основе ненасыщенных жирных кислот, в большей степени, чем на основе насыщенных. Этот показатель интересен тем, что поглощая влагу, мыло набухает, увеличиваясь в объёме, вплоть до полного растворения. Кроме того, процесс набухания сопровождается выделением соответствующего количества тепла, что в определённых условиях, при поглощении мыльной стружкой влаги или при хранении смеси сухой и влажной стружки мыла, может привезти к обугливанию и даже самовозгоранию, с большими негативными последствиями; д) Растворимость в воде и спиртах: Растворимость мыл в воде зависит от целого ряда факторов. Мыла на основе низкомолекулярных кислот растворяются в воде быстрее и в большей концентрации, чем мыла на основе высокомолекулярных жирных кислот. Растворимость в воде мыл на основе высокомолекулярных жирных кислот, в присутствии мыл на основе низкомолекулярных жирных кислот, растёт. Мыла на основе ненасыщенных жирных кислот растворяются лучше, чем мыла на основе насыщенных кислот. Хорошей растворимостью в воде характеризуются мыла на основе нафтеновых и смоляных жирных кислот. Калиевые мыла обладают лучшей растворимостью, чем натриевые. С повышением температуры растворимость мыл в воде возрастает. Что касается мыл тяжелых, щелочно-земельных металлов, то они в воде нерастворимы и их присутствие в товарном мыле недопустимо. Мыла хорошо растворяются в спирте, особенно при повышенных температурах, образуя при этом истинные растворы. В серном эфире, бензине, ацетоне и других органических растворителях мыла практически не растворяются. Зато кислые мыла наоборот – растворяются хорошо. Такие органические вещества, как фенол, крезол, гексалин и другие хорошо растворяются в водных мыльных растворах, особенно с повышенной концентрацией мыла. Мыла, будучи по своей природе, солями сильного основания и слабой органической кислоты, в водном растворе гидролизуются по схеме:
давая свободную щёлочь и слабую органическую кислоту. Именно это и обусловливает как электропроводность, так и щелочную реакцию водных мыльных растворов. Одновременно, молекула жирной кислоты (если концентрация мыльного раствора не слишком мала), с молекулами негидролизованного мыла образует кислое мыло, по выше указанной схеме. С повышением молекулярной массы жирной кислоты мыла, температуры раствора, с понижением концентрации мыльного раствора, гидролиз мыл усиливается. Причём, поскольку ненасыщенные жирные кислоты более сильные чем насыщенные, то гидролиз мыл на их основе протекает слабее. Намного сильнее гидролизуются мыла на основе смоляных жирных кислот. Если в водный мыльный раствор вести щёлочь(в виде NaOH, Na2CO3, силиката натрия и др.), то уравнение процесса гидролиза мыла сдвигается влево, вплоть до полного подавления его. Аналогично, снижает или полностью подавляет процесс гидролиза мыл введение в мыльные растворы этилового спирта, особенно в количестве более 60% мас. е) Реакции разложения мыл: Минеральные кислоты, как более сильные, разлагают мыла с выделением свободных жирных кислот по схеме:
Эту реакцию часто используют при разложении доомыленных соапстоков или грязных мыл с выделением жирных кислот и последующей их дистилляцией. Получаемые чистые жирные кислоты могут быть использованы даже для изготовления основы туалетных мыл. Слабые кислоты, в частности угольная, при низкой температуре, частично разлагают натриевое мыло с образованием бикарбоната натрия и кислого мыла. В горячих растворах такого разложения мыл не наблюдается. Мыла могут вступать в реакции обменного разложения. В частности, калиевые мыла при обработке поваренной солью можно превратить в натриевые и наоборот. Растворы солей тяжелых или щелочноземельных металлов вступают в реакции обменного разложения с обычными растворами мыл по схеме:
с образованием нерастворимых в воде щелочноземельных мыл. и) Вязкость водных мыльных растворов: Вязкость водных мыльных растворов снижается с повышением температуры и возрастает с повышением концентрации мыла вплоть до затвердевания. Введение в мыльные растворы небольшого количества электролитов способствует понижению вязкости, а большое количество приводит к изменению структуры водных клеевых мыльных растворов, повышению вязкости и последующей высолке мыла.
|
||||
|
Последнее изменение этой страницы: 2016-04-08; просмотров: 3604; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.58.141 (0.007 с.) |