
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Классификация галогенопроизводных углеводородовСодержание книги
Поиск на нашем сайте
Классификация галогенопроизводных углеводородов
Галогенопроизводные углеводородов могут быть: 1. по природе радикала - предельными; - непредельными; - ароматическими. 2. по числу атомов галогена в молекуле - моно-; - ди-; - полигалогенопроизводные. 3. по природе галогена - хлор-; - бром-; - йод-; - фторпроизводные. 4. по характеру атома углерода, с которым связан галоген - первичными; - вторичными; - третичными.
Изомерия галогенопроизводных предельных углеводородов
Галогенопроизводные предельных углеводородов носят название алкилгалогениды или галогеналканы. Общая формула гомологического ряда галогенопроизводных предельных углеводородов СnH2n+1Hal (формулы и названия г.р. приведены в приложении В). Для галогенопроизводных предельных углеводородов характерны изомерии: - углеродного скелета; - положения функциональной группы.
Номенклатура галогенопроизводных предельных углеводородов
Галогеналканы называют по рациональной и международной номенклатурам. Согласно международной номенклатуре – выбирают главную цепь. Нумеруют цепь с того конца, к которому ближе углерод, содержащий галоген. Название галогеналканов строится следующим образом: цифрой указывают положение галогена, записывают его название, а затем название пронумерованной цепи по названию соответствующего алкана. Например
Способы получения галогенопроизводных предельных углеводородов
Предельные галогенопроизводные могут быть получены: 1) галогенированием алканов 2) гидрогалогенированием алкенов 3) взаимодействием спирта с галогеноводородом
Вопросы для самоконтроля
1. Какие вещества называют галогенопроизводными? галогеналканами? 2. Какова общая формула галогеналканов? 3. По каким признакам классифицируют галогенопроизводные? Приведите примеры. 4. Какие виды изомерии характерны для галогеналканов? 5. Какие виды номенклатур характерны для галогеналканов? 6. Чем определяются химические свойства галогенопроизводных? Что называется функциональной группой? 7. Какие типы реакций характерны для галогенопроизводных предельных углеводородов? Почему? 8. Какие области применения находят галогеналканы?
9. Назовите основные способы получения галогенопроизводных предельных углеводородов.
Тема 3.2 Гидроксильные соединения и их производные
Студент должен: знать: - общую формулу предельных одноатомных спиртов; - номенклатуру и виды изомерии предельных одноатомных спиртов; - способы получения и химические свойства спиртов; - качественные реакции на многоатомные спирты и фенол; уметь: - писать изомеры и называть спирты; - писать уравнения реакций получения и свойств спиртов. Классификация гидроксильных производных, функциональная группа. Гомологический ряд предельных одноатомных спиртов. Изомерия и номенклатура. Общие способы получения спиртов. Физические и характерные химические свойства спиртов. Реакции образования простых и сложных эфиров. Дегидратация спиртов. Реакции окисления. Отдельные представители спиртов. Многоатомные спирты. Этиленгликоль, глицерин. Их получение и применение. Фенол. Получение. Физические и характерные химические свойства фенола: по фенольному гидроксилу и бензольному кольцу. Простые эфиры. Диэтиловый эфир.
Методические рекомендации
Гидроксильные соединения – производные углеводродов, в молекулах которых один или несколько атомов водорода замещены на гидроскильные группы. Группа –ОН является функциональной группой.
Классификация гидроксильных производных
Гидроксильные производные могут быть: 1. по природе углеводородного радикала - спиртами; - фенолами; - ароматическими спиртами. 2. по количеству замещенных атомов водорода - одноатомными; - двухатомными; - многоатомными.
Классификация спиртов
Спирты могут быть: 1. по природе радикала - предельными; - непредельными. 2. по количеству гидроксильных групп - одноатомными; - двухатомными; - многоатомными. 3. по характеру атома углерода, с которым связана гидроксильная группа - первичными; - вторичными; - третичными.
Спирты
Спирты – производные алифатических углеводородов, в молекулах которых один или несколько атомов водорода замещены на гидроксильную группу. Общая формула одноатомных спиртов R – OH. Ароматические спирты – производные ароматических углеводородов, в молекулах которых гидроксильная группа находится в боковой цепи бензольного кольца.
Пример бензиловый спирт Многоатомные спирты
Из многоатомных спиртов наибольшее значение имеют двухатомные спирты (гликоли) – например, этиленгликоль и трехатомный спирт – глицерин Химические свойства этих соединений определяются присутствием двух (или трех) гидроксильных групп: они могут вступать во все химические реакции, характерные для одноатомных спиртов с участием одной, двух или трех спиртовых групп. Присутствие нескольких функциональных групп усиливает кислый характер гликолей и глицеринов по сравнению с одноатомными спиртами. Поэтому они образуют растворимые в воде гликолята и глицерата не только со щелочными металлами, но и с гидроксидами металлов, например с гидроксидом меди (II). Реакция с гидроксидом меди (II) является качественной реакцией на многоатомные спирты.
Фенолы
Фенолы – производные ароматических углеводородов, в молекулах которых гидроксильная группа связана с бензольным кольцом. Простейшим представителем фенолов является фенол (оксибензол)
Фенолы – реакционноспособные соединения, реакции с ними могут проходить как по гидроксильной группе, так и по ароматическому кольцу.
1. Реакции, идущие по гидроксильной группе а) взаимодействие раствором хлорида железа (III) – образуется фенолят железа (III), имеющий интенсивную фиолетовую окраску. Данная реакция является качественной на фенолы. б) взаимодействие с раствором гидроксида натрия (кислотный характер), поэтому раствор фенола называют карболовой кислотой.
2. Реакции, идущие по ароматическому кольцу К ним относятся: а) галогенирование Взаимодействие с бромной водой является качественной реакцией на фенолы. Образуется белый осадок. б) нитрование в) сульфирование Такие реакции в фенолах проходят легче, чем для ароматических углеводородов. Поскольку гидроксильная группа в ароматическом кольце является заместителем I рода, то преимущественно образуются орто- и пара- замещенные продукты.
2,4,6-тринитрофенол (пикриновая кислота) Для фенолов также характерны реакции присоединения (каталитическое гидрирование) и окисление хромовой смесью.
Практическое занятие
Вопросы для самоконтроля
1. Какие вещества относят к гидроксильным? 2. Какие вещества называют спиртами? 3. Какова общая формула спиртов? 4. По каким признакам класифицирую спирты? Приведите примеры. 5. Какие виды изомерий характерны для предельных одноатомных спиртов? 6. Какие виды номенклатур характерны для предельных одноатомных спиртов? 7. Чем определяются химические свойства спиртов? 8. Какие типы реакций характерны для спиртов? 9. Чем отличаются химические свойства одноатомных спиртов и многоатомных спиртов? 10. Назовите общие способы получения спиртов. 11. Назовите области применения спиртов. 12. Какие вещества называют фенолами? 13. Назовите простейший представитель фенолов. 14. Назовите способы получения фенола. 15. Назовите свойства, отличительные от одноатомных спиртов. 16. Какие качественные реакции характерны для многоатомных спиртов? фенолов?
Практическое занятие
Вопросы для самоконтроля
1. Какие вещества относятся к карбонильным? 2. Какие вещества называют альдегидами? кетонами? 3. Какова общая формула альдегидов? кетонов? 4. Какие виды изомерий характерны для альдегидов? кетонов? 5. Какие виды номенклатур характерны для альдегидов? кетонов? 6. Чем определяются химические свойства альдегидов и кетонов? 7. Какие типы реакций характерны для альдегидов и кетонов? 8. Чем химические свойства альдегидов отличаются от химических свойств кетонов? Почему? 9. Назовите способы получения альдегидов и кетонов. 10. Назовите области применения альдегидов и кетонов.
Изомерия карбоновых кислот
1. Общая формула гомологического ряда предельных одноосновных карбоновых кислот CnH2n+1COOH или CnH2nO2. Для предельных одноосновных карбоновых кислот характерны изомерии: - углеродного скелета; - межклассовая (предельные одноосновные кислоты изомерны сложным эфирам).
Пример
Напишите по одному изомеру на каждый вид для вещества следующего строения
1 изомер – углеродного скелета – меняем строение, делаем углеродную цепь разветвленной
2 изомер – межклассовый – строим формулу сложного эфира, в составе которого 4 атома углерода
Общая формула гомологического ряда непредельных одноосновных карбоновых кислот CnH2n-1COOH. Для непредельных карбоновых кислот характерны изомерии: - углеродного скелета; - положения двойной связи.
Галогеноангидриды
Это производные карбоновых кислот, в молекулах которых гидроксил карбоксильной группы замещены на галоген. Общая формула Названия галогеноангидридов производятся от названий соответствующих кислот или от названия соответствующих ацильных остатков, перед которыми ставится слово «бромистый», «йодистый», «хлористый». Например Ангидриды
Это производные карбоновых кислот, в молекулах которых водород гидроксила карбоксильной группы замещен на ацил. Общая формула Названия ангидридов производятся от названий соответствующих кислот. Например
Амиды
Это производные карбоновых кислот, в молекулах которых гидроксил карбоксильной группы замещен на аминогруппу. Общая формула Названия амидов производятся от названий соответствующих кислот. Например
Сложные эфиры
Это производные карбоновых кислот, в молекулах которых водород гидроксила карбоксильной группы замещен на углеводородный радикал. Общая формула Названия сложных эфиров складывается из соответствующих названий кислоты и спирта или от названия сначала спиртового радикала ( Например
Практическое занятие
Вопросы для самоконтроля
1. Какие органические вещества относят к карбоновым кислотам? 2. Как классифицируют карбоновые кислоты? Приведите примеры. 3. Какая общая формула предельных одноосновных карбоновых кислот? непредельных одноосновных кислот? двухосновных? 4. Какие виды номенклатур характерны для карбоновых кислот (предельных, непредельных, двухосновных)? 5. Какие виды изомерий характерны для одноосновных карбоновых кислот? 6. В чем проявляется сходство карбоновых кислот и минеральных? 7. Какие типы реакций характерны для одноосновных карбоновых кислот? 8. Назовите способы получения карбоновых кислот. 9. Где находят применение карбоновые кислоты? Перечислите области их использования. 10. Какие органические вещества относят к производным карбоновых кислот? 11. Назовите способы получения производных карбоновых кислот.
Нитросоединения
Нитросоединения – производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на нитрогруппу. В общем виде формула нитросоединений R – NO2.
Амины
Амины – производные аммиака, в молекулах которых один или несколько атомов водорода замещены углеводородными радикалами.
Классификация аминов
Амины могут быть: 1. по природе радикала - предельными; - непредельными; - ароматическими. 2. по числу замещенных атомов водорода в аммиаке - первичными R – NH2 - вторичными R – NH – R - третичными Изомерия аминов
Изомерия аминов определяется строением углеводородного скелета и положением аминогруппы.
Номенклатура аминов
Амины называют по рациональной номенклатуре. Согласно рациональной номенклатуре – дают название углеводородного радикала с добавлением суффикса –амин. Например,
Способы получения аминов
Амины широко применяют в технике и лабораторной практике, поэтому разработано много способов их получения. К основным способам получения аминов относят: 1) восстановление нитросоединений в присутствии катализаторов Ni, Pt, Pd или смеси Этим способом можно получить только первичные амины. 2) аминирование галогенопроизводных углеводородов – взаимодействие галогенопроизводных углеводородов с избытком аммиака. Этим способом можно получить первичные, вторичные и третичные амины предельного ряда.
Вопросы для самоконтроля
1. Дайте определение нитросоединениям, аминам. 2. Какая общая формула нитросоединений? предельных мононитросоединений? 3. Какая общая формула первичных аминов? вторичных аминов? третичных аминов?
4. Какие виды изомерий характерны для предельных мононитросоединений? аминов? 5. Какие виды номенклатур характерны для предельных мононитросоединений? аминов? 6. Назовите способы получения нитросоединений. 7. Какие реакции характерны для нитросоединений? 8. Назовите способы получения аминов. 9. Какие реакции характерны для аминов? 10.Где применяются нитросоединения? анилин?
Моносахариды
Моносахариды – простейшие углеводы. Они являются строительными элементами олигосахаридов и полисахаридов.
Классификация моносахаридов
Монозы принадлежат к альдегидоспиртам (альдозы) и кетоспиртам (кетозы).
n = 1 – 5 n = 1 – 4
В зависимости от числа атомов углерода в молекуле различают триозы Наиболее важным из моносахаридов являются пентозы (в частности, рибоза и ее восстановленная форма – дезоксирибоза) и гексозы (глюкоза, фруктоза).
Строение моносахаридов
Первые представления о структуре моносахаридов связаны с оксо-формой – альдегидо- и кетоспиртами. Для их изображения обычно используют проекционные формулы Э. Фишера, позволяющие представить расположение водорода и гидроксильных групп в пространстве относительно ассиметрических атомов углеродной цепи.
Кроме этого для наглядного изображения моносахаридов в пространстве используют «перспективные» формулы Хеуорса.
Дисахариды
Биозы являются природными веществами. Состав их выражается формулой К окислению дисахариды относятся по-разному. Одни дисахариды не способны к таутомерии и к окислению, так как эфирная связь между двумя остатками глюкозы образована с участием обоих полуацетальных гидроксидов. Такие биозы относят к невосстанавливающим сахарам. К ним относится сахароза. Другие способны к таутомерии и окислению, так как для образования эфирной связи принимают участие полуацетальный гидроксил одного моносахарида и спиртовая группа другого. Такие биозы называют восстанавливающими сахарами. К ним относятся мальтоза и лактоза (молочный сахар). Для всех биоз, как и моноз, идут реакции алкилирования и ацилирования с образованием соответственно простых и сложных эфиров, которые используются в производстве пластмасс и при изготовлении стекла триплекс.
Полисахариды
Полиозы – макромолекулярные соединения, представляющие собой продукты конденсации большого числа одинаковых или разных молекул моносахаридов. Наиболее распространенными в природе являются крахмал и целлюлоза (клетчатка). Они построены из остатков глюкозы. Состав их выражается формулой Крахмал широко применяется в химической промышленности, являясь сырьем не только для получения глюкозы, но и этилового, бутилового спиртов, глицерина, молочной и лимонной кислот и других продуктов. При действии на него раствора йода появляется синее окрашивание, что используется как качественная реакция на присутствие крахмала. От крахмала целлюлоза отличается β-конфигурацией связи между циклами и линейным характером цепей. Целлюлозу используют для изготовления бумаги, искусственного волокна, пластмасс и различных сортов пороха.
Вопросы для самоконтроля
1. Какие вещества называются углеводами? 2. Как классифицируют углеводы? Приведите примеры. 3. Какие углеводы относят к моносахаридам? Приведите примеры. 4. Какая молекулярная формула глюкозы? Какими еще формулами можно изобразить молекулу глюкозы? 5. Какие физические свойства глюкозы? 6. Какая существует качественная реакция на глюкозу? 7. Назовите области применения глюкозы? 8. Какие углеводы относят к дисахаридам? Приведите примеры. 9. Какие дисахариды называют восстанавливающими? Приведите примеры. 10. Какие дисахариды называют невосстанавливающими? Приведите примеры. 11. Какая молекулярная формула сахарозы? 12. Какие физические свойства сахарозы? 13. Назовите области применения сахарозы? 14. Какие углеводы относят к полисахаридам? Приведите примеры. 15. В чем сходство и отличие крахмала и целлюлозы (по составу молекул, по строению, по физическим свойствам, химическим свойствам)? 16. Какая существует качественная реакция на крахмал? 17. Как получают в промышленности крахмал? Целлюлозу? 18. Назовите области применения крахмала? целлюлозы?
Вопросы для самоконтроля
1. Какие вещества называются полимерами? 2. По какому принципу классифицируются полимеры? 3. Какие полимеры называют термопластичными? Приведите примеры. 4. Какие полимеры называют термореактивными? Приведите примеры. 5. Что такое полимеризация, поликонденсация? Чем отличаются друг от друга реакции? 6. Назовите области применения полимеров.
Классификация галогенопроизводных углеводородов
Галогенопроизводные углеводородов могут быть: 1. по природе радикала - предельными; - непредельными; - ароматическими. 2. по числу атомов галогена в молекуле - моно-; - ди-; - полигалогенопроизводные. 3. по природе галогена - хлор-; - бром-; - йод-; - фторпроизводные. 4. по характеру атома углерода, с которым связан галоген - первичными; - вторичными; - третичными.
|
|||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 4379; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.190.239.38 (0.009 с.) |

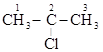 2-хлорпропан
2-хлорпропан
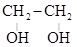 (этандиол-1,2)
(этандиол-1,2)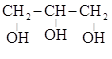 (пропантриол-1,2,3)
(пропантриол-1,2,3)
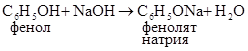
 Например:
Например:



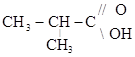 2-метилпропановая кислота
2-метилпропановая кислота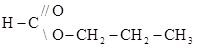 пропиловый эфир муравьиной кислоты
пропиловый эфир муравьиной кислоты , где
, где 
 хлорангидрид уксусной кислоты (хлористый ацетил)
хлорангидрид уксусной кислоты (хлористый ацетил) где
где 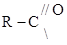 называется ацилом
называется ацилом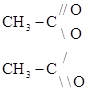 уксусный ангидрид
уксусный ангидрид , где
, где  - аминогруппа
- аминогруппа амид уксусной кислоты
амид уксусной кислоты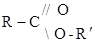 , где
, где  - углеводородный радикал
- углеводородный радикал уксуснометиловый эфир (метилацетат)
уксуснометиловый эфир (метилацетат)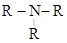
 - пропиламин
- пропиламин .
. и
и 
 , тетрозы
, тетрозы  , пентозы
, пентозы  , гексозы
, гексозы  и гептозы
и гептозы  .
.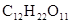 .
. , где n достигает величины сотен и тысяч.
, где n достигает величины сотен и тысяч.


