Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Распространение антраценпротводных в растительном мире,Содержание книги
Поиск на нашем сайте Распространение антраценпротводных в растительном мире, Роль для жизни растений. АП широко распространены в растительном мире. По данным В.А.Стихина и А.И. Баньковского в растениях обнаружено около 200 веществ этой группы. Наиболее часто встречаются в высших растениях семейств Fabaceae, Hypericaceae, Liliaceae, Polygonaceae. Также они обнаружены в грибах, лишайниках, различных видах плесени, насекомых и морских животных. Наиболее важной функцией АП является их участие в окислительно-восстановительных процессах, протекающих в растениях. Также они выполняют защитную функцию от различных микроорганизмов, насекомых (обладают антибиотическими свойствами); стимулируют образование полисахаридов в растениях. Биосинтез антраценпротводных, локализация, влияние факторов на накопление антраценпротводных в растениях. Биосинтез АП происходит по общему пути образования фенольных соединений. В 60-е годы Берч и Донован выдвинули ацетатную теорию биосинтеза АП, согласно которой, в растениях происходит конденсация ацетатных остатков с последующей их циклизацией. Позднее эта версия была подтверждена методом меченых атомов. В настоящее время установлено, что существует 2 пути образования АП в растениях: 1.По ацетатно-малонатному пути образуются АП в низших растениях 2.По смешанному пути происходит образование производных ализарина В растениях АП растворены в клеточном соке и локализованы преимущественно в основной паренхиме, сердцевине и сердцевинных лучах. Накопление АП происходит в листьях, побегах, травах, плодах, подземных органах, коре. Содержание АП в растениях колеблется от 2% до 6%. В растениях АП встречаются как в свободном состоянии, так и в виде гликозидов. Чаще образуют О-гликозиды, реже - С-гликозиды (алоин из листьев алоэ древовидного). В качестве сахарного компонента могут выступать глюкоза, рамноза, арабиноза, ксилоза. В зависимости от количества и места присоединения сахарных остатков, АП делят на монозиды, биозиды и дигликози-ды. Наиболее часто в образовании гликозидов участвуют -ОН группы в положениях 1,3,6,8. На накопление АП влияют условия внешней среды, возраст и фаза развития растения. Установлено, что максимальное содержание АП в подземных органах наблюдается на 2,3-ий или 4-ый год жизни, после чего содер-жание АП снижается. В ходе вегетативного развития растений происходит изменение в качественном и количественном отношении: осенью преимущественно накапливаются гликозиды антрахинонов, а летом и весной - свободные агликоны; в молодых растениях (в начале вегетации) преобладают восстановленные формы, а в старых (к концу вегетационного периода) - окисленные. Так, в листьях сенны, траве зверобоя максимальное содержание АП наблюдается в период цветения. Данные закономерности указывают на активное участие АП в окислительно-восстановительных процессах. Это свойство необходимо учитывать при заготовке и применении сырья крушины. Собранная весной Cortex Frangulae содержит преимущественно восстановленные формы АП, которые при использовании вызывают тошноту и рвоту. Поэтому кору крушины перед применением выдерживают в течение 1 года при обычных условиях хранения или в течение 1 часа при 100-105°С в сушильном шкафу. При этом происходит окисление восстановленных форм АП. П. Димерные соединения. Встречаются окисленные и восстановленные соединения. Молекулы димерных АП могут состоять из одинаковых (симметричные) или различных мономеров (несимметричные), связанных по кольцу В в у-положениях. Обнаружены в растениях семейства Fabaceae, Rhamnaceae. глюкоза —о о он
глюкоза —о о он
симметричные - сеннозиды А и В (стереоизомеры) содержатся в кассии остролистной Cassia acutifolia.
несимметричные - франгулярозид Франгулярозид накапливается ранней весной в коре крушины. Оценка качества сырья, содержащего антраценпроизводные. Методы анализа. Из сырья АП извлекают водой или спиртом различной концентрации. Для получения свободных агликонов, гликозиды АП в растительном сырье подвергают гидролизу, свободные агликоны извлекают этиловым эфиром или хлороформом. Для обнаружения АП в сырье используют качественные реакции и хроматографическое исследование. Качественные реакции основаны на химических свойствах: 1. Реакция образования антрахинолятов со щелочью. а) на сухом сырье - при нанесении нескольких капель 10%-ного раствора Положительный результат наблюдается, если АП присутствуют в окисленной форме. Рекомендована ГФ-XI для подтверждения подлинности Cortex Frangulae; б) с водным извлечением (1:10) - при добавлении к водному извлечению в) реакция Борнтрегера. Позволяет обнаружить эмодины в присутствии Проба основана на способности антрагликозидов подвергаться щелочному гидролизу с образованием свободных агликонов. Одновременно происходит окисление восстановленных форм. После подкисления гидролизата агликоны извлекают эфиром. Эфирный слой окрашивается в желтый цвет. При встряхивании эфирного слоя с аммиаком эмодины, имеющие гидроксильные группы в бета-положении, переходят в водный слой, окрашивая его в вишнево-красный цвет. Хризофанол остается в органическом слое, окрашивая его в желтый цвет. Предложена в ГФ-XI для подтверждения подлинности Cortex Frangulae, Folia Sennae, Fructus Rhamni catharticae, Radices Rhei, Rhizomata et radices Rubiae. 2. Реакция микросублимации (микровозгонки). Основана на способности АП возгоняться при 200°С с последующей конденсацией на холодной поверхности без изменения основной структуры. Может быть проведена в двух вариантах: в пробирке и на предметном стекле. При нанесении на сублимат раствора натрия гидроксида образуется вишнево-красное окрашивание. Дана в ГФ-XI для подтверждения подлинности Cortex Frangulae. 3.Реакция образования лаков. Основана на способности АП образовывать со спиртовым раствором магния ацетата комплексы, окрашенные в вишнево-красный цвет. Количественное определение. Все методы количественного определения АП в сырье основаны на определении свободных агликонов после кислотного гидролиза. Агликоны экстрагируют в органический растворитель и определяют различными методами.
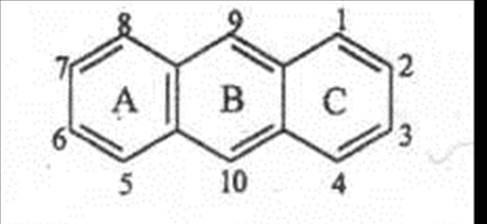
1. Фотоэлектроколориметрический метод. Основан на способности окрашенных антрахинолятов поглощать немонохроматических свет при длине волны 530-540 нм. Предложен в 1957 г. Аутергофом (Германия), модифицирован А.С. Романовой и А.И.Баньковским (НПО «ВИЛАР», 1965). Аутергоф предложил гидролиз и экстракцию агликонов объединить в одну стадию кипячением навески сырья с ледяной уксусной кислотой и последующей экстракцией диэтиловым эфиром. Стадии определения суммы производных антрацена: 1 стадия. Гидролиз АП и экстракция агликонов из сырья. 2 стадия. Получение окрашенных солей. Эфирное извлечение обрабатывают в делительной воронке отдельными порциями щелочно-аммиачного раствора (5% раствор NaOH, содержащий 2% раствора NH4OH). АП в виде окрашенных антрахинолятов переходят в водную фазу; обрабатывают до тех пор, пока последняя порция щелочно-аммиачного раствора не будет оставаться бесцветной. 3 стадия. Окисление восстановленных форм АП. Для перевода всех форм АП в окисленные, часть щелочно-аммиачного раствора антрахинолятов нагревают на водяной бане в течение 15 мин. Восстановленные формы окисляются кислородом воздуха и вступают в реакцию со щелочно-аммиачным раствором, окраска становится интенсивнее (сырье крушины и ревеня). В сырье марены красильной окисление восстановленных форм проводят пергидролем. 4 стадия. Измерение оптической плотности окрашенных антрахинолятов с по Содержание АП в сырье (%) рассчитывают по калибровочному графику, построенному по кобальта хлориду (СоСI2), в пересчете на истизин. Фотоэлектроколориметрический метод рекомендован ГФ-XI для определения содержания (%) АП в сырье крушины, ревеня, марены красильной. В корневищах и корнях марены красильной по ФС регламентируется содержание связанных производных антрацена. Количественное содержание связанных производных антрацена определяют вычитанием количества свободных производных антрацена (агликонов) из суммы производных антрацена. Количественное определение суммы производных антрацена в сырье марены красильной см.выше. При определение свободных производных антрацена отсутствует стадия гидролиза антрагликозидов. Агликоны извлекают из сырья эфиром, получают окрашенные антрахиноляты, окисляют восстановленные формы пергидролем, определяют оптическую плотность окрашенных антрахинолятов и по калибровочному графику, построенному по кобальта хлориду рассчитывают содержание свободных производных антрацена в сырье марены красильной. Антраценпроизводные Антраценпроизводные (АП) - это группа природных фенольных соединений, в основе которых лежит ядро антрацена различной степени окисленности по среднему кольцу В.
Антрацен Ализарин и его производные. Обнаружены в растениях ализарин семейств Rubiaceae, Scrophulariacea
П. Димерные соединения.
Встречаются окисленные и восстановленные соединения. Молекулы димерных АП могут состоять из одинаковых (симметричные) или различных мономеров (несимметричные), связанных по кольцу В в γ-положениях. Обнаружены в растениях семейства Fabaceae, Rhamnaceae. Глюкоза-О О ОН
Глюкоза -О О ОН симметричные- сеннозиды А и В (стереоизомеры) содержатся в кассии остролистной Cassia acutifolia.
Глюкоза-О ОН ОН ОН
несимметричные - франгулярозид Франгулярозид накапливается ранней весной в коре крушины. ОН О ОН
гиперицин (Нуреriсum perforatum, H.maculatum) Методы анализа. Из сырья АП извлекают водой или спиртом различной концентрации. Для получения свободных агликонов, гликозиды АП в растительном сырье подвергают гидролизу, свободные агликоны извлекают этиловым эфиром или хлороформом. Качественные реакции и хроматографическое исследование. Качественные реакции основаны на химических свойствах: 1. Реакция образования антрахинолятов со щелочью. а) на сухом сырье - при нанесении нескольких капель 10%-ного раствора Положительный результат наблюдается, если АП присутствуют в окисленной форме. Рекомендована ГФ-XI для подтверждения подлинности Cortex Frangulae; б) с водным извлечением (1:10) - при добавлении к водному извлечению в) реакция Борнтрегера. Позволяет обнаружить эмодины в присутствии Проба основана на способности антрагликозидов подвергаться щелочному гидролизу с образованием свободных агликонов. Одновременно происходит окисление восстановленных форм. После подкисления гидролизата агликоны извлекают эфиром. Эфирный слой окрашивается в желтый цвет. При встряхивании эфирного слоя с аммиаком эмодины, имеющие гидроксильные группы в бета-положении, переходят в водный слой, окрашивая его в вишнево-красный цвет. Хризофанол остается в органическом слое, окрашивая его в желтый цвет. Предложена в ГФ-XI для подтверждения подлинности Cortex Frangulae, Folia Sennae, Fructus Rhamni catharticae, Radices Rhei, Rhizomata et radices Rubiae. Количественное определение. Все методы количественного определения АП в сырье основаны на определении свободных агликонов после кислотного гидролиза. Агликоны экстрагируют в органический растворитель и определяют различными методами. 1. Фотоэлектроколориметрический метод. Основан на способности окрашенных антрахинолятов поглощать немонохроматических свет при длине волны 530-540 нм. Стадии определения суммы производных антрацена: 1. стадия. Гидролиз АП и экстракция агликонов из сырья. 2. стадия. Получение окрашенных солей. Эфирное извлечение обрабатывают в делительной воронке отдельными порциями щелочно-аммиачного раствора (5% раствор NaOH, содержащий 2% раствора NH4OH). АП в виде окрашенных антрахинолятов переходят в водную фазу; обрабатывают до тех пор, пока последняя порция щелочно-аммиачного раствора не будет оставаться бесцветной. 3. стадия. Окисление восстановленных форм АП. Для перевода всех форм АП в окисленные, часть щелочно-аммиачного раствора антрахинолятов нагревают на водяной бане в течение 15 мин. Восстановленные формы окисляются кислородом воздуха и вступают в реакцию со щелочно-аммиачным раствором, окраска становится интенсивнее (сырье крушины и ревеня). В сырье марены красильной окисление восстановленных форм проводят пергидролем. 4. стадия. Измерение оптической плотности окрашенных антрахинолятов с по Содержание АП в сырье (%) рассчитывают по калибровочному графику, построенному по кобальта хлориду (СоСI2), в пересчете на истизин. Фотоэлектроколориметрический метод рекомендован ГФ-XI для определения содержания (%) АП в сырье крушины, ревеня, марены красильной.
Распространение антраценпротводных в растительном мире, Роль для жизни растений. АП широко распространены в растительном мире. По данным В.А.Стихина и А.И. Баньковского в растениях обнаружено около 200 веществ этой группы. Наиболее часто встречаются в высших растениях семейств Fabaceae, Hypericaceae, Liliaceae, Polygonaceae. Также они обнаружены в грибах, лишайниках, различных видах плесени, насекомых и морских животных. Наиболее важной функцией АП является их участие в окислительно-восстановительных процессах, протекающих в растениях. Также они выполняют защитную функцию от различных микроорганизмов, насекомых (обладают антибиотическими свойствами); стимулируют образование полисахаридов в растениях.
|
||||||
|
Последнее изменение этой страницы: 2016-07-11; просмотров: 366; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.007 с.) |