
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Неионогенные моющие веществаСодержание книги
Поиск на нашем сайте
Технологический процесс их получения связан с реакцией полиприсоединения окиси этилена к соединениям, имеющим подвижный атом водорода. В качестве последних, наиболее часто используют различные жирные кислоты:
В реакции данного типа могут участвовать и жирные спирты:
Однако наиболее широкое применение нашли полиэтиленгликолевые эфиры алкилфенолов, которые выпускают под маркой ОП – с указанием цифрой количества присоединившихся молей окиси этилена (ОП–4; ОП–7; ОП–10 и т.д.). Их получают по схеме:
где: R – алкильный радикал; R1– алкильный радикал или –Н; n= от 4 до нескольких десятков. Продукты марки ОП, в зависимости от молекулярной массы, представляют собой маслообразные вязкие жидкости или легкоплавкие пасты, слабокоричневого цвета, со слабощелочной реакцией (рН 1% по массе раствора =8). Их свойства в существенной мере зависят от количества молей окиси этилена, взятых в реакцию полиприсоединения. Например: ОП–10, в котором оксиэтиленовая цепочка длинная (большая концентрация простых эфирных связей и – ОН групп) хорошо растворяется в воде. В тоже время, ОП–4, где цепочка намного короче (и соответственно меньше концентрация простых эфирных связей и – ОН групп на молекулу) в воде не растворяетсяся. Продукты марки ОП сохраняют свое моющее действие как в мягкой, так и в жесткой воде; в растворах кислот и щелочей и, поэтому, являются универсальным моющим средством. Они обладают хорошим смачивающим, пенообразующим и стабилизирующим действием и широко используются в текстильной промышленности для обработки как исходных волокон, так и готовых тканей, а также в других рецептурах моющих препаратов. Электролиты Используемые при выработке синтетических моющих средств, электролиты подразделяют на: – щелочные, в основном это натриевые (реже калиевые) соли неорганических кислот – угольной, фосфорной, кремниевой. При растворении в воде и гидролизе, они в некоторой мере повышают рН среды. Например:
Степень гидролиза таких электролитов, обычно повышается при росте температуры раствора и при снижении его концентрации. В меньшей степени, из перечисленного ряда, гидролизуется триполифосфат натрия, (рН 1% по массе раствора которого имеет величину 9,7); – нейтральные электролиты (соли сильных кислот и оснований), которые в водных растворах не гидролизуются и не меняют рН воды (Na2SO4, NaCl). Способность электролитов гидролизоваться в водных растворах имеет большое значение при выборе компонентов и составлении рецептур для моющих средств. Например: при составлении рецептур синтетических порошков для стирки ткани из шерстяных, шелковых и некоторых синтетических волокон, которые в своей структуре имеют группы или связи, чувствительные к щелочам (неустойчивые в средах), обычно используют нейтральные электролиты, иногда с небольшой добавкой триполифосфата – или гексаметофосфата натрия. Нейтральные электролиты применяют в тех случаях, когда в составе стиральных порошков используют активные сами по себе моющие средства (алкилсульфаты высших жирных спиртов) или, когда эти моющие средства используют, при стирке не очень загрязненных шерстяных, шелковых и других цветных тканей с обеспечением рН моющего раствора на уровне не выше 7–8. При стирке хлопчатобумажных, льняных и других тканей, практически малочувствительных к щелочам, в рецептуру порошков вводят щелочные электролиты, повышая при этом эффект стирки. Вследствии своей высокой эффективности, как электролиты, наиболее широко используются полифосфаты – конденсированные соли фосфорной кислоты, которые одновременно обладают: – синергетическими свойствами по отношению к моющим веществам; – комплексообразующими свойствами. Их синергетизм проявляется в том, что в процессе стирки такие электролиты способствуют усилению поверхностно-активных свойств моющих веществ и одновременно повышают степень диспергируемости и пептизирования жидкообразных загрязнений до величин намного более высоких, чем для каждого отдельного компонента соответственно. Количество, добавляемых в рецептуру состава, полифосфатов зависит от типа используемого ПАВ; от вида подлежащей стирке ткани. Например: при стирке хлопчатобумажных тканей, наибольший моющий эффект наблюдают, при избытке в рецептуре полифосфата натрия в 1–1,5 раза, по сравнению в массой сульфонола. В тоже время, при стирке шерстяных тканей такой избыток не должен превышать 10–20%мас., а при использовании неионогенных моющих веществ, количество полифосфата натрия уменьшают в 2–2,5 раза в сравнении с количеством моющего порошка на основе анионоактивного вещества. Способность полифосфатов натрия к комплексообразованию обусловлено потерею ионами Са В отношении ионов магния, комплексообразующая способность несколько ниже; с ионами тяжелых металлов еще хуже. Наиболее широко используют триполифосфат натрия (Na5P3O10), поскольку его комплексообразующая способность в 2–2,5 раза выше, чем у пирофосфата натрия. Тетрапирофосфат натрия (Na4P2O7) хотя и повышает моющее действие стиральных порошков, но одновременно способствует увеличению показателя «зольность стираемых тканей», поэтому мало используют. Гексаметафосфат натрия (NaPO3)6 в умеренно теплой воде дает рН от 6,8 до 7 (т.е. нейтральную среду, что особенно важно для шерстяных тканей, которые в щелочной или сильнокислой среде теряют свою прочность). Это позволяет вводить его в рецептуры стиральных порошков, чувствительных к рН среде. С солями кальция или магния он образует водорастворимые комплексные соединения типа Na2[Na2Ca(PO3)6]. Однако, недостатком при его применении является легкая гидролизуемость с образованием смеси из ортофосфата (NaH2PO4), пирофосфата и триполифосфата натрия. Тринатрий фосфат (Na3PO4) в водных растворах гидролизуется с рН=11–12,5 (т.е. с образованием сильнощелочной среды и его используют только для стирки грубых тканей, не реагирующих на щелочную среду). Углекислая сода (Na2CO3), также как тринатрийфосфат, в водных растворах сильно гидролизуется с достижением рН=10–11,5 и его используют в составе порошков для стирки тканей на хлопчатобумажной и льняной основе. Бикарбонат натрия (NaHCO3) характеризуется меньшей гидролизуемостью в водных растворах, давая рН на более низком уровне и используют его в составе порошков при стирке шелковых, синтетических и искусственных тканей. Силикат натрия (его водные растворы называют «жидким стеклом»). Силикат натрия при стирке выполняет несколько функций: – связывает соли железа, предохраняя ткани от пожелтения; – стабилизирует перекисные соли, задерживая их разложение и преждевременную потерю активности. Растворы метасиликата натрия (с отношением Na2O к SiO2 в пределах 0,97–0,98) характеризуются прекрасными очищающими свойствами и их вводят в моющие средства для мытья и чистки сильнозагрязненных тканей, оборудования, танкеров, резервуаров и др. Силикат магния, будучи в составе моющего средства, защищает от коррозии оборудование, в котором осуществляют стирку, и является обязательным компонентом таких средств. В качестве нейтрального электролита широко используют (Na2SO4), доступный продукт (получаемый при нейтрализации отходов серной кислоты кальцинированной содой) и его, в виде белого мелкокристаллического порошка, не содержащего посторонних включений, вводят в некоторые рецептуры моющих средств. Перекисные соли В составе некоторых моющих порошков (для стирки материала белого цвета и изделий на его основе) вводят перекисные соли, содержащие в своем составе, в связанном состоянии, активный кислород. В процессе стирки, в нагретой воде, такие соединения разлагаются с выделением свободного атомарного кислорода, который и отбеливает ткани до белоснежного цвета или обеспечивает удаление пятен от зелени, вина, кофе и др. загрязнений. Наиболее эффективными и широко используемыми в настоящее время являются: – перборат натрия (NaВО2 × Н2О2 × 3Н2О), который содержит до 10–10,5% массовых активного кислорода; – перкарбонат натрия (Na2СО3 × Н2О2 × 1/2Н2О) или другие, типа «персила». Все они отличаются высокой стабильностью при хранении в составе порошков и работают только в условиях использования рабочих водных растворах.
|
|||||||||||||
|
Последнее изменение этой страницы: 2016-04-08; просмотров: 989; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.210.173 (0.009 с.) |

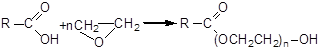
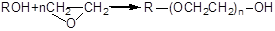
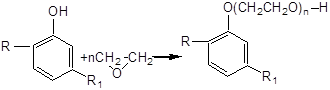
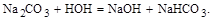
 и Mg
и Mg 


